帕金森病患者肠道菌群变化与临床特征的相关性研究
2021-06-19童巧文陈杨芳吴森翔郑丽芬陈依依冯梅叶华
童巧文 陈杨芳 吴森翔 郑丽芬 陈依依 冯梅 叶华
帕金森病是一种中老年人常见的中枢神经系统退行性疾病。帕金森病的病理特征是黑质致密部中多巴胺能神经元明显减少和路易小体形成。帕金森病临床上主要表现为肌强直、运动迟缓和震颤等运动症状,以及睡眠障碍、感觉障碍、自主神经功能紊乱及神经精神障碍等非运动症状[1]。患者出现上述症状说明体内的自主神经系统和肠神经系统相关的脑-肠轴通路可能已受到影响[2-6]。中枢神经系统和胃肠道之间存在着脑-肠轴的双向通信交流,而且越来越多的研究开始关注肠道菌群对脑-肠轴的作用[7-10]。帕金森病患者体内脑-肠-菌群轴的失调可能导致其胃肠道功能障碍[11],并促进了帕金森病的发病,这支持了Braak等[2,4]关于帕金森病病理过程是从肠道影响到大脑的假设。本研究采用高通量测序技术对帕金森病患者肠道菌群进行定量检测,分析菌群变化及与临床特征的相关性,为帕金森病的发病机制提供理论支持,现将结果报道如下。
1 对象和方法
1.1 对象 选择2017年11月至2019年2月温州市人民医院神经内科诊治的帕金森病患者30例为PD组,并选择同期医院体检中心的健康体检者30例为HC 组。PD 组男 14例,女 16例,年龄 46~79(66.1±7.2)岁,BMI为(22.85±2.71)kg/m2;HC 组男 18 例,女 12例,年龄 50~75(64.8±5.0)岁,BMI为(23.08±2.32)kg/m2。两组对象均长期生活于浙南地区,饮食结构相似,无特殊饮食习惯;两组对象性别、年龄、BMI比较差异均无统计学意义(均P>0.05)。纳入标准:依据英国脑库帕金森病诊断标准[12],并由经验丰富的神经内科医师确诊。排除标准:恶性肿瘤、严重肝肾功能不全、急性心力衰竭等严重基础疾病者;严重消化道疾病史;胃肠手术病史;3个月内服用过抗生素和益生菌。本研究经温州市人民医院医学伦理委员会批准,两组对象或家属均签署知情同意书。
1.2 方法
1.2.1 PD组临床资料和评价的收集 收集PD组患者病史资料。采用Hoehn&Yahr分级量表(H-Y分级)和统一帕金森病评分量表第三部分(unified Parkinson's disease rating scale Ⅲ,UPDRS Ⅲ)进行临床分类,以评估疾病进展和运动功能损伤。由神经内科医师对PD组患者进行非运动症状的评估,包括简易精神状态检查量表(mini-mental state examination,MMSE),汉密尔顿抑郁量表(hamilton depression scale,HAMD)24 项版,汉密尔顿焦虑量表(hamilton anxiety scale,HAMA),帕金森病自主神经症状量表(the scale for outcomes in PD for autonomic symptoms,SCOPA-AUT),Wexner便秘评分[13]。
1.2.2 粪便标本微生物分类分析 采用统一的无菌一次性便盒在医院或家中采集粪便标本,并储存于微生物检测试剂盒(杭州金源生物技术公司)。使用粪便基因组DNA试剂盒(北京天根生化科技有限公司,DP328),按照说明书要求,对粪便标本提取DNA。使用特定设计的细菌PCR扩增引物对粪便标本中的16S rDNA进行PCR扩增,具体引物序列如下:正向引物:5'-tcgtcggcagcgtcagatgtgtataagagacag CCTACGGGNGGCWGCAG-3',反向引物:5'-gtctcgtgggctcggagatgtgtataagagacagGACTACHVGGGTATCTAATCC-3'。使用 Miseq仪器(美国Illumina公司)进行细菌16S rDNA高通量测序。
1.2.3 两组对象肠道菌群的可操作分类单元(operational taxonomic units,OTU)和Alpha多样性分析 过滤处理测序原始数据后,得到OTU。基于样本OTU,分析菌群Alpha多样性,计算Chao1指数,Shannon指数、Simpson指数及Good's coverage等参数。它们分别用于反映菌群的丰度;估算样品中微生物的多样性;反映一个样品中任意两条序列不属于同一个物种的概率;估算各样文本库的覆盖率。
1.2.4 两组对象门、属水平肠道菌群丰度的比较 根据OTU物种注释,以及每个OTU的序列数,计算两组对象肠道菌群的丰度;根据分类学信息,从门水平和属水平分析比较两组肠道菌群的丰度。
1.2.5 两组对象差异菌群与PD组临床特征的相关性分析 分析两组间差异菌群与PD组病程、运动症状、非运动症状等临床特征的相关性。
1.3 统计学处理 使用R(v3.6.1)语言软件进行分析。在Rstudio界面,符合正态分布的计量资料以表示,组间比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用秩和检验。计数资料以百分率表示,组间比较采用χ2检验。PD组患者肠道菌群丰度与临床症状之间的关系采用Spearman秩相关。P<0.05为差异有统计学意义。
2 结果
2.1 PD组临床资料和评价结果 PD组病程为(5.54±3.5)年,H-Y 分级为(2.11±0.65)级,UPDRS Ⅲ评分为(25.31±10.37)分,MMSE 评分为(26.94±2.48)分,HAMD评分为(18.67±9.76)分,HAMA 评分为(12.25±6.55)分,SCOPA-AUT 评分为(28.08±8.26)分,Wexner便秘评分为(9.28±6.3)分。
2.2 两组对象肠道菌群的OTU和Alpha多样性分析比较 见表1。
由表1可见,PD组与HC组OTU数、Chao1指数、Shannon指数和Simpson指数、Good's coverage反映的菌群多样性比较,差异均无统计学意义(均P>0.05)。
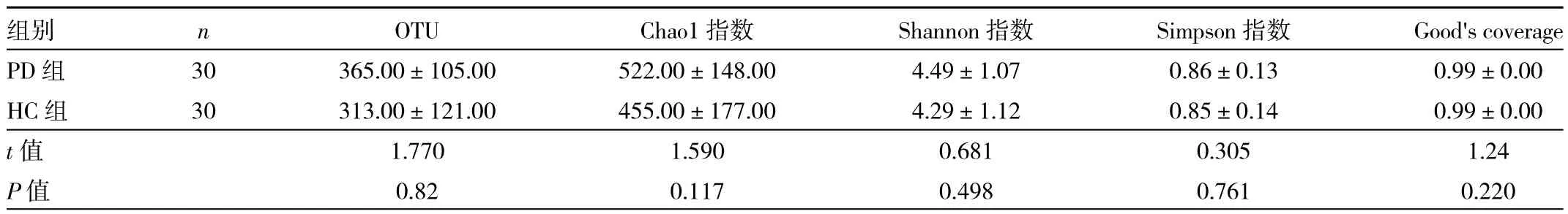
表1 两组对象肠道菌群的OTU和Alpha多样性分析比较
2.3 两组对象门水平肠道菌群丰度比较 见表2。
由表2可见,在门水平上,PD组疣微菌门、黏胶球形菌门、异常球菌门的丰度高于HC组,差异有统计学意义(均 P<0.05)。

表2 两组对象门水平肠道菌群丰度比较(%)
2.4 两组对象属水平肠道菌群丰度比较 见表3。
由表3可见,PD组中毛螺旋菌属、伯劳特菌属、链球菌属、克雷伯菌属丰度明显低于HC组,差异均有统计学意义(均P<0.05)。PD组中埃希菌属、瘤胃球菌属、巨单胞菌属、阿克曼菌属、巨型球菌属、颤杆菌属、伯克菌属、埃森博格拉菌属、异味杆菌属、丹毒丝菌科未命名属、脱硫弧菌属、普雷沃菌属、单胞菌属、脱硫弧菌科未命名属、嗜胨菌属丰度高于HC组,差异均有统计学意义(均 P<0.05)。
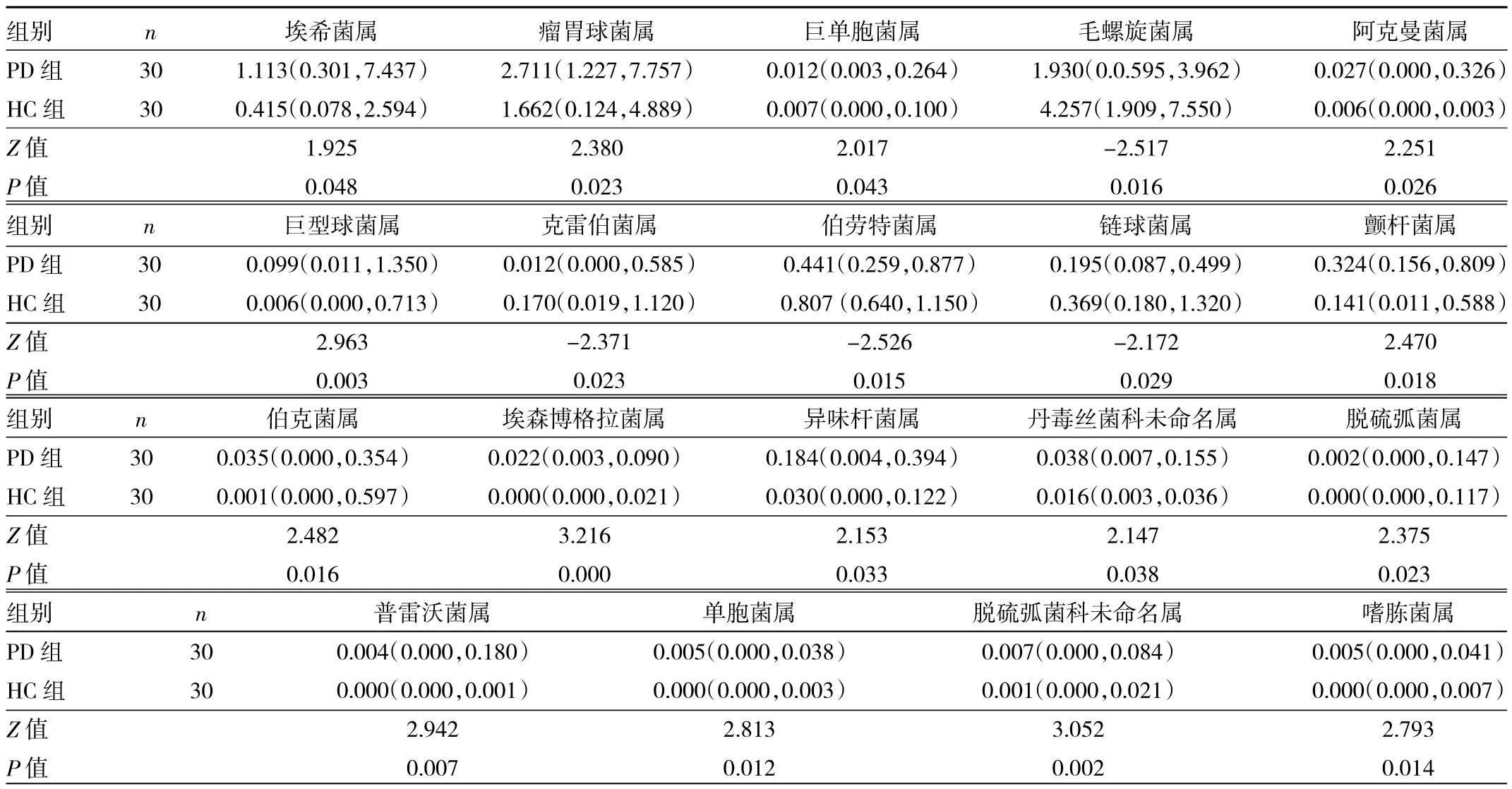
表3 两组对象属水平肠道菌群丰度比较(%)
2.5 两组对象差异菌群与病程、运动症状的相关性分析 见表4。
由表4可见,PD组与HC组间的差异菌属分别与帕金森病病程、运动症状进行相关分析,结果显示UPDRS Ⅲ与脱硫弧菌属呈正相关(rho=0.482,P=0.023)。
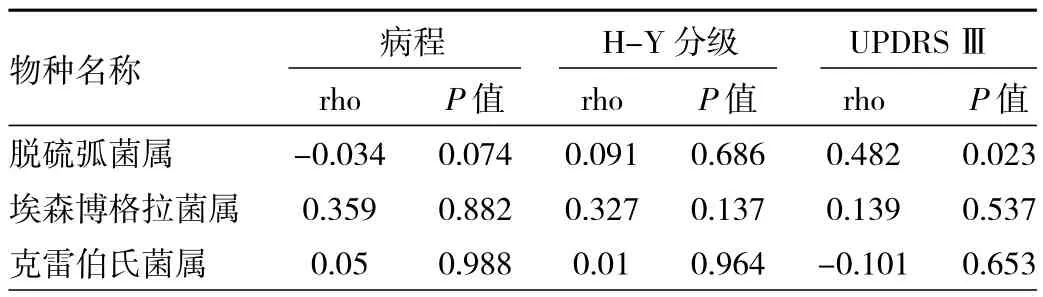
表4 两组对象差异菌群与病程、运动症状的相关性分析
2.6 两组对象差异菌群与非运动症状的相关性 见表5。
由表5可见,将PD组与HC组间差异菌属分别与PD非运动症状进行相关分析,HAMA与链球菌属呈正相关,HAMA、HAMD与巨型球菌属呈正相关;MMSE与埃森博格拉菌属呈负相关;SCOPA-AUT与普雷沃菌属呈负相关。
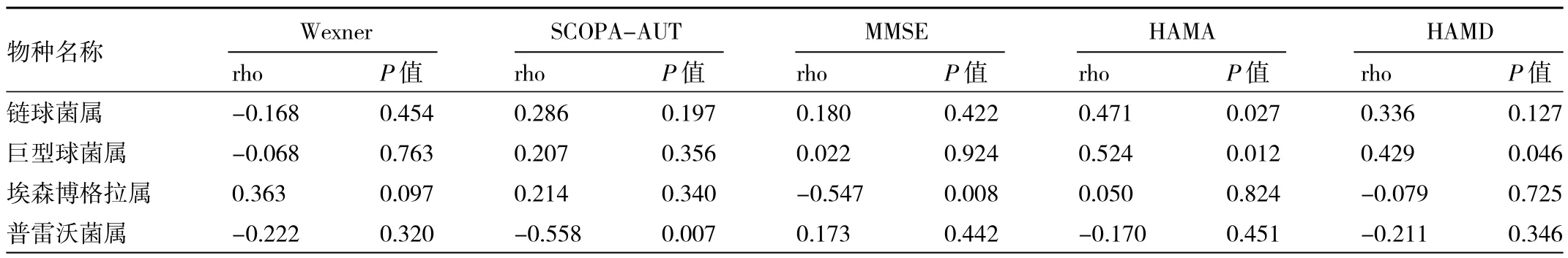
表5 两组对象差异菌群与非运动症状的相关性
3 讨论
帕金森病是一种以中脑黑质多巴胺能神经元退行性病变为特征的神经变性性疾病。在神经系统不同区域的神经元内存在的含有α-突触核蛋白的路易小体是帕金森病病理诊断重要的相关标志物[14-16]。Braak等[2]根据帕金森病患者的病理学研究提出帕金森病脑-肠轴受累的假设,越来越多证据表明胃肠道和肠神经对帕金森病的发展有重要作用。脑-肠轴是中枢神经系统和胃肠道之间的双向通信系统。新近研究提出肠道菌群可能影响胃肠-脑相互作用[17-19]。
本研究分析结果发现PD组与HC组在菌群多样性上比较无统计学意义。这与Pietrucci等[20-21]的研究结果一致。从门水平上看,本研究结果显示PD组患者粪便中疣微菌门、黏胶球形菌门、异常球菌门的丰度较高,其中,疣微菌门比例比较高,作用可能比较大。既往国外研究结果显示了帕金森病肠道菌群中疣微菌门丰度较高[22],与本研究结果一致。从属水平上看,本研究结果发现PD组毛螺旋菌属、伯劳特菌属的丰度较少。这两种细菌均参与调节产生短链脂肪酸[17,23-27]。短链脂肪酸是菌群代谢的主要产物,不仅起到稳定菌群结构的作用,还参与肠道免疫、动力和肠上皮屏障的调节[28]。既往一些研究已经表明在帕金森病患者肠道中缺乏短链脂肪酸,这可能与帕金森病患者肠道调节产生短链脂肪酸的菌群减少有关[29-30]。本研究关注到PD组肠杆菌科中的埃希菌属和阿克曼菌属丰度明显升高,这与之前的研究结果一致[31-32]。埃希菌属是革兰阴性菌,而脂多糖是革兰阴性菌细胞壁的主要成分,它可以诱导产生促炎性细胞因子。Small等[33]发现在克罗恩病中持续感染黏附侵袭性埃希菌可以导致慢性、持续性外周炎症。而阿克曼菌被认为可以降解肠道黏液层[34],导致微生物抗原暴露于免疫细胞,从而可能具有炎症潜力。这两种细菌可能促进了帕金森病患者肠道炎症反应和肠黏膜屏障的破坏。
相关性分析结果显示UPDRS Ⅲ与脱硫弧菌属丰度呈正相关性。Tomova等[35]的研究发现自闭症儿童肠道中脱硫弧菌增加的趋势,其丰度与自闭症孤独症诊断访谈的限制/重复行为评分严重程度有明显的相关性。从非运动症状量表相关性结果来看,SCOPA-AUT与普雷沃菌属丰度呈负相关性;同样在特发性快速眼动睡眠行为紊乱患者中肠道普雷沃菌下降,提示普雷沃菌可能对帕金森病非运动症状有影响[36]。MMSE与埃森博格拉菌属丰度呈负相关性;HAMA与链球菌属呈正相关性,HAMA、HAMD均与巨型球菌属丰度均呈正相关性。有研究发现精神分裂症患者巨型球菌丰度较HC组明显升高,说明巨型球菌可能与帕金森病精神行为功能相关[37-38]。
本研究尚有许多不足,包括采用横断面研究方法,纳入的帕金森病患者较少,未进行不同临床分型的分类比较和不同阶段菌群动态分析比较,仅初步证实了帕金森病患者与健康人群之间的肠道菌群差异。Sampson等[24]发现无菌的帕金森病小鼠模型的运动障碍症状比正常菌群的帕金森病小鼠模型症状更轻;将帕金森病患者的肠道菌群转移至无菌的帕金森病小鼠模型,其运动障碍症状则加重。但目前国内外关于帕金森病肠道菌群结构尚不统一,无法归纳出其典型菌群分布特点,肠道菌群被认为只是帕金森病发病机制中的影响因素之一。
综上所述,帕金森病患者与健康人群之间的肠道菌群存在明显差异。帕金森病肠道菌群中致炎病菌的增多及短链脂肪酸产生菌减少,而且差异菌群与帕金森病的临床特征有一定相关性。但是具体的作用机制尚不明确,还需进一步深入研究,本研究为帕金森病患者诊断的生物标志物提供新方向,为肠道菌群的靶点治疗方法应用提供依据。
