高耐受Pb2+酵母菌抗氧化及吸附Pb2+特性的研究
2021-06-19张丰生李丽杰贺银凤
张丰生,李丽杰,贺银凤
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
重金属是指密度大于4.5 g/cm3的金属,常见的有铬、铜、镉、镍等,铅(plumbum,Pb)是其中对环境和人体危害较大的一种[1]。在灌溉小麦和水稻时,如果使用含铅浓度在0.1 mg/L~4.4 mg/L的水,成熟作物中的含铅量就会显著增加[2]。有学者分别研究了重金属铅对野生植物种子发芽和水稻生长情况的影响,结果表明,Pb的污染对野生种子的发芽和水稻根系的生长影响显著[3-4]。铅还能通过呼吸和消化两大途径进入机体并蓄积于体内,产生大量的自由基攻击生物大分子,主要体现在DNA损伤和对特定酶的氧化钝化,甚至可能破坏细胞的结构和功能,造成机体各大器官等一系列的系统损伤[5-8]。具体表现为:小脑和大脑的皮层细胞损伤[9];对儿童智力发育产生损害[10];免疫系统损伤[11];心血管系统损伤[12];肾脏系统损伤[13-14]等。重金属铅对人体的这种危害已经不容忽视,对重金属铅中毒的防治与治疗引起众多学者的关注,除西医络合类药物及食疗驱铅等治疗方法外,由于微生物具有种类多、来源广、易获取等特点,使得对铅有吸附性及抗氧化活性微生物的利用提供了极大的可能性。
酵母菌是一种单细胞真核微生物,在人类漫长的历史长河中,很早被人们发现和利用。直到现在,酵母菌的研究热度和使用热度依旧不减,是世界上被研究最多的微生物之一。根据对酵母菌抗氧化性的研究,酵母菌在受到重金属胁迫时,自身的抗氧化应激酶系统能够缓解重金属对菌株的胁迫伤害。重金属离子在与细胞壁接触过程中,会与其中多种官能团上的氧、氮、磷、硫等原子配位发生络合反应[15-16]。李昌宝等通过对11种酵母发酵的冬瓜酒进行抗氧化性能力比较发现,BV818酵母发酵的冬瓜酒具有良好的·OH、O-2·、DPPH·清除能力,其清除率分别为6.70%、43.25%、45.73%[17]。崔静等对酿酒酵母细胞壁上的多糖类物质抗氧化性进行研究发现,当多糖质量浓度升高至2.0 mg/mL时,对·OH清除率高达91.5%[18];王欣卉等通过研究酵母菌中的金属硫蛋白发现,其能够显著降低锦鲤肾脏中的Pb2+含量[19]。邵昭等通过对固定化酵母菌吸附重金属离子规律进行研究发现,在一定温度范围内,温度升高对吸附能力的提高有一定作用[20]。本文选择对Pb2+的耐受质量浓度在6 000 mg/L~7 000 mg/L之间的异常威克汉姆酵母(Wickerhamomyces anomalus)QI-1-6、QI-1-7、QD-2-8,对其进行一系列抗氧化能力试验,并研究pH值、湿菌体浓度、初始Pb2+浓度、吸附温度、吸附时间等因素对酵母菌吸附Pb2+的影响,为同时具有抗氧化和吸附重金属特性产品的开发提供参考。
1 材料与方法
异常威克汉姆酵母(Wickerhamomyces anomalus)QI-1-6、QI-1-7、QD-2-8:内蒙古农业大学食品学院食品生物技术团队提供;1,1-二苯基-2-三硝基苯肼[1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH]:北京Coolaber公司;2-硫代巴比妥酸(2-thiobarbituric acid,TBA):山西东亚化学工业有限公司;水杨酸、邻苯三酚、亚油酸、三羟甲基氨基甲烷 [tris(hydroxymethyl)aminomethane,Tris]、2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)、硫酸亚铁[iron(II)sulfate heptahydrate,FeSO4]、抗坏血酸(ascorbic acid,VC)等均为分析纯。
KDC-140HR型高速冷冻离心机:安徽中佳仪器有限公司;MBR-022UP型深孔板高速振摇培养箱:日本TAITEC公司;UV-1100型紫外可见分光光度计:上海美谱达仪器有限公司;JY 88-IIN型超声波细胞粉碎机:宁波生物股份有限公司;HF-SAFE 1500型生物安全柜:力康生物医疗有限公司;SX-500型全自动高压灭菌锅:日本TOMY公司;AAS990型火焰原子吸收光谱仪:北京普析通用公司。
1.1 样品的制备
将筛选出的高耐受Pb2+的W.anomalus QI-1-6、QI-1-7、QD-2-8利用酵母提取物蛋白胨葡萄糖(yeast extract peptone dextrose,YEPD)液体培养基进行活化(30℃,160 r/min)培养三代,利用无菌超纯水将第三代菌液离心(4 000 r/min,4 min)洗涤3次,制成约为107CFU/mL菌悬液,吸取5 mL,利用超声波破碎仪(300 W,4 s/6 s,14 min)冰浴破碎处理,离心,取上清液,获得无细胞提取物。
1.2 菌株抗氧化能力的测定
1.2.1 DPPH自由基清除能力的测定
以 1、50、100、150、200 μg/mL 的 VC浓度为横坐标,DPPH自由基清除率为纵坐标,绘制标准曲线,得出回归方程为:y=0.397 9x+7.033,R2=0.992 2。用2 mL超纯水替代样品为阴性对照组,用1 mL无水乙醇代替DPPH无水乙醇溶液为空白组,1.5 mL超纯水与同体积无水乙醇混合溶液调零。清除率按公式(1)计算[21]。根据标准曲线回归方程计算清除能力。
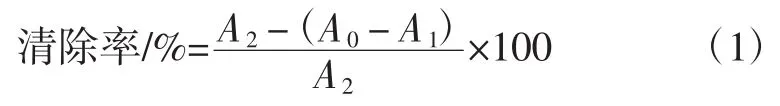
式中:A0为样品组的吸光值;A1为空白组的吸光值;A2为对照组的吸光值。
1.2.2 羟基自由基清除能力的测定
以 1、100、200、400、800 μg/mL 的 VC浓度为横坐标,羟基自由基清除率为纵坐标,绘制标准曲线,得出回归方程为:y=0.123 4x+0.805 3,R2=0.992 8。用超纯水替代样品为阴性对照组。清除率按公式(2)计算[22]。根据标准曲线回归方程计算清除能力。
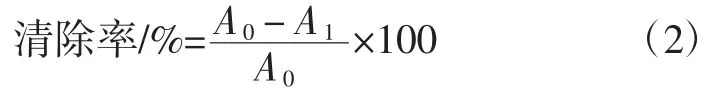
式中:A1为样品组的吸光值A0为阴性对照组的吸光值[22]。
1.2.3 超氧阴离子自由基清除能力的测定
以 1、50、100、200、300 μg/mL 的 VC浓度为横坐标,超氧阴离子自由基清除率为纵坐标,绘制标准曲线,得出回归方程为:y=0.3x+10.748,R2=0.992 6。用超纯水替代样品为阴性对照组。清除率按以公式(3)计算[17]。根据标准曲线回归方程计算清除能力。
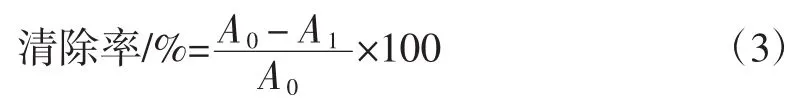
式中:A1为样品组的吸光值;A0为阴性对照组的吸光值。
1.2.4 脂质过氧化物抑制能力的测定
以 1、50、100、150、200 μg/mL 的 VC浓度为横坐标,脂质过氧化物清除率为纵坐标,绘制标准曲线,得出回归方程为:y=0.382 9x+8.717 7,R2=0.990 1。用超纯水替代样品为阴性对照组。清除率按公式(4)计算[23]。根据标准曲线回归方程计算抑制脂质过氧化能力。

式中:A0为样品组的吸光值;AX为阴性对照组的吸光值。
1.3 酵母菌对Pb2+吸附特性的研究
以 0、20、40、60、80、100 mg/L 的 Pb2+储备液为横坐标,火焰原子吸收分光光度计测定的吸光值为纵坐标,绘制标准曲线,得出回归方程为:y=0.009x+0.001 8,R2=0.999 7。根据公式(5)、(6)计算 Pb2+吸附量和吸附率。
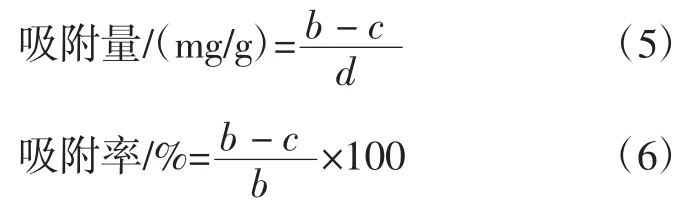
式中:b为未接种酵母菌处理溶液中的Pb2+含量,mg;c为酵母菌处理后溶液中的 Pb2+含量,mg;d为酵母菌的添加量,g。
1.3.1 pH值对酵母菌吸附Pb2+的影响
将 1.4 mL 不同 pH(2.0~6.0)的 100 mg/L Pb2+储备液加到48孔深孔板中,再加入菌体浓度为15 g/L的菌悬液,在深孔板摇床(800 r/min,30℃,120 min)条件下进行Pb2+吸附试验。
1.3.2 菌体浓度对酵母菌吸附Pb2+的影响
将1.4 mL pH 6.0的100 mg/L Pb2+储备液加到48孔深孔板中,再加入不同菌体浓度(9 g/L~17 g/L)的菌悬液,在深孔板摇床(800 r/min,30℃,120 min)条件下进行Pb2+吸附试验。
1.3.3 初始Pb2+浓度对酵母菌吸附Pb2+的影响
将1.4mLpH6.0的不同Pb2+浓度(100mg/L~500mg/L)储备液加到48孔方形深孔板中,再加入菌体浓度为15 g/L的菌悬液,在深孔板摇床(800 r/min,30℃,120 min)条件下进行Pb2+吸附试验。
1.3.4 吸附温度对酵母菌吸附Pb2+的影响
将1.4 mL pH 6.0的100 mg/L Pb2+储备液加到48孔深孔板中,再加入菌体浓度为15 g/L的菌悬液,在不同温度(25℃~45℃)下利用深孔板摇床(800 r/min,120 min)进行Pb2+吸附试验。
1.3.5 吸附时间对酵母菌吸附Pb2+的影响
将1.4 mL pH 6.0的100 mg/L Pb2+储备液加到48孔深孔板中,再加入浓度为15g/L的菌悬液,利用深孔板摇床(30℃,800 r/min)分别吸附不同时间(60 min~180min)进行Pb2+吸附试验。
1.4 数据处理
每组试验3次平行3次重复,所有数据均利用SPSS 23.0中的one-way ANOVA和Origin 2018进行数据分析及作图,测定结果以平均值±标准偏差表示。
2 结果与分析
2.1 W.anomalus抗氧化能力测定结果
2.1.1 DPPH·清除能力
按1.2.1方法,酵母菌清除DPPH·结果见图1。
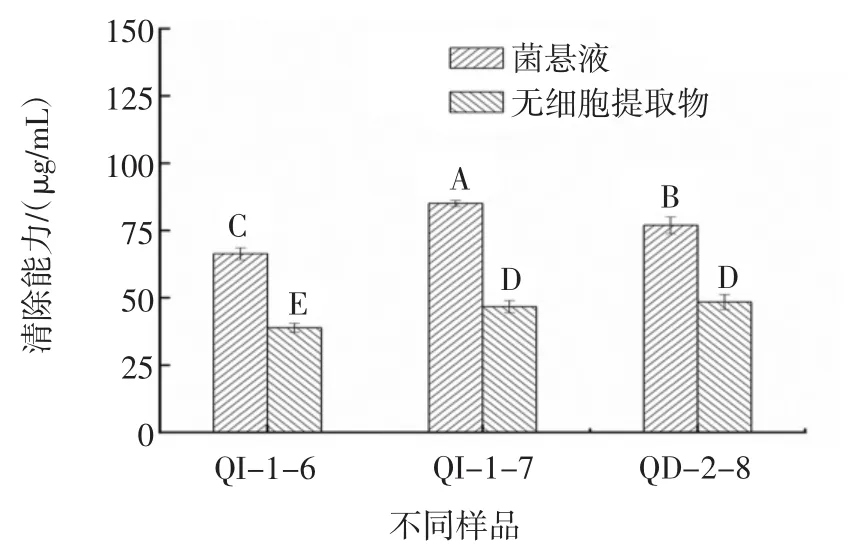
图1 酵母菌菌悬液和无细胞提取物对DPPH·的清除能力Fig.1 DPPH free radical scavenging ability of yeast suspension and cell-free extract
由图1可知,不同的酵母菌对DPPH·清除能力不同,W.anomalus QI-1-6、QI-1-7、QD-2-8 菌悬液对DPPH·清除能力分别是(66.37±2.21)、(85.09±1.11)、(76.89±3.15)μg/mL;超声破碎离心后的无细胞提取物对 DPPH·清除能力分别是(38.87±1.69)、(46.70±2.25)、(48.45±2.02)μg/mL。菌悬液清除DPPH·水平显著高于无细胞提取物(p<0.05),其中W.anomalus QI-1-7菌悬液对DPPH·清除能力最高,但低于陈君试验中酵母菌对DPPH·的清除能力,原因可能是不同酵母菌间产生的抗氧化活性物质分布不同(细胞内或菌体表面),从而导致不同酵母菌清除DPPH·能力不同[24]。
2.1.2 羟基自由基清除能力
按1.2.2方法,酵母菌清除羟基自由基结果见图2。
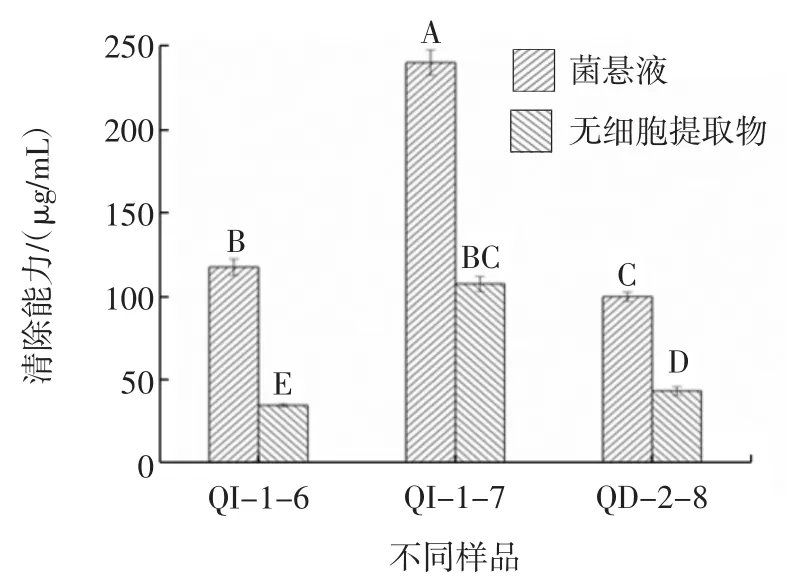
图2 酵母菌菌悬液和无细胞提取物对羟自由基的清除能力Fig.2 Hydroxyl radical scavenging ability of yeast suspension and cell-free extract
由图2可知,不同的酵母菌对羟基自由基清除能力不同,W.anomalus QI-1-6、QI-1-7、QD-2-8 菌悬液清除羟基自由基的能力分别为(117.95±5.01)、(240.88±7.69)、(100.20±2.76)μg/mL 超声破碎离心后的无细胞提取物对羟基自由基的清除能力分别是(34.88±0.98)、(107.85±4.55)、(43.56±2.54)μg/mL。W.anomalus菌悬液清除羟基自由基的水平显著高于无细胞提取物(p<0.05),无论菌悬液还是无细胞提取物,W.anomalus QI-1-7清除羟基自由基能力最优。与清除DPPH·不同的是,陈君[24]试验中酵母菌对羟基自由基的清除能力为 140.81 μg/mL,显著低于 W.anomalus QI-1-7。
2.1.3 超氧阴离子自由基清除能力
按1.2.3方法,酵母菌清除超氧阴离子自由基结果见图3。
由图3可知,酵母菌不同,对超氧阴离子自由基的清除作用也会有所改变,其中W.anomalus QI-1-6、QI-1-7、QD-2-8菌悬液清除超氧阴离子自由基能力分别是(137.74±7.30)、(171.41±6.92)、(158.60±7.97)μg/mL;超声破碎离心后其清除能力分别是(24.70±2.15)、(5.74±0.57)、(34.27±0.91)μg/mL,W.anomalus菌悬液清除超氧阴离子自由基的水平显著高于(p<0.05)无细胞提取物。由于存在种间差异,特性有所不同,菌悬液和无细胞提取物清除超氧阴离子自由基的能力也不尽相同。柳青[25]试验中,抗氧化酵母DQ-1-2,FQ-7菌悬液清除超氧阴离子自由基能力分别为27.57%和24.97%,均低于本试验W.anomalus酵母菌的清除率。

图3 酵母菌菌悬液和无细胞提取物对超氧阴离子自由基的清除能力Fig.3 Removal of superoxide anions radical by yeast suspension and cell-free extracts
2.1.4 酵母菌抑制脂质过氧化能力
按1.2.4方法,酵母菌抑制脂质过氧化能力结果见图4。
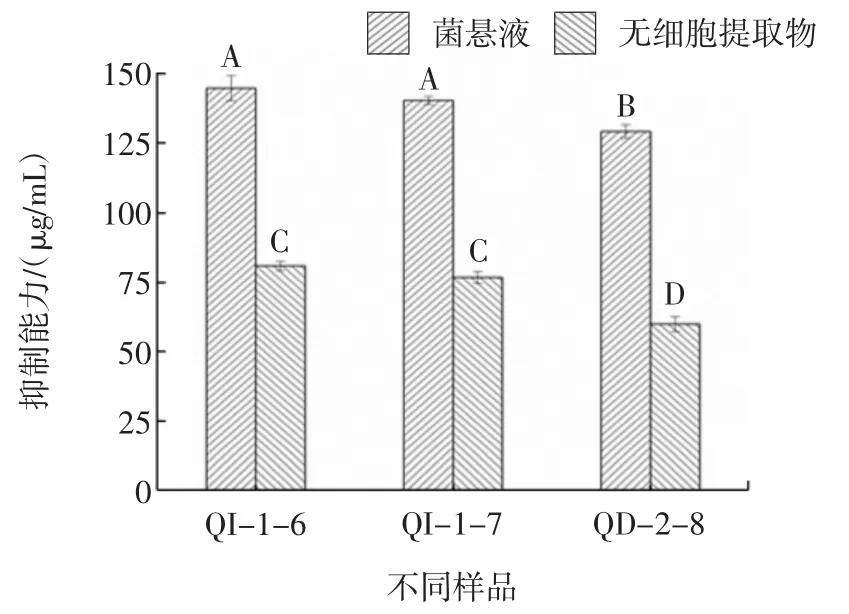
图4 酵母菌菌悬液和无细胞提取物的抑制脂质过氧化能力Fig.4 Inhibition of lipid peroxidation by yeast suspension and cell-free extract
由图 4 可知,W.anomalus QI-1-6、QI-1-7、QD-2-8菌悬液抑制脂质过氧化能力分别为(144.72±4.53)、(140.32±1.44)、(129.13±2.42)μg/mL,超声破碎离心后无细胞提取物抑制脂质过氧化能力分别为(80.84±1.67)、(76.66±2.17)、(59.94±2.72)μg/mL。其中菌悬液的脂质过氧化抑制率显著高于无细胞提取物的脂质过氧化抑制率(p<0.05),W.anomalus QI-1-6菌悬液抑制脂质过氧化能力最好,但与W.anomalus QI-1-7无显著差异(p>0.05)。原因可能是因为完整细胞活性的酵母菌在抑制脂质过氧化时产生相同的抗氧化物质(如谷胱甘肽、多酚、多糖、酶类),因此抑制脂质过氧化能力也相似。这与陈历水等对12株酵母菌抑制脂质过氧化能力进行测定的试验中酵母菌完整细胞活性(49%~75%)高于相应酵母菌提取物(0%~59%)的结果相似[26]。
2.2 不同因素对酵母菌Pb2+吸附能力的影响
2.2.1 pH值对酵母菌吸附Pb2+的影响
不同pH值对W.anomalus QI-1-7吸附Pb2+的影响如图5所示。
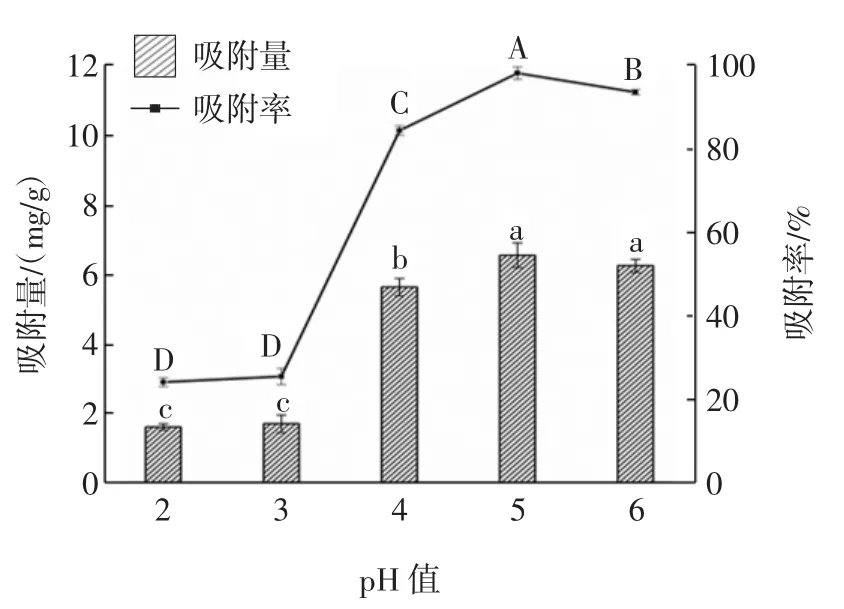
图5 不同pH值对W.anomalus QI-1-7吸附Pb2+的影响Fig.5 Effect of different pH values on adsorption of Pb2+by W.anomalus QI-1-7
酵母菌在吸附重金属过程中,pH值的变化会影响官能团结合重金属离子的能力,因此,pH值是影响酵母菌吸附重金属的主要因素之一。由图5可知,在pH值升高的同时,吸附率和吸附量也在增大。具体表现为:当pH值在2.0~3.0区间内,菌株QI-1-7吸附Pb2+的能力较弱;当pH值为5.0时,吸附能力达到最高,且显著高于其他pH值(p<0.05),此时吸附率和吸附量分别为98.31%、6.55 mg/g。当pH值大于5.0时,吸附率不再随着pH值的增大而增大,反而呈一个负相关的关系,原因可能是随着pH值的继续升高,OH-会和金属离子竞争菌体表面的结合位点[27]。
2.2.2 不同菌体浓度对酵母菌吸附Pb2+的影响
不同菌体浓度对W.anomalus QI-1-7吸附Pb2+的影响如图6所示。

图6 不同菌体浓度对W.anomalus QI-1-7吸附Pb2+的影响Fig.6 Effect of different cell concentration on the adsorption of Pb2+by W.anomalus QI-1-7
由图6可知,当菌体浓度为9 g/L~17 g/L,菌体吸附率呈先上升后下降的趋势。当菌体浓度为15 g/L时,吸附率达到最高的98.76%。当菌体浓度为9 g/L时,吸附量最多,为7.96 mg/g,具体表现为:当菌体浓度为9 g/L~15 g/L时,菌株QI-1-7的吸附能力维持在一个较高的水平,吸附量在6.5 mg/g~7.9 mg/g之间;当菌体浓度为17g/L时,吸附量出现显著的下降(p<0.05)。这种现象出现的原因可能是由于菌体QI-1-7在高的浓度下,部分细胞聚集导致细胞壁中化学反应基团(OH-、COO-和NH3+)之间的内部连接发生羟氨基化和酰胺化反应,从而减少了金属离子在菌体中的吸附[28]。
2.2.3 初始Pb2+浓度对酵母菌吸附Pb2+的影响
不同初始Pb2+浓度对W.anomalus QI-1-7吸附Pb2+的影响如图7所示。
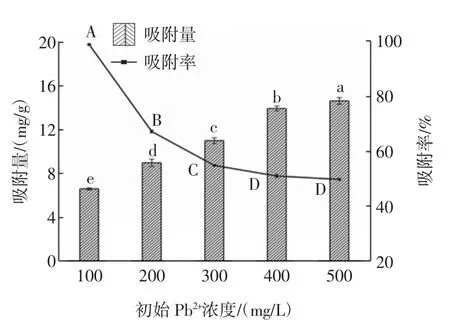
图7 不同初始Pb2+浓度对W.anomalus QI-1-7吸附Pb2+的影响Fig.7 Effect of different initial Pb2+concentrations on the adsorption of Pb2+by W.anomalus QI-1-7
由图7可知,随着初始Pb2+浓度的增大,吸附率逐渐下降,反观吸附量,呈现增长的趋势。具体表现为:当Pb2+浓度为100 mg/L时,此时吸附率为最大值,达到98.98%;Pb2+浓度为500 mg/L时,吸附率达到最低的49.85%。当Pb2+浓度为100 mg/L时,吸附量最低,为6.60 mg/g,随着Pb2+浓度的持续升高呈现一个匀速增长的过程,Pb2+浓度增长到500 mg/L时,吸附量达到最高的16.62 mg/g。推测原因可能是:Pb2+浓度为100 mg/L时,菌株QI-1-7表面的结合位点较少,无法与较多的Pb2+进行结合所以吸附量较少;当Pb2+浓度增大到500 mg/L时,菌株QI-1-7表面上的结合位点与Pb2+的结合逐渐趋于饱和,吸附率不再发生显著变化,此时吸附量最大。本研究与Li等[29]和Wahab[30]的结论基本一致,而Gunjal等[31]的研究发现,随着Pb2+质量浓度的升高,菌体细胞对Pb2+的吸附量及吸附率均呈现逐渐下降的趋势,表明不同微生物对Pb2+的吸附能力有差异。
2.2.4 吸附温度对酵母菌吸附Pb2+的影响
不同吸附温度对W.anomalus QI-1-7吸附Pb2+的影响如图8所示。
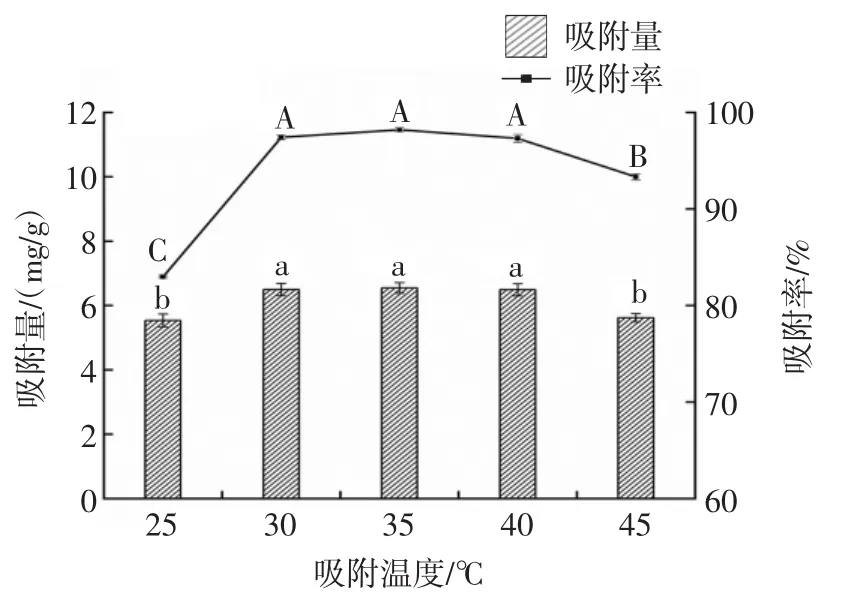
图8 不同吸附温度对W.anomalus QI-1-7吸附Pb2+的影响Fig.8 Effect of different adsorption temperature on the adsorption of Pb2+by W.anomalus QI-1-7
酵母菌QI-1-7在吸附重金属Pb2+过程中,吸附温度的变化会影响酵母菌吸附Pb2+的能力。由图8可知,当吸附温度为25℃时,对菌株QI-1-7的吸附量和吸附率影响显著;菌株QI-1-7在35℃时,吸附率与吸附量达到最大值,分别为98.2%和6.55 mg/g,吸附温度超过35℃之后,随着温度的上升,菌株QI-1-7吸附Pb2+的能力呈显著下降的趋势。由此可知,酵母菌的最适宜生长温度为35℃左右,在该温度下,菌株可以保持较强的吸附能力,不论是温度升高又或者是温度降低,都会有一些细胞丧失活性,影响菌株的吸附率以及吸附量。本研究与赵晓峰对两株高耐铅菌株E.hirae Qaa和P.pento-saceus Fe3进行的不同温度下铅吸附试验结果一致[32]。
2.2.5 吸附时间对酵母菌吸附Pb2+的影响
不同吸附时间对W.anomalus QI-1-7吸附Pb2+的影响如图9所示。
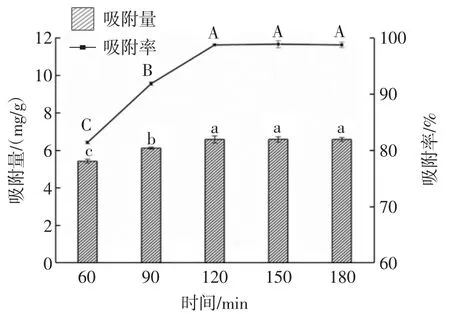
图9 不同吸附时间对W.anomalus QI-1-7吸附Pb2+的影响Fig.9 Effect of different adsorption time on the adsorption of Pb2+by W.anomalus QI-1-7
由图9可知,吸附时间达到150 min时,菌株QI-1-7吸附Pb2+的吸附率及吸附量达到最高,分别为98.87%和6.59 mg/g,与120 min和180 min时的吸附率及吸附量无显著差异(p>0.05)。原因可能是菌株QI-1-7的吸附方式为胞外结合。当细胞与Pb2+相接触时,存在于细胞表面上的活性基团在静电结合的作用下,开始与Pb2+进行结合,吸附能力会增强,活性基团的结合位点会随着时间的推移逐渐趋向饱和状态,此时吸附进入到平稳的状态,同时也表明,菌株QI-1-7对Pb2+的吸附是一个比较快的过程。
3 结论
W.anomalus QI-1-6、QI-1-7、QD-2-8 菌悬液和无细胞提取物都具有一定的抗氧化能力,菌悬液抗氧化能力显著高于无细胞提取物(p<0.05)。W.anomalus QI-1-6菌悬液对DPPH·清除能力较好,达到(144.72±4.53)μg/mL;W.anomalus QI-1-7菌悬液对 DPPH 自由基、羟基自由基和超氧阴离子自由基的清除能力较好,分别达到(85.09±1.11)、(240.88±7.69)、(171.41±6.92)μg/mL。
当pH值为5时,W.anomalus QI-1-7对Pb2+的吸附能力最强,此时吸附率为98.31%;菌体浓度为15 g/L时,吸附率为98.75%;Pb2+浓度为100 g/L时,吸附率为98.97%;温度为35℃时,吸附率为98.20%;吸附时间为150 min时,菌株QI-1-7对重金属Pb2+的吸附能力最强,吸附率达到98.87%。
