牦牛附睾ADAM28基因CDS区的克隆和表达研究
2021-06-19王红梅杨刘玥玲吴逸韬杨献康郑旭昕赵旺生
王红梅,杨刘玥玲,吴逸韬,杨献康,郑旭昕,赵旺生
(西南科技大学生命科学与工程学院,四川绵阳 621010)
去整合素-金属蛋白酶(Disintegrin and Metallopro teinase 28,ADAM28)基因家族成员具有明显的结构特征,包括前域、金属蛋白酶和崩解素域以及半胱氨酸域。ADAM 蛋白在细胞黏附与迁移、细胞融合、精子发生、神经发生等细胞活动中起着至关重要的作用。哺乳动物附睾是精子获得动力和受精能力的关键部位,附睾管是一个高度有序和分节的器官,每一个片段都代表一个独特的生理分区。每个小室在上皮细胞内都有独特的基因表达谱,导致特定的蛋白质分泌到管腔液中,直接或间接影响精子成熟[1]。
ADAM28 是一种含有催化位点的金属蛋白酶,已有数据表明在小鼠附睾中至少存在2 种ADAM28的剪接形式,其组织印记分析显示ADAM28在小鼠附睾中以交替剪接的形式高表达[2],提示其可能在精子成熟过程中发挥作用。Miyamae 等[3]在猕猴附睾和小鼠附睾的cDNA 文库中测序,发现ADAM28在猕猴附睾中表达高,在淋巴结、胰腺、卵巢和子宫中表达低;在小鼠附睾高表达,在肺、气管、胃等组织低表达,因此在不同物种中,负责在生理条件下表达ADAM28的细胞类型是不同的。由于ADAM28在附睾的高水平表达及其能够分泌CD200 从而参与免疫抑制[4-5],推测ADAM28参与了精子的成熟和免疫抑制,但没有直接证据证明这种可能性,因此有必要对ADAM28基因在牦牛附睾不同区域的表达进行研究。本研究利用克隆手段获得ADAM28基因的CDS 区,并对其进行生物信息学分析,通过荧光定量检测其在附睾组织中的表达,以期为探讨高原动物的生殖机制提供基本数据,同时为研究ADAM28基因在牦牛附睾上皮细胞中的功能奠定基础。
1 材料和方法
1.1 实验材料 四川省阿坝州红原县屠宰场采集3 头成年且年龄相近、体格相似、身体健康的公牦牛的睾丸。Hanks 溶液漂洗3 次将附睾从睾丸中分离出来,分为附睾头、附睾体、附睾尾,置于冻存管中迅速放入液氮中冷冻保存。利用PCR(qPCR)技术,以内参基因UXT作为对照基因,以附睾头作为对照组,附睾体和附睾尾部作为处理组,运用2-△△Ct方法可计算出ADAM28基因在附睾组织头、体、尾的相对表达量,观察ADAM28基因在牦牛附睾组头、体、尾3 个不同区段中的表达情况。
1.2 实验方法
1.2.1 牦牛附睾组织总RNA 的提取 按照Trizol 试剂说明书提取牦牛附睾组织3 个不同区段的总RNA,用0.8%的琼脂糖凝胶电泳检测RNA 的完整性,SpectraMax Quick Drop 超微量分光光度计检测RNA 质量,并保存于-80℃冰箱中。
1.2.2 引物设计及克隆 牦牛ADAM28基因全长2 447 bp,包含20 个外显子,其CDS 区有2 235 bp 编码744 个氨基酸。利用引物设计软件Primer Premier 5.0 设计牦牛ADAM28基因的PCR 克隆引物:ADAM28-F:5'-ATGGAGATCAATGTGGAC-3',ADAM28-R:5'-TGGCAAACAATAGTAAGG-3',以牦牛附睾组织逆转录所得的cDNA 为模板进行PCR 扩增,采用20.0 μL扩增体系:DNA 聚合酶10.0 μL,双蒸水7.0 μL,混匀的上下游特异性引物2.0 μL(10 μmol/L),附睾头、体、尾的cDNA 各加1.0 μL。反应条件:预变性94℃ 4 min;94℃30 s,60℃ 30 s,72℃ 60 s;共循环40 次,后72℃延伸2 min。将产物电泳检测后进行DNA 的纯化并与目的片段和载体连接,转化及鉴定后送成都擎科梓熙生物公司进行测序。
1.2.3 ADAM28 蛋白质生物信息学分析 利用软件BioXM 2.6 分析牦牛ADAM28 的核苷酸和氨基酸序列;利用在线软件EXPASY(https://web.expasy.org/protparam/)分析ADAM28 蛋白质理化性质;利用NCBI 的BLAST 功能比对氨基酸同源性,MEGA 6.0软件对其系统进化树进行构建,其他相关生物学的预测参考胡斐等文献中介绍的方法[16]。
1.2.4 荧光定量PCR 利用Primer Premier 5.0 软件设计ADAM28基因及内参基因UXT的特异性定量引物,ADAM28-F:5'-TTGCCTCTTTAATGTCCC-3',ADAM28-R:5'-GCATTCTCCTAACGCACA -3';UXT-F:5'-TGTGGCCCTTGGATATGGTT-3',UXT-R:5'-GGT TGTCGCTGAGCTCTGTG-3。荧光定量操作方法按照生工生物工程(上海)股份有限公司的2×SG Fast qPCR Master Mix 试剂盒说明书进行,反应体系10.0 μL:2×SG Fast qPCR Master Mix 5.0 μL,上下游引物各0.4 μL(10 μmol/L),PCR-grade water 3.1 μL,模 板DNA为0.5 μL,ddH2O 0.6 μL,以每样3 个重复为对照。反应条件:预变性95℃ 3 min,95℃ 2 s,60℃ 25 s;40个循环。
2 结果
2.1 牦牛ADAM28基因克隆产物 克隆结果显示,所筛选的牦牛ADAM28载体经过测序分析后可知产物片段长度为2 336 bp,其中包含牦牛ADAM28基因的CDS 序列2 235 bp,共编码744 个氨基酸,起始密码子为ATG,终止密码子为TGA。
2.2 牦牛ADAM28 蛋白质的理化性质 ADAM28 氨基酸分子式为C3643H5727N1005O1125S64,分子量为83.66 ku,总氨基酸数744,其中赖氨酸含量最高,占总氨基酸数的8.7%,其次为亮氨酸,占7.0%,第三为丝氨酸,占6.9%,色氨酸含量最低,占1.3%。其负电荷残基(Asp+Glu)和正电荷残基(Arg+Lys)总数分别是94和90,等电点为6.58,总亲水系数(GRAVY)为-0.479,脂肪系数值为69.56。不稳定性系数为36.12,蛋白质分类为稳定。
2.3ADAM28同源性 牦牛ADAM28核苷酸序列与绵羊(登录号:XM_027964322.1)、山羊(登录号:XM_005684210.3)、白尾鹿(登录号:XM_020900956.1)、野猪(登录号:XM_005670434.3)和鼠耳蝠(登录号:XM_015569247.1)的同源性分别为96.27%、96.29%、95.18%、84.71%、83.03%(图1),可知牦牛与山羊、绵羊亲缘关系较近,符合物种进化规律。

图1 ADAM28 基因的系统进化树
2.4 牦牛ADAM28 蛋白的结构 利用NeTPhos 3.1 Server 预测ADAM28 蛋白磷酸化位点显示有丝氨酸31个、酪氨酸13 个、苏氨酸22 个。利用ProtScale 分析其亲疏水性(图2),最大值3.622 在第694 个位点上,最小值-3.622 在第233 个位点上;ADAM28 整体为亲水性蛋白,这与其理化性质预测相符。由SOPMA 软件分析ADAM28 蛋白质二级结构,其蛋白质序列由744个氨基酸组成,122 个处于α螺旋区,占16.40%;154个在延伸链结构,占20.70%;40 个位于β转角区,占5.38%;428 个处于无规则状态,占57.53%;利用TMHMM 2.0 分析其跨膜区(图3),牦牛ADAM28蛋白的676~698 位氨基酸之间形成跨膜螺旋区。采用SignalP 4.1 Server 预测ADAM28 蛋白质信号肽情况(图4),结果显示牦牛ADAM28 蛋白不存在信号肽序列,经Softberry 预测,牦牛ADAM28 蛋白质亚细胞定位于细胞质膜上。
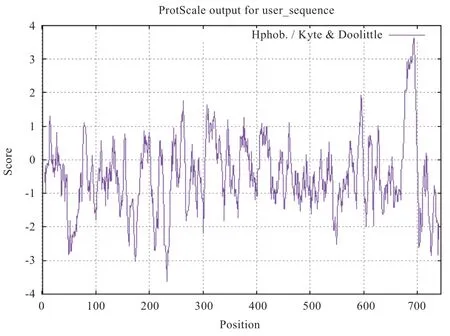
图2 ADAM28 亲疏水预测图

图3 牦牛附睾ADAM28 蛋白结构域图

图4 牦牛附睾ADAM28 蛋白信号肽预测
2.5 牦牛附睾不同区域的基因表达 如图5 所示,ADAM28基因在附睾组织不同区段中的表达差异极大(P<0.01),其中表达量最高的部位为头部,附睾体部和尾部中表达量较低。
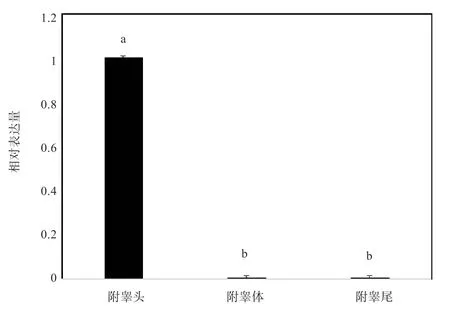
图5 ADAM28 基因在牦牛附睾不同部位的相对表达情况
3 讨 论
ADAMs(崩解素和金属蛋白酶)是一个跨膜和分泌蛋白家族,通过对细胞黏附、迁移、蛋白水解和信号传导作用在调节细胞表型中发挥重要作用[6],同时是精子和卵子黏附融合所需要蛋白的决定基因,这些蛋白存在于精子膜上,在受精时起重要作用[7]。
ADAMs 与整合素相互作用的生理相关性在受精过程中得到了明确的证明,在豚鼠精子表面发现的ADAM-1 也称作PH-30,在小鼠及猴子体内发现的ADAM-2 也称为受精-beta[10],这2 种蛋白质在成熟过程中都失去了它们的金属蛋白酶结构域,并直接暴露细胞表面的解体蛋白结构域[11],基于ADAM1-6在哺乳动物男性生殖器官如睾丸和附睾中的表达[12],其他的ADAMs也被认为参与了卵-精膜融合受精过程。在ADAM家族中,ADAM1、ADAM-2和ADAM-3在调节受精过程中起关键作用,但并不依赖于其黏附和融合潜能[13]。实验发现,缺乏ADAM-1和ADAM-2的精子在迁移过程中都有缺陷,但细胞黏附和融合过程只有微小的改变,而ADAM-2 和ADAM-3 蛋白质复合物对于精子从子宫到输卵管的体内迁移至关重要[14]。
本研究克隆获得牦牛ADAM28序列长2 247 bp,CDS 区有2 235 bp,氨基酸为744 个,ADAM28亲缘距离是从偶蹄目到食肉目到啮齿目,进化树演变同动物分类学规律演变一致。其蛋白质带负电,且GRAVY 为负值,因此牦牛ADAM28 编码的是带负电的稳定的亲水性蛋白。本研究发现该蛋白磷酸化位点有66 个,为研究其磷酸化提供了思路,同时蛋白结构以α螺旋和无规则状态为主,并在其基础上延伸,预测其跨膜域时,ADAM28 蛋白的第676~698 位氨基酸之间形成跨膜螺旋区,但SignalP 4.1 预测其信号肽发现该蛋白没有信号肽的存在,其以亚细胞定位于细胞质膜上。在牦牛整个附睾中均检测到ADAM28但附睾头组织中ADAM28水平远高于附睾体和附睾尾,与ADAM 家族其他成员不同,ADAM28 蛋白不具有典型的前蛋白转化酶的裂解位点[2],ADAM28 通过细胞表面表达的成熟跨膜蛋白对前结构域的自催化去除而被激活,作为膜锚定蛋白,ADAM28 的自催化活性已得到验证[17],ADAM28的表达与sCD200(与免疫抑制有关)显著相关,已确定存在2 种ADAM28 的替代形式,即膜结合形式的ADAM28-m 和分泌形式的ADAM28-s,其中膜结合形式的ADAM28-m 在释放CD200 过程中起重要作用,因此推测ADAM28在精子成熟和免疫抑制方面起重要作用[15]。
在男性不育症患者的精液中检测到多个ADAM基因缺失或不表达,而ADAM家族基因在生育过程中可能存在重要作用[7],推测其在牦牛附睾体部和尾部的低表达可能在牦牛生殖生理过程中起重要作用,但ADAM28在雄性生殖过程中的机制还需后续进一步研究。
4 结 论
本研究成功克隆牦牛ADAM28基因,同时发现ADAM28 蛋白为稳定的带负电蛋白,具有亲水性,存在跨膜结构域;经过qPCR 技术检测,ADAM28在牦牛附睾组织表达分布不均,附睾头的表达显著高于附睾颈和附睾尾。本研究初步对牦牛的ADAM28在牦牛附睾组织的不同表达进行了探索,将为牦牛精子成熟的机制提供一定的基础资料,同时为进一步研究ADAM28基因在牦牛附睾上皮细胞中的功能奠定基础。
