右旋糖酐生产用菌种肠膜状明串珠菌CMCC(B)34991 的全基因组分析
2021-06-18王珊珊石继春杜宗利石刚龙新星叶强徐颖华
王珊珊,石继春,杜宗利,石刚,龙新星,叶强,徐颖华
中国食品药品检定研究院卫生部生物技术产品检定方法及其标准化重点实验室,北京102629
右旋糖酐(dextran)也称葡聚糖,是一种以葡糖苷键连接形成的高分子化合物,因其具有安全、无毒、生物相容性好等优点,在临床上被广泛用于代血浆或补铁剂[1]。《中国药典》二部(2020 版)中收载了右旋糖酐 20、40 和 70 及其不同制剂[2]。右旋糖酐制备方法主要有微生物发酵法和酶合成法,目前国内临床级右旋糖酐主要是由肠膜状明串珠菌CMCC(B)34991(原编号为LM-1226)作为生产用菌种,发酵合成高分子葡聚糖,再经酸水解、乙醇沉淀及烘干最终获得不同分子量的右旋糖酐终产品[1,3]。
生产用菌种是药品研究、生产和检定的物质基础,其质量直接与药物终产品的安全性和有效性密切相关[4]。肠膜状明串珠菌能发酵糖类产生多种酸和醇,具有高产酸、抗氧化和拮抗致病菌等能力,被广泛应用于右旋糖酐和各种食品调味剂的生产,并有望成为新型微生态制剂[1]。最近研究表明,肠膜明串珠菌包括4 个亚种:肠膜亚种(L.mesenteroides subsp.mesenteroides)、右旋葡聚糖亚种(L.mesenteroides subsp.dextranicum)、乳脂亚种(L.mesenteroides subsp.cremoris)和 L.mesenteroides subsp.jonggajibkimchii[5]。目前对肠膜状明串珠菌生产用菌种的质量控制主要包括形态观察、培养特性和发酵率等传统项目,缺乏菌株水平分子特征方面的评价。因此,基于药品生产用菌种的菌株溯源、制剂工艺优化以及检定等方面考虑,了解该生产用菌种的分子特征和遗传背景显得尤为重要。本研究首次应用高通量测序技术,对右旋糖酐生产用菌种肠膜状明串珠菌CMCC(B)34991 进行全基因组序列测定,分析其基因组基本特征,与其他4 种亚种代表菌株进行比较基因组学分析,并探讨其系统发育进化关系。
1 材料与方法
1.1 菌株 肠膜状明串珠菌生产用菌种CMCC(B)34991 来自中国食品药品检定研究院的中国医学细菌保藏管理中心。
1.2 主要试剂及仪器 10%含糖、蛋白胨及其琼脂培养基由中国食品药品检定研究院北京三药科技开发公司配制;其他试剂均为国产分析纯;DNA 提取试剂盒购自德国QIAGEN 公司;TruSeqTMDNA Sample Prep Kit-Set A 和 TruSeq PE Cluster Kit 购自美国Illumina 公司;美国细菌培养箱为中仪国科(北京)科技有限公司产品;VITEK 全自动微生物生化鉴定仪为梅里埃诊断产品(上海)有限公司产品;Bruker MALDI Biotyper 系统为德国Bruker Daltonics 公司产品;超声仪为美国Fisher 公司产品。
1.3 菌株形态观察与生化鉴定 将CMCC(B)34991菌种接种于含糖、蛋白胨培养基复苏,再转接至其琼脂平板培养基,观察菌落形态、革兰染色镜检,并使用VITEK 全自动微生物生化鉴定仪进行生化鉴定。
1.4 基质辅助激光解吸电离飞行时间质谱分析 选取琼脂平板上培养的第2 代单菌落,直接涂至清洗后的基质辅助激光解吸电离飞行时间质谱(MALDITOF MS)靶板上。覆盖1 μL 70%甲酸水溶液,室温下自然晾干。将1 μL HCCA 基质溶液仔细涂敷在每个样本上,室温下晾干。将MALDI 靶板放入质谱仪中进行检测分析。用仪器自带Biotyper 软件对所采集的谱图进行分析。当Bruker Biotyper 系统分值≥1.7 时,认为其结果高度可信。
1.5 16S rRNA 基因序列分析 取CMCC(B)34991菌种新鲜过夜培养物,按照DNA 提取试剂盒说明书提取细菌全基因组DNA,以其为模板,使用通用引物 27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGYTACCTTGTTACGACTT-3′)进行扩增,产物送北京中美泰和生物技术有限公司测序,最后将测序拼接结果提交NCBI 数据库中进行Blast 比对分析。
1.6 全基因组序列测定 使用illumina 公司的第2代solexa 测序技术进行全基因组测序。取1 μg DNA,利用超声仪打断,切胶回收300 bp 片段,将纯化的DNA 利用TruSeqTMDNA Sample Prep Kit-Set A制备文库,并利用TruSeq PE Cluster Kit 进行扩增,最后在Illumina 机器上进行测序反应。应用软件velvet V1.2.03 对数据进行拼装,结合软件glimmer 3.02 进行基因预测;搜寻 NCBI 的 nr 库、KEGG 蛋白数据库以及SEED 蛋白数据库进行基因功能注释,利用CDD 数据库进行直系同源簇(clusters of orthologous groups,COG)分类。通过KEGG 数据库构建代谢通路。
1.7 比较基因组学分析 将CMCC(B)34991 菌种拼接全基因组序列与已发表的4 种肠膜状明串珠菌亚种代表株包括乳脂亚种ATCC 19254(ACKV0-1000000)、L.mesenteroidessubsp.jonggajibkimchii DRC-1506(CP014611-15)、右旋葡聚糖亚种DSM 20484(CP012009-10)和肠膜亚种 ATCC 8293(CP000414-15)进行配对基因组的平均核苷酸一致性(average nucleotide identity,ANI)、DNA-DNA 杂交(DDH)以及共有与特有的基因比较分析。同时将上述5 株肠膜状明串珠菌基因组与其他4 株明串珠菌属细菌(L.pseudomesenteroides KCTC 3652、L.citreum KM20、L.gelidum subsp.gasicomitatum KG16-1 和L.kimchii IMSNU 11154)进行核心基因的系统进化树分析。
2 结 果
2.1 肠膜状明串珠菌生产用菌种的形态及生化特性 CMCC(B)34991 菌种在含糖琼脂平板上的菌落无色透明、中间隆起、边缘整齐。革兰染色为阳性球菌,见图1。生化鉴定结果为肠膜状明串珠菌。

图1 肠膜状明串珠菌CMCC(B)34991 的革兰染色分析结果(× 100)Fig.1 Gram staining of L.mesenteroides CMCC(B)34991 strain(× 100)
2.2 基质辅助激光解吸电离飞行时间质谱分析 3 个重复样品分析结果的系统分值分别为2.326、2.358和2.425,均大于1.7,表明分析结果可靠,均鉴定为肠膜状明串珠菌。
2.3 16S rRNA 基因序列分析 CMCC(B)34991 菌种16S rRNA 测序拼接结果经NCBI 网站进行Blast分析,发现与NCBI 数据库中收录的不同肠膜状明串珠菌的16S rRNA 序列相似度均大于99%。进一步将其与L.mesenteroides subsp.jonggajibkimchii DRC 1506、乳脂亚种ATCC 19254、肠膜亚种ATCC 8293和右旋葡聚糖亚种DSM 20484 四株亚种代表株的16S rRNA 序列比对分析,发现它们之间的核苷酸相似度分别为99.86%、99.79%、99.93%和99.93%。
2.4 全基因组序列分析 经全基因组测序分析,共获得5 673 333 个读长片段,覆盖其基因组大小500倍。对测序数据进行拼装,最终获得36 个基因组contig片段,其中最大contig 片段为695 204 bp,平均每个contig 片段大小为58 365 bp。经拼接比对分析发现,CMCC(B)34991 菌种染色体全基因组序列全长为1 857 684 bp,同时通过结合软件glimmer 3.02 进行基因预测,最终在CMCC(B)34991 菌种基因组中鉴定出2 089 个基因,平均长度为889 bp。编码基因占整个基因组序列的88.4%,其平均GC 含量为38.2%。基因组中非编码基因间区域大小为243 467 bp,在基因组序列中占比为11.6%,基因间区域GC 含量为32.0%。在非编码RNA 中鉴定出44 个tRNA 和3 个 rRNA 序列。
2.5 全基因组序列基因功能分析 应用COG 数据库注释上述已获得的全基因组序列,发现CMCC(B)34991 菌种中共有1 566 个CDS 具有明确的生物学功能,COG 功能注释的蛋白有1 621 个,其中与氨基酸运输、碳水化合物代谢相关的蛋白最多,数量高达328 个,占总注释基因的20.2%,主要负责细菌的氨基酸和碳水化合物转运与代谢(图2);其次为负责转录的蛋白,为119 个。此外,仍有162 个(占9.9%)未知功能蛋白无法获得功能注释,有待后续进一步分析。
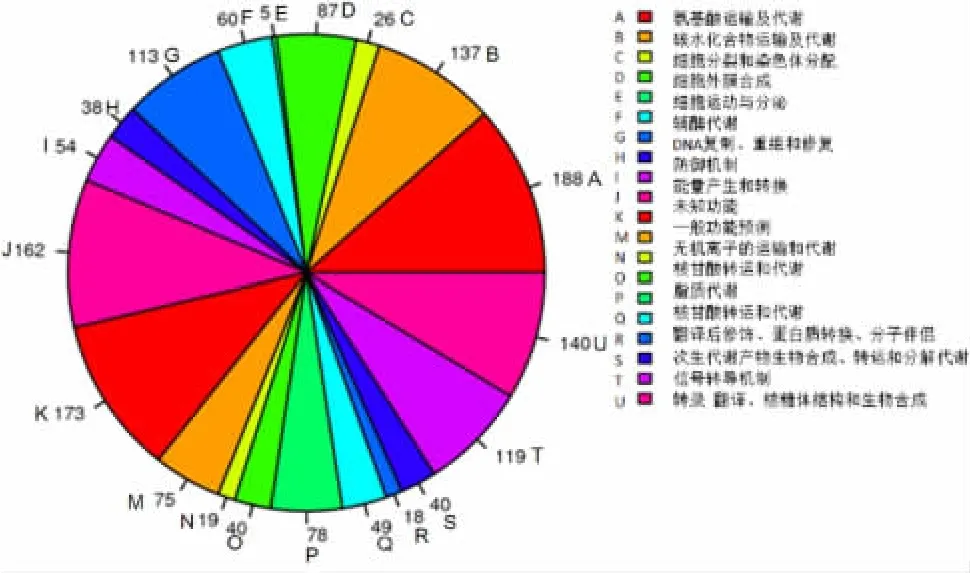
图2 肠膜状明串珠菌CMCC(B)34991 菌种基因组的COG聚类分析Fig.2 COG clustering analysis of genome of L.mesenteroides CMCC(B)34991 strain
通过KEGG 数据库构建代谢通路,分析表明,CMCC(B)34991 菌种中1 125 个蛋白具有KEGG的ortholog。KEGG 功能分类主要包括对细胞内过程、环境信息处理过程、遗传信息处理过程、代谢和有机系统(图3),其中代谢类基因数量最多,占KEGG 注释总基因数的63.5%;其次为环境信息处理过程基因数量,具体包括膜转运和信号转导通路,占比分别为9.7%和4.4%。
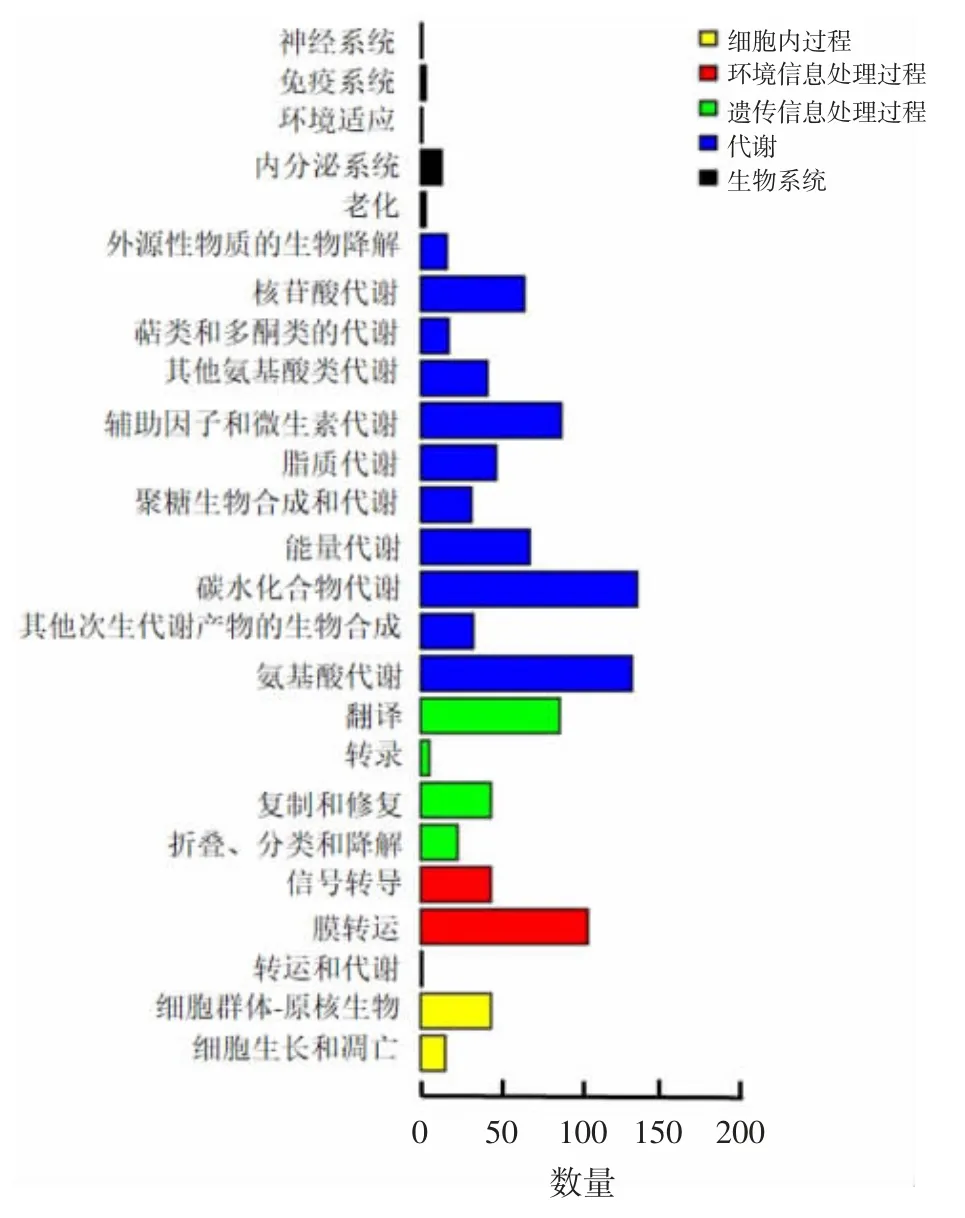
图3 肠膜状明串珠菌CMCC(B)34991 菌种基因组的KEGG 代谢通路分类Fig.3 Classification of KEGG metabolic pathways in genome of L.mesenteroides CMCC(B)34991 strain
2.6 比较基因组学分析 ANI 分析结果显示,5 株肠膜状明串珠菌之间的核苷酸一致性很高,在98.7% ~99.0%之间,见表 1;CMCC(B)34991 菌种与 4 种肠膜状明串珠菌亚种代表株在全基因组水平的核苷酸一致性均在98.7%以上,其中与右旋葡聚糖亚种DSM 20484 的同源性最高,为99.0%;DDH 杂交分析表明,CMCC(B)34991 菌种与4 种肠膜状明串珠菌亚种代表株的DDH 数值在89.6% ~91.6%之间。
通过维恩图分析共有和特有基因,发现5 个全基因组共有的核心基因有1 186 个,见图4,CMCC(B)34991 菌种基因组特有的基因有247 个。

图4 CMCC(B)34991 菌种与4 株肠膜状明串珠菌亚种代表株的共有和特有基因维恩图Fig.4 Venn diagram of common and specific genes of CMCC(B)34991 strain and four representative strains of L.mesenteroides subspecies
2.7 系统发育进化分析 系统发育进化分析显示,CMCC(B)34991 菌种与4 种肠膜状明串珠菌亚种代表株共属于一个进化分支,但由于5 株肠膜状明串珠菌之间核苷酸同源性较高,尽管5 株肠膜状明串珠菌又被分成4 个小分支,但它们之间的进化距离非常近。其他4 株明串珠菌属细菌分别位于不同进化分支,与肠膜状明串珠菌进化明显不同。见图5。

图5 肠膜状明串珠菌CMCC(B)34991 全基因组系统进化分析Fig.5 Phylogenetic analysis of whole genome of L.mesenteroides CMCC(B)34991 strain

表1 CMCC(B)34991 菌种与4 种肠膜状明串珠菌亚种代表株之间的ANI 和DDH 分析结果(%)Tab.1 ANI and DDH analyses of between CMCC(B)34991 and four representative strains of L.mesenteroides subspecies(%)
3 讨 论
在任何一个国家或地区,任何一种微生物要成为一株药品生产用菌种,前期均需大量的有效性和安全性验证试验[4]。肠膜状明串珠菌CMCC(B)34991自20 世纪50 ~60 年代起一直用于国内右旋糖酐的生产。由于传统的质控方法只能鉴定到肠膜状明串珠菌,并不能提供肠膜状明串珠菌CMCC(B)34991的特定信息,为了全面了解生产用菌种的特征,在传统形态与生化反应之外,本研究应用包括细菌自动生化鉴定、质谱、16S rRNA 以及全基因组多种不同原理的微生物鉴定和溯源方法对肠膜状明串珠菌CMCC(B)34991 进行了分析,丰富了该生产用菌种的特征性背景资料。
目前,16S rRNA 基因序列广泛用于细菌鉴定和分类,但由于16S rRNA 在同一种属细菌内核苷酸同源性很高,在用于一些同源性较高的细菌亚种分析就存在局限性[6-7]。本研究结果发现,CMCC(B)34991 菌种与4 种肠膜状明串珠菌亚种代表株的16S rRNA 基因序列仅差1 ~2 个碱基,核苷酸相似性均在99.5%以上。随着高通量测序技术的发展,细菌全基因组的测序成本极大降低[8-10]。与单个特征基因序列分析比较,基于全基因组水平进行微生物鉴定与分类具有更高的分辨率和准确性。同一种属两株细菌之间的ANI 值 ≥ 95%或DDH 值 ≥ 70%通常认为这两株细菌为同一亚种[11-12]。本研究发现,CMCC(B)34991 菌种与4 种肠膜状明串珠菌亚种代表株的ANI 值均在98.5%以上,DDH 值均超过89%,进一步支持肠膜状明串珠菌亚种之间的核苷酸同源性很高。由于其同源性太高,研究人员建议当肠膜状明串珠菌亚种ANI 值≥99%或DDH 值≥91%,认为隶属同一亚种[5]。按照该推荐标准,CMCC(B)34991 菌种与右旋葡聚糖亚种DSM 20484 的ANI值和DDH 值分别为99.0%和91.4%,建议CMCC(B)34991应为右旋葡聚糖亚种。
肠膜状明串珠菌jonggajibkimchii 亚种为2017年报道新发现的亚种,基于本研究比较基因组学分析获得core 基因的系统进化树显示,5 株肠膜状明串珠菌位于同一个进化分支内,与其他4 种明串珠菌种属细菌进化距离明显不同。结合上述ANI 与DDH分析结果,也进一步支持DRC 1506 菌株为肠膜状明串珠菌新亚种。原核生物基因组中的共有基因在其物种长期进化过程中的适应性进化与筛选重要功能性状方面具有重要意义[13-14],因此,为了更深入地了解肠膜状明串珠菌的进化历程,建议后续应进行比较基因组学获得5 株肠膜状明串珠菌1 186 个共有基因的功能分析。同时,筛选获得各株细菌基因组的特有基因也为研究特定菌株的生物学功能提供了可能[15]。考虑到CMCC(B)34991 菌种作为右旋糖酐生产用菌种的特殊性,本研究获得其基因组中247 个特有基因,为将来实现生产用菌种菌株水平的鉴定与质量控制奠定了良好的基础。
综上所述,本研究首次获得了我国右旋糖酐生产用菌种肠膜状明串珠菌CMCC(B)34991 的全基因组基本特征,并详细分析了基因功能、同源性及其系统发育进化关系,不仅为后续鉴定生产用菌种到菌株水平的质量控制提供了数据支持,也为后续右旋糖酐生产工艺的优化奠定了基础。
志谢感谢上海人类基因组研究中心郑华军、朱永强和金磊给予的帮助
