家族聚集性与散发性LAA脑梗死患者CYP2C19及GPⅡb/Ⅲa基因表达差异研究*
2021-06-18许双双王燕华吕玉芹张敬军
郝 瑞 许双双 高 敏 王燕华 吕玉芹 王 娜 张敬军
1. 山东省泰山医院,山东 泰安 271000; 2.山东第一医科大学第二附属医院,山东 泰安 271000
大动脉粥样硬化性 (large-artery atherosclerosis, LAA) 脑梗死发病机制尚未阐明,部分LAA脑梗死患者具有家族聚集性[1-3]。部分LAA脑梗死患者对氯吡格雷疗效存在明显个体差异,这些现象的发生机制尚未完全阐明,推测可能与ADP、CYP2C19、P2Y12及GPⅡb/Ⅲa等基因多态性有关[2],关于这些基因是否参与LAA脑梗死形成发病机制研究报道较少。本研究探讨家族聚集性LAA脑梗死、散发性LAA脑梗死及对照组ADP蛋白表达、CYP2C19基因、P2Y12基因G52T位点及GPⅡb/Ⅲa蛋白表达差异,为LAA脑梗死发病机制及分层防治提供理论依据。
1 材料与方法
1.1 对象
1.1.1分组 分别选择25例(中国北方汉族)三甲医院神经内科住院家族聚集性LAA脑梗死患者(经CT或MRI 证实)及散发性LAA脑梗死患者为家族组及散发组。按照家族聚集性LAA脑梗死及散发性LAA脑梗死的诊断标准严格入选所有患者。选择25例与LAA脑梗死患者同期就诊于同一医院其他科室的非心脑血管病患者为对照组,要求与先证者同性别、同民族、年龄相差不超过5 岁。使用NIHSS评分量表对入院患者行NIHSS评分(总分为0~42分),分数越高说明神经功能缺损程度越重。常规治疗3个月后随访其神经功能恢复情况,用mRS评分量表进行评分,分数越高说明神经功能恢复程度越差。3组研究对象一般临床资料见表1。
1.1.2纳入标准 脑梗死和LAA脑梗死诊断标准参照文献[4];家族聚集性LAA脑梗死诊断标准参照文献[3]。
1.1.3排除标准 排除心源性栓塞所致脑梗死,如在狭窄>50%或闭塞颅内或颅外大动脉支配区之外无急性梗死灶,没有心源性卒中中度或高度危险因素。最近有颅脑损伤、肿瘤、手术、创伤、自身免疫性疾病及严重心、肺、肾等疾病;有严重肝肾疾病、血液疾病及自身免疫性疾病。
该研究得到山东第一医科大学第二附属医院伦理委员会批准,所有受试者均签署知情同意书。
1.2 方法
1.2.1标本处理 所有入选患者在清晨空腹状态下抽取静脉血2 mL(EDTA采血管),采血后轻晃摇匀抗凝管,2 h内将抗凝管放置在-80 ℃的冰箱中。ELISA血液检测要求:将收集到的抗凝血液加入淋巴细胞分离液,2500 r/min离心10 min,收集分离后的上清液,-80 ℃的冰箱中保存。
1.2.2qPCR表达实验操作步骤 (1)从血液中抽提总RNA:将冰冻血液样品复温至常温状态,用力摇晃混合均匀,放置5 min,将血液样本转移至1.5 mL尖底离心管,常温状态下12 000 r/min离心2 min,丢弃上清液,反复离心处理完固定液,将0.75 mL去离子水加入固定液中,用枪头吹打沉淀物;同样条件下离心2 min,弃上清,将离心管扣在吸水纸上1 min。加入100 μL Buffer BR2,反复吹打10次悬浮沉淀物。释放RNA,加入300 μL Buffer BR3,用力摇晃3次,室温放置10 min。将所得产物转入DNA吸附柱-RD,常温状态下8000 r/min离心30 s后转入收集管,进行RNA提取;RNA洗脱:将吸附柱-A转入试剂盒原本的1.5 mL离心管内,在硅胶膜中央加15 μL ddH2O,把1.5 mL离心管盖(A)反置于RNA吸附柱上,做好标记,去除RNA吸附柱的盖子(B)。常温状态下12 000 r/min离心1 min。(2)RNA反转录成cDNA:在RNase-Free的PCR管中加入RNA 1 μg,DEPC·H2O补足11 μL,摇晃均匀,65 ℃条件下孵育5 min,立即冰浴;再依次加入5×reaction buffer 4.1 μL、RiboLockTM Ribonuclease inhibitor (20 u/μL) 0.6 μL、dNTP mix (10 mM) 2.1 μL、Reverse Tra Ace 1.1 μL、Oligo(dT) primer (0.5 μg/μL) 1.1 μL,42 ℃孵育60 min后,72 ℃孵育10 min。所得cDNA置于-20 ℃或即刻PCR。(3)qPCR引物设计:根据目的基因排列顺序设计并合成qPCR检测引物(表2)。(4)RT-PCR预实验:利用mRNA逆转录产生cDNA作为PCR扩增模板,用目的基因特异性引物和内参引物扩增待检测的目的基因片段和看家基因,探索最佳qPCR上机数值,若有杂带再次调整PCR扩增时的退火温度,直至杂带消失。(5)qPCR正式实验:在RT-PCR预实验找出最适合引物退火温度和模板量,运用2×SYBR Green Mix配置qPCR Mix,根据需要上机的样品数量和重复次数,计算并配置qPCR Mix。将配置好的MIX分别置于AXYGEN PCR 8连管内,微型离心机瞬时离心混匀PCR体系;将以上实验体系放到荧光定量PCR仪中,SYBR Green法荧光定量PCR以检测各基因的表达量。
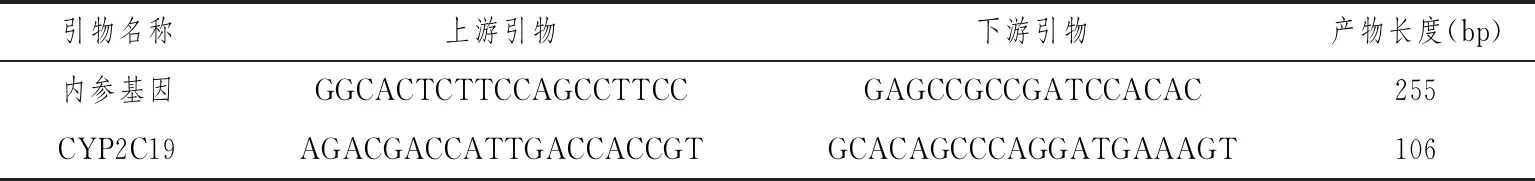
表2 RT-RCR检测引物信息
1.2.3数据分析 由于RNA提纯后获得率不一致、RNA逆转录为cDNA的效率有差异等原因,为了校正因样品开始时浓度差异对实验结果的影响,在进行目的基因数量检测时加入看家基因进行标准化。用△△Ct法进行各基因表达的相对定量。
1.2.4蛋白含量测定 采用ELISA法,标准品与样品中的待检测因子与单抗结合,加入酶标抗体,形成免疫复合物连接在板上,加入酶底物TMB,测定450 nm处的OD值。
1.3 统计学分析
2 结 果
2.1 3组研究对象ADP 表达量
用ELASA法检测ADP表达量,结果显示ADP在家族组高表达,散发组中表达,对照组低表达。实验数据应用方差分析,家族组与对照组比较ADP表达量差异有统计学意义(P<0.05),家族组与散发组及散发组与对照组比较ADP表达量差异无统计学意义(P>0.05)。见表3。

表3 3组研究对象ADP表达量
2.2 3组研究对象CYP2C19基因表达量
CYP2C19基因在3组的相对表达量比较差异有统计学意义(P<0.05);与对照组比较,家族组中CYP2C19基因表达明显下调,差异有统计学意义(P<0.05);CYP2C19基因在散发组与对照组中表达量差异无统计学意义(P>0.05)。见表4。

表4 3组研究对象cyp2c19基因表达量
2.3 3组研究对象CYP2C19蛋白表达量
CYP2C19蛋白表达量在家族组、散发组及对照组中差异无统计学意义(P>0.05),见表5。
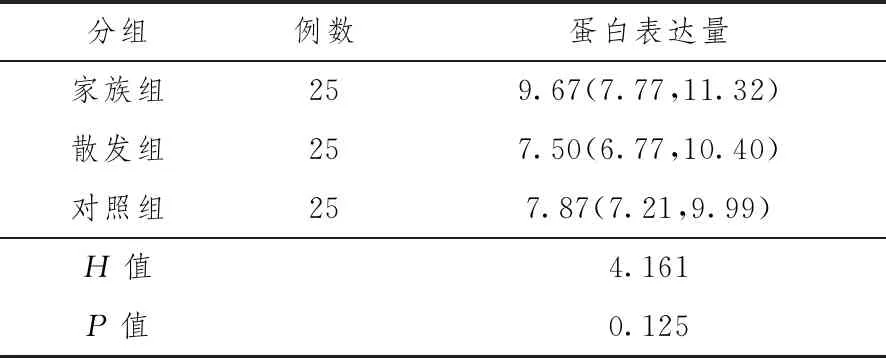
表5 3组研究对象CYP2C19蛋白相对表达量
2.4 3组研究对象P2Y12基因G52T位点多态性
实时定量PCR技术检测血小板膜受体P2Y12的基因序列在G52T位点单核苷酸多态性,基因型分布频率为家族组GG 22例(88.0%),GT 3例(12.0%),TT 0例(0.0%);散发组GG 18例(72.0%),GT 7例(28.0%),TT 0例(0.0%);对照组GG 14例(56.0%),GT 10例(40.0%),TT 1例(4.00%)。P2Y12 基因的G52T位点在家族组、散发组和对照组之间差异有统计学意义(χ2= 11.261,P=0.024),GG基因型携带者有患脑血栓的高风险。
2.5 3组研究对象GPⅡb/Ⅲa 表达量
用ELASA法检测GPⅡb/Ⅲa表达量,结果显示GPⅡb/Ⅲa在家族组高表达,散发组中表达,对照组低表达,家族组与对照组比较GPⅡb/Ⅲa表达量差异有统计学意义(P<0.05),家族组与散发组及散发组与对照组比较GPⅡb/Ⅲa表达量差异无统计学意义(P>0.05)。见表6。

表6 3组研究对象GPⅡb/Ⅲa表达量
2.6 家族组和散发组入院时NIHSS评分和治疗3个月后mRS评分比较
家族组及散发组入院时NIHSS评分差异无统计学意义(P>0.05);家族组及散发组治疗3个月后mRS评分差异有统计学意义(P<0.05)。见表7。

表7 家族组与散发组NIHSS及mRS评分
家族组及散发组研究对象P2Y12受体在G52T位点不同基因型分为GG组(GG基因型)和GT组(GT基因型),行入院NIHSS评分比较,GG组和GT组差异无统计学意义(P>0.05),常规治疗3个月后随访行mRS评分比较,GG组和GT组mRS评分差异无统计学意义(P>0.05)。见表8。
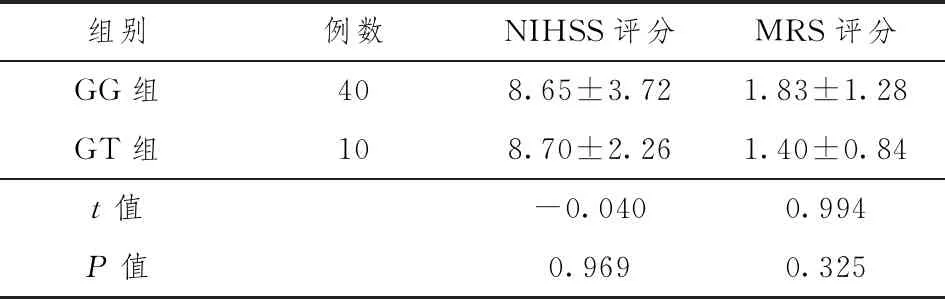
表8 GG与GT组NIHSS及mRS评分
3 讨 论
LAA脑梗死呈现家族聚集现象,LAA脑梗死先证者一级亲属患病率是对照组患病率的3.14倍,LAA脑梗死家族史是LAA脑梗死发生的重要危险因素。ADP、CYP2C19、P2Y12及GPⅡb/Ⅲa等基因多态性与LAA脑梗死疗效密切相关[5-6],但与家族聚集性LAA脑梗死发病机制及预后研究报道较少。
3.1 ADP与脑血栓发病机制研究
血小板有3种ADP受体: P2Y12 、P2Y1及P2X1 受体。P2Y12 受体存在于血小板膜上,ADP是促进血小板活化的重要激动剂之一[5]。ADP以较高浓度储存在血小板致密颗粒中,当血小板受到刺激活化后,ADP 从致密颗粒中释放出来作用于多种受体,增强自身及其他诱导剂对血小板的诱导作用并促进LAA脑梗死形成。本实验结果显示ADP在家族组高表达,说明家族组易导致LAA脑梗死发生。ADP增高导致家族聚集性LAA脑梗死发生的可能机制:(1)ADP与血小板表面P2Y12或P2Y1受体结合,进一步激活血小板和加强了活化信号转导,激活LAA脑梗死形成的最终通路,即GPⅡb/Ⅲa与纤维蛋白原配体结合;(2)ADP所引起的血小板聚集与浓度密切相关,低浓度ADP刺激不引发内源性纤维蛋白原释放,高浓度ADP才引起其释放,即使没有外源性刺激也可以导致或加强血小板聚集。
p450参与临床70%~80%的药物代谢一期反应,其中CYP2C19约占20%,其参与许多临床药物代谢,如抗血小板前药氯吡格雷[6]。CYP2C19*2是CYP2C19的主要遗传缺陷等位基因,在黄种人和白种人中占代谢不良者的75%~85%[7]。研究显示家族组与散发组及对照组比较,CYP2C19基因表达量明显下调,这可能是导致家族聚集性LAA脑梗死发生或复发的原因之一,其可能机制为:(1)CYP2C19参与花生四烯酸的肝外代谢对LAA脑梗死形成有影响的环氧花生酸,其与LAA脑梗死发病风险有关;(2)CYP2C19弱代谢型个体更易发生LAA脑梗死,急性LAA脑梗死患者弱代谢型个体更易在急性期病情进展加重[8];(3)CYP2C19 功能缺失基因型降低了其编码的酶活性,经其代谢的表氧二十碳三烯酸水平随之降低,表氧二十碳三烯酸具有降血压、抗炎、抗凝、抗动脉粥样硬化等作用,从而导致LAA脑梗死发病风险增加[9];(4)CYP2C19 G681A的A基因型和A等位基因可能与LAA脑梗死发生和复发有关,是LAA脑梗死的独立危险因素[10];(5)CYP2C19基因与LAA脑梗死复发有关。文献报道急性LAA脑梗死患者76例口服氯吡格雷治疗,根据患者CYP2C19的分型将患者分为3组,结果显示弱代谢型患者早期病变复发率明显高于其他组[11]。CYP2C19失功能等位基因会增加LAA脑梗死复发风险,其多态性是不良功能预后的预测因子,但这种作用会随着时间推移逐渐减弱[12]。CYP2C19基因与LAA脑梗死发生发展及疗效密切相关[13-14]。
CYP2C19的蛋白表达量在家族组、散发组和对照组之间无差异,说明CYP2C19对LAA脑梗死形成的影响仅在基因水平发挥作用,蛋白质水平无影响,其机制不清,可能存在转录水平的修饰使得修饰后的基因不再被翻译,或者CYP2C19基因存在多种突变结构,不排除突变后的基因不再表达相应蛋白质的可能,详尽机制待进一步研究。
3.2 P2Y12基因G52T位点多态性与脑血栓发病机制研究
血小板膜受体P2Y12基因G52T位点多态性可能影响氯吡格雷疗效,但是否影响LAA脑梗死的发病机制未见报道。研究发现ADP最主要受体P2Y12基因在G52T位点表达差异,其中GG基因型在家族组的分布频率最高,散发组居中,对照组较低,推测GG基因型可能与家族聚集性LAA脑梗死发病相关,其可能机制是:该基因型的外显子通过作用于mRNA,改变氨基酸类型,进而影响编码蛋白功能,影响ADP与受体结合,促进血小板聚集,诱发LAA脑梗死发生,其详尽机制待进一步研究。
3.3 GPⅡb/Ⅲa表达量与脑血栓发病机制研究
GPⅡb/Ⅲa是由GPⅡb(CD41)和GPⅢa(CD61)两个亚基借助钙离子以非共价键形式相互连接而成的功能单位。血小板活化的主要标志为GPⅡb/Ⅲa构象改变。GPⅡb/Ⅲa激活是血小板“瀑布式”聚集的最终共同通路和核心环节。一旦GPⅡb/Ⅲa出现缺陷,血小板即使被激活,也不能聚集。实验结果显示GPⅡb/Ⅲa在家族组高表达,说明家族组易导致LAA脑梗死发生,其可能机制:(1)高表达的GPⅡb/Ⅲa和纤维蛋白原结合是LAA脑梗死形成的最终通道,血小板变构而富有高度亲和力,连接相邻血小板并与血管性血友病因子相互结合,促进血小板聚集,导致LAA脑梗死发生;(2)GPⅡb/Ⅲa基因多态性可能影响LAA脑梗死发生。文献报道3209例白种人LAA脑梗死患者,GPⅡb基因(ITG2B基因)和GPⅢa基因(ITGA3基因)与LAA脑梗死发生有关[15]。PLA2基因突变促进GPⅡb/Ⅲa和纤维蛋白原结合,加剧血小板聚集[16]。也有研究报道ITG2B和ITGA3基因与脑梗死发生无关。目前该受体基因多态性对LAA脑梗死的影响意见不一,待进一步深入研究。
3.4 家族组与散发组神经功能缺损及预后与遗传相关性研究
家族组及散发组入院NIHSS评分差异无统计学意义,说明两组患者发病时神经功能缺损程度无明显差异,经常规治疗,对两组患者3月后随访mRS评分,两组患者mRS评分差异有统计学意义,家族组较散发组差,是否与遗传因素有关待深入研究。研究发现,GG组和GT组入院NIHSS评分及出院3个月后mRS评分比较,差异均无统计学意义,说明两组患者神经功能缺损程度与P2Y12受体在G52T位点的基因亚型无关,详尽机制待进一步研究。
LAA脑梗死形成与遗传及环境等因素密切相关,多数LAA脑梗死形成的遗传方式属于多基因遗传,即多个微小效应基因,在多因素作用下产生一个总效应从而导致LAA脑梗死发生。家族聚集性LAA脑梗死发生与ADP、CYP2C19、P2Y12及GPⅡb/Ⅲa等基因多态性相关,其多态性影响LAA发生、发展、治疗及预后情况,需进一步深入研究其作用机制,阐明药物基因组学个体代谢能力差异机制,为脑血管病分层防治提供新的理论依据。
利益冲突所有作者均声明不存在利益冲突