H-TiO2/g-C3N4的制备及光催化降解性能研究
2021-06-18李超钟婉菱刘小明雷彩霞
李超,钟婉菱,刘小明,雷彩霞
(广西大学 资源环境与材料学院,广西 南宁 530004)
0 引 言
我国水资源短缺,人均可用水量低,且工业废水排放量大[1],将工业废水中的有毒有害物质[2]处理后可得到干净的淡水。因此,将工业废水处理净化之后加以循环利用,能够有效缓解我国水资源短缺问题。光催化技术可直接利用太阳能,将有毒有害物质降解为无毒的小分子量的有机物和水,处理过程绿色无二次污染被视为处理废污水的有效方案。常见的半导体光催化剂有TiO2,g-C3N4,ZnO,α-Fe2O3等[3-6]。纳米TiO2因其稳定性和无毒性被认为是富有前景的光催化材料,但TiO2的宽禁带(约3.2 eV)和光生电子与空穴的高复合速率限制其广泛应用[7]。同时,g-C3N4作为一种原料丰富的新型半导体材料备受关注。然而,单一的g-C3N4同样受制于光生电子-空穴对复合快的限制,不能满足于应用[8]。将TiO2与g-C3N4两种光催化剂复合是一种提高光催化效率的有效方式。N.T.T.Truc等[9]将g-C3N4与Nb-TiO2进行复合,50Nb-TiO2/50g-C3N4材料拥有高还原CO2能力,达到了利用可见光的目的,提高了光催化剂效率。由于g-C3N4呈二维纳米片结构,较多研究选择将g-C3N4包裹在其他材料上进行复合,这样能够很好地保持材料形貌,但很少有人研究g-C3N4的引入对其他材料的形貌影响。以往研究[10]表明,水热液相沉积法可以直接制备得到光催化活性较高的锐钛矿型TiO2纳米颗粒,且这个制备过程为水解过程,能够通过化学结合力将TiO2与其他基底材料进行很好地复合。
本文将g-C3N4添加到H-TiO2水热前驱体溶液中,使H-TiO2在形成过程中依靠化学作用力结合在g-C3N4表面。以g-C3N4添加量为变量,研究不同g-C3N4添加量对H-TiO2的微观形貌及光催化降解性能的影响,以期为TiO2和g-C3N4的水热复合提供研究基础。
1 实 验
1.1 实验材料
六氟钛酸铵(AR,上海麦克林生化科技有限公司产),硼酸(AR,广东光华科技股份有限公司产),脲(AR,广东光华科技股份有限公司产),罗丹明B(AR,国药集团化学试剂有限公司产),P25(AR,广东光华科技股份有限公司产),无水乙醇(AR,广东光华科技股份有限公司产),去离子水(实验室自供)。
1.2 实验仪器
78-1磁力加热搅拌器(金坛市医疗仪器厂产),CP-114型电子天平(奥豪斯仪器上海有限公司产),特氟龙水热反应釜(南京瑞尼克科技开发有限公司产),TGl6-WS台式高速离心机(湘仪离心机仪器有限公司产),DHG-9240电热鼓风干燥箱(上海精宏实验设备有限公司产)。
1.3 光催化剂制备
水热辅助液相沉积TiO2的合成:向300 mL的0.025 mol/L六氟钛酸铵溶液中加入1.397 1 g硼酸,搅拌10 min后转移至500 mL特氟龙水热釜中,将水热釜在烘箱中170 ℃保温3 h,反应产物用去离子水和无水乙醇离心清洗3次后,于80 ℃烘干,即可得到TiO2白色粉末,将样品命名为H-TiO2。
g-C3N4的合成:使用热聚合[11]合成g-C3N4。称取8 g脲置于带盖坩埚中,用厚20 μm的锡纸包裹坩埚以减少热处理过程中脲的挥发。将包覆好的坩埚置于马弗炉中,按速率10 ℃/min升温至600 ℃并保温6 h。待坩埚在马弗炉中自然冷却时取出,即可得到淡黄色g-C3N4粉末。
H-TiO2/g-C3N4复合材料的合成过程:取一定量的g-C3N4粉末(75,150,300 mg),加入300 mL的0.025 mol/L六氟钛酸铵溶液中,将溶液超声分散15 min后加入1.397 1 g硼酸,搅拌10 min后转入特氟龙水热釜进行水热反应。反应条件与合成H-TiO2一致。将样品命名为H-T-CN-75,H-T-CN-150和H-T-CN-300。
1.4 样品表征
使用日本理学公司Rigaku D/MAX 2500V型X射线衍射仪进行测试,扫描角度10°~80°,步进速度0.02°/s;扫描电镜使用日立高新科技SU8020新型高分辨场发射扫描电镜及配套的EDS配件进行表征;氮气吸附脱附测试使用贝士德仪器科技(北京)有限公司的3H-2000PM2型仪器测试。光催化反应装置为北京中教金源科技有限公司生产的CEL-HXB F300型号300W氙灯;紫外可见分光光度计使用岛津国际贸易有限公司生产的UV-2550型可见分光光度计。
1.5 光催化性能测试
将50 mg光催化剂分散到100 mL的罗丹明B溶液(10 mg/L)中,超声分散15 min后,于暗室搅拌30 min,达到吸附脱附平衡。将达到吸附脱附平衡的悬浊液用300 W氙灯(波长350~800 nm)照射,间隔3 min取样1次,每次取4 mL。将光催化降解后得到的样品离心去除光催化剂后,用紫外可见分光光度计测量吸光度,取550 nm波长处吸光度数据转换得到罗丹明B浓度,根据罗丹明B溶液浓度计算出光催化剂随时间的降解率。降解率按式(1)计算,一级反应速率常数k根据式(2)计算[12]:
降解率=(1-Ct/C0)×100%,
(1)
kt=-ln(Ct/C0),
(2)
其中,Ct为取样时溶液浓度,mol/L;C0为10 mg/L的罗丹明B溶液浓度,mol/L。
2 结果与讨论
2.1 物相分析
图1为H-TiO2,H-T-CN-75,H-T-CN-150,H-T-CN-300和g-C3N4样品的XRD图谱。由图1可以看出,H-TiO2样品在25.2°,37.8°,47.8°,53.8°,54.8°等位置出现特征衍射峰,与JCPDS#21-1272卡片匹配良好,表明通过水热辅助液相沉积法可成功制备出锐钛矿相TiO2。在g-C3N4的XRD图谱中,主要出现了位于13.4°的(001)峰和位于27.5°的(002)特征衍射峰,这与王心晨等[13]研究结果一致。H-T-CN系列样品的XRD图谱为锐钛矿TiO2和g-C3N4两者特征衍射峰的简单叠加,这表明复合样品中没有新组分生成。
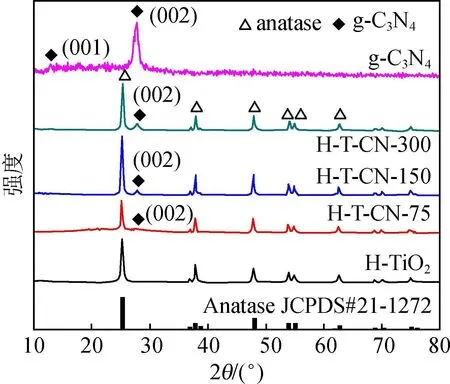
图1 H-TiO2,H-T-CN-75,H-T-CN-150,H-T-CN-300和g-C3N4样品的XRD图谱
对比分析H-T-CN系列复合样品的XRD结果可以看出,随着g-C3N4加入量增加,位于27.5°位置的特征衍射峰也明显增强。
2.2 微观形貌分析
图2分别是H-TiO2,g-C3N4,H-T-CN-75,H-T-CN-150,H-T-CN-300样品的SEM图。从图2可以看出,水热辅助液相沉积法制备得到的TiO2颗粒为表面粗糙的球状,直径约300 nm。g-C3N4表现出典型的二维纳米片结构。随着g-C3N4加入,可明显观察到H-T-CN样品中球状的H-TiO2颗粒和g-C3N4纳米片,并且g-C3N4纳米片包裹在H-TiO2颗粒表面,表明TiO2和g-C3N4复合成功。同时,随着g-C3N4引入,H-TiO2颗粒形貌发生了较明显的变化:H-TiO2单质颗粒表现出粗糙的球状颗粒,加入g-C3N4后H-TiO2表面粗糙度明显降低。此外,引入g-C3N4后,H-TiO2颗粒直径从300 nm增加到1~1.5 μm。该现象可以通过H-TiO2的成核生长机制解释。

图2 H-TiO2,g-C3N4,H-T-CN-75,H-T-CN-150,H-T-CN-300样品的SEM图
本实验中,以(NH4)2TiF6作为钛源,硼酸作为F-捕获剂,通过水解反应得到TiO2粉末,反应方程为[14-15]
(3)
(4)
(5)
根据经典成核-生长理论,水热辅助液相沉积法制备H-TiO2粉末过程中,(NH4)2TiF6在溶液里水解生成大量的TiO2纳米颗粒充当晶核。根据Ostwald熟化理论[16],TiO2纳米颗粒之间接触、结合,最终生成TiO2颗粒粉末,如图2(a)中H-TiO2SEM图所示。在该实验中,g-C3N4由尿素热聚合生成,g-C3N4中残留有部分未参与热聚合反应的尿素且g-C3N4表面有NH4+基团。在高于80 ℃的条件下尿素发生以下反应[16]:
(6)
制备H-TiO2/g-C3N4时,加入g-C3N4后,首先会在溶液中引入一定量的NH4+,这部分NH4+与TiF62-发生如下反应[16]:
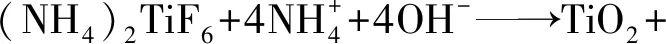
(7)
根据式(7),水热反应开始前溶液中已经存在部分TiO2纳米粒子,该粒子在水热过程中可以直接充当晶核,进而参与TiO2颗粒的晶体生长。水热反应开始阶段,由于式(6)反应发生,使式(7)直接生成TiO2的过程优先于式(3)~(5)的多级水解反应。结果表现为水热反应溶液中更多TiO2颗粒充当晶核进入到晶体生长过程。本实验中,水热反应时间设为3 h,加入g-C3N4样品在制备过程中减少了晶体成核的时间,使得TiO2颗粒有充足的时间进行晶体生长,结果表现为H-T-CN系列样品中TiO2颗粒直径大于H-TiO2样品的。此外,对比H-T-CN-75,H-T-CN-150和H-T-CN-300三组样品,发现TiO2颗粒直径随着g-C3N4加入量的增加而减小,产生这一现象原因为:随着g-C3N4加入量增多,溶液中引入了更多的可以与TiF62-发生反应的NH4+,生成了更多的TiO2粒子充当晶核进而晶体生长。由于溶液中钛源总量固定,更多晶核在同一时间进行晶体生长,使TiO2颗粒的直径减小。
图2(f)是样品H-T-CN-300的EDS能谱图。从图2(f)可以看出,T-CN-300复合样品中不仅含有TiO2的Ti和O元素,g-C3N4的C和N元素,而且还含有F元素。F元素是(NH4)2TiF6钛源水解生成TiO2过程中引入的。根据于伟等[17]研究,F-的引入可以有效提高TiO2的光催化活性。此外,C和N元素分布均匀,Ti和O元素较为集中,g-C3N4包裹在TiO2外层,即水热液相沉积法制备的H-T-CN样品中TiO2和g-C3N4复合效果良好。
2.3 样品的氮气吸附-脱附
图3(a)为样品的吸附-脱附等温线,图3(b)为样品的孔径分布。由图3(a)可知,所有样品表现出典型的IV型等温线,迟滞环是明显的H3型。根据BET计算,H-TiO2,H-T-CN-75,H-T-CN-150,H-T-CN-300和g-C3N4的比表面积分别为46.34,22.31,31.79,50.35和95.57 cm3/g。单质的g-C3N4表现出最大的比表面积,H-T-CN-75和H-T-CN-150样品的比表面积低于单质的H-TiO2和g-C3N4的比表面积。这个现象可以从以下两个方面解释:首先由样品的SEM测试可以看出,加入少量g-C3N4时,H-TiO2颗粒直径增大,导致样品的比表面积降低;其次根据样品的孔径分布可以看出,H-TiO2样品存在大量直径2~10 nm的孔,随着g-C3N4加入,这些孔消失,样品的比表面积降低。随着g-C3N4加入量增加到300 mg,H-T-CN-300的比表面积大于单质的H-TiO2的比表面积,这表明加入一定量的g-C3N4可以有效增加样品的比表面积,可明显提高样品的催化活性。

图3 H-TiO2,H-T-CN-75,H-T-CN-150,H-T-CN-300,g-C3N4样品的氮气吸附脱附-等温线和孔径分布图
2.4 固体紫外漫反射
图4是样品的固体紫外漫反射图。由图4(a)可以看出,H-TiO2只能吸收紫外波长范围内的光,而g-C3N4可以吸收400 nm波长的光,g-C3N4的加入有效拓宽了H-T-CN系列样品的吸光范围。根据Kubelka-Munk式计算样品的禁带宽度[18],
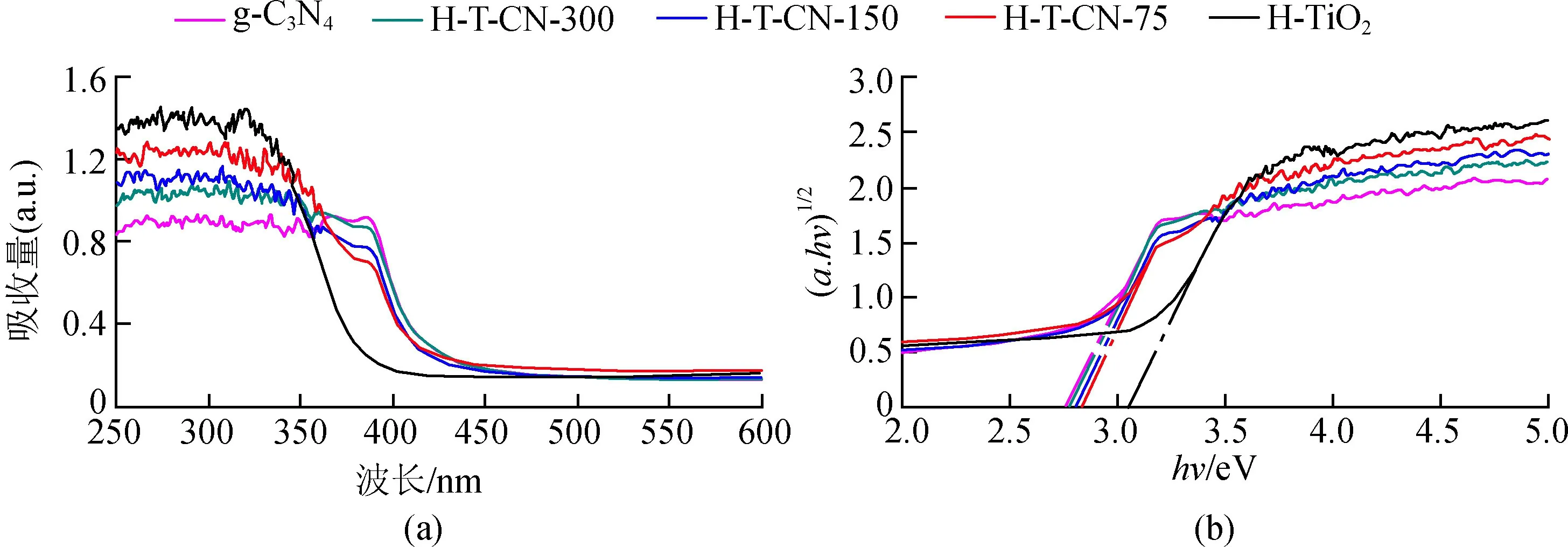
图4 H-TiO2,H-T-CN-75,H-T-CN-150,H-T-CN-300,g-C3N4样品的固体紫外漫反射图
F(R)hν=C(hν-Eg)p,
(8)
式中:hν为光子能量;C为常数;Eg为禁带宽度;p取决于半导体类型,该体系中p=2。
由式(8)可知,H-TiO2,H-T-CN-75,H-T-CN-150,H-T-CN-300和g-C3N4的禁带宽度分别为3.05,2.83,2.81,2.79,2.78 eV。可以明显看出,加入g-C3N4后样品的禁带宽度变窄,即可以更多地利用可见光,这对满足光催化技术的实际应用是非常有益的。此外,H-TiO2的禁带宽度为3.05 eV,低于理论的3.2 eV的原因是合成H-TiO2过程中引入了F元素,非金属元素掺杂提高了TiO2的光催化性能。
2.5 光催化性能
图5为300 W氙灯照射下不同样品紫外-可见光谱及对罗丹明B溶液的降解率随时间变化曲线。
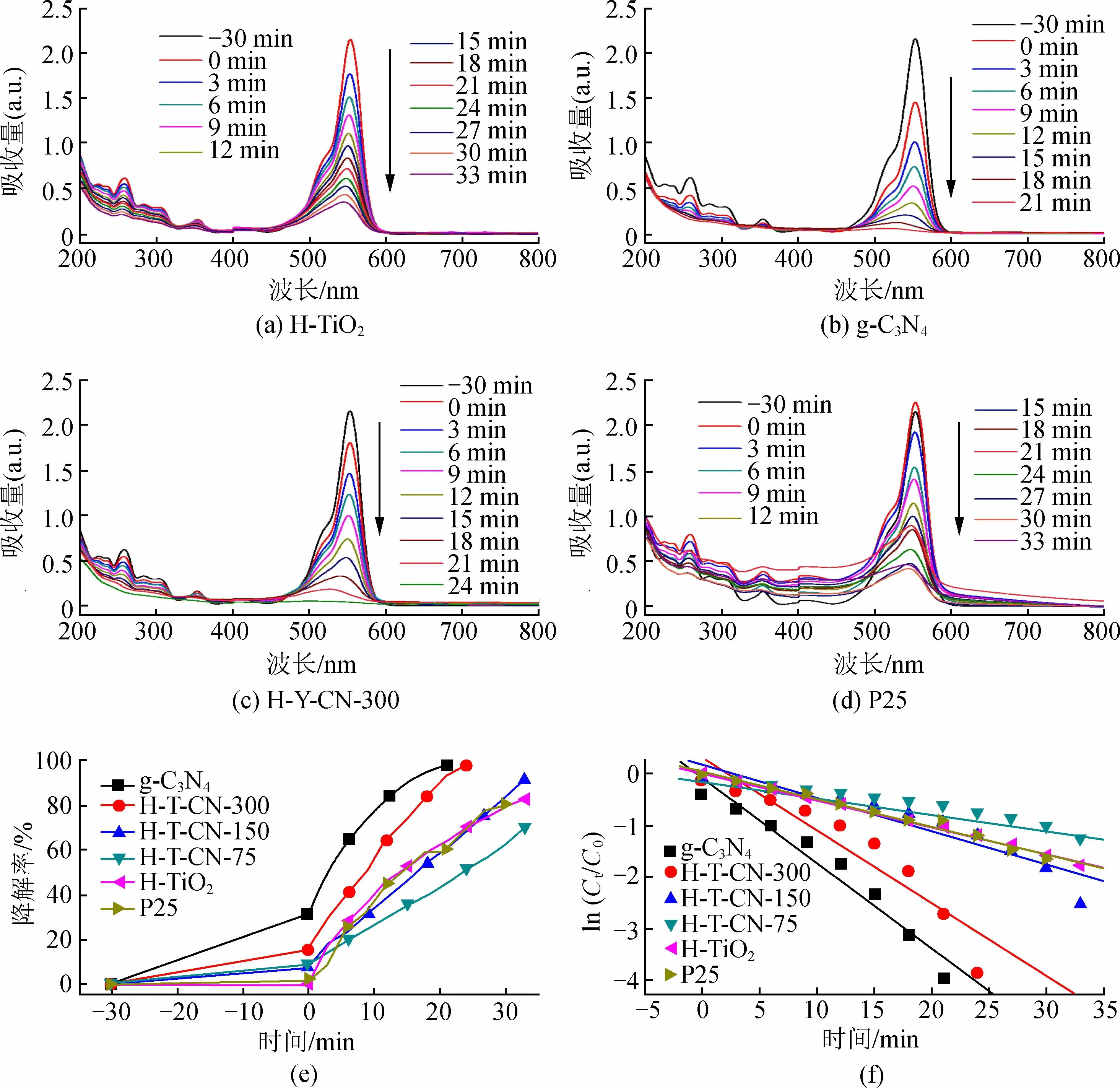
图5 300 W氙灯照射下紫外-可见光谱及不同样品尺寸罗丹明B溶液的降解率随时间变化曲线
从图5可以看出,g-C3N4样品对罗丹明B溶液的暗态吸附作用最强,30 min暗态吸附脱附平衡后,g-C3N4对罗丹明B的吸附量达到最高,为31.8%。而H-TiO2样品对罗丹明B溶液的吸附量仅有0.2%。由于g-C3N4的存在,复合样品对罗丹明B溶液的吸附量也有显著增加,H-T-CN-75样品的吸附量为9.0%,H-T-CN-300的吸附率为15.5%。值得注意的是,暗态吸附为物理作用力,并未对RhB结构造成破坏;光催化降解能够破坏污染物结构,降低污染物毒性,更符合水处理的要求。如图5所示,样品的紫外-可见光谱的峰位置经暗反应吸附后无明显变化;随着光催化反应进行,样品的紫外-可见光图谱的峰向光波长较小位置发生偏移,表明RhB的结构发生变化。300 W氙灯照射条件下,光照21 min时,H-TiO2样品降解率为达到65.1%;g-C3N4降解率达到最高,98.1%。复合样品中H-T-CN-75降解率低于H-TiO2,降解率仅有45.4%;H-T-CN-150的降解率为61.4%;H-T-CN-300样品降解率为93.4%,高于纯组分的TiO2。H-T-CN-75样品的降解率低于H-TiO2的原因可能是由于g-C3N4引入,使TiO2颗粒直径变大,比表面积降低,相对应的反应活性位点数量减少,最终导致样品的光催化活性降低。此外,本实验将水热辅助液相沉积法制备的光催化剂与商业化P25的光催化降解能力进行了对比。吸附脱附平衡时P25的吸附量为2.1%,光照21 min时降解率为60.1%。P25的降解率略低于本实验通过水热辅助液相沉积制备的H-TiO2降解率,且P25样品的降解率与时间线性效果较差。H-T-CN-300样品的光催化性能优于商业化的P25。
考虑到g-C3N4吸附量高,且吸附作用不能破坏污染物结构,实验对比了所有样品的降解速率。0~21 min时,g-C3N4降解率变化量为66.3%;H-TiO2降解率变化量为64.9%;H-T-CN-300样品的降解率变化量最大,达到了77.9%。即只考虑光催化降解条件下,H-T-CN-300样品表现出最优的降解性能,降解能力高于纯组分的H-TiO2和g-C3N4。图5(f)是所有样品的ln(Ct/C0)拟合图谱,根据式(2)拟合计算结果,P25,H-TiO2,H-T-CN-75,H-T-CN-150和H-T-CN-300样品的一级反应速率常数k分别为0.05,0.05,0.03,0.06和0.14 min-1。一级反应速率常数反映出P25与H-TiO2光催化效率相近,g-C3N4的加入量对光催化速率影响巨大,g-C3N4的添加量为300 mg时,H-T-CN-300样品的反应速率可达到H-TiO2样品的2.8倍。
3 结 论
(1)g-C3N4的引入对H-TiO2的物相不产生影响,仍可得到锐钛矿型二氧化钛;g-C3N4的引入影响H-TiO2的微观形貌,使水热辅助液相沉积得到的球状H-TiO2颗粒直径增加,表面粗糙度降低。
(2)g-C3N4的添加量对复合样品的比表面积影响显著。加入少量g-C3N4的复合光催化剂比表面积低于单组分光催化剂的比表面积;随着g-C3N4添加量增加,样品的比表面积也增加;当g-C3N4添加量达到300 mg时,H-T-CN-300样品比表面积高于H-TiO2样品的。
(3)H-TiO2与g-C3N4复合后样品的禁带宽度变窄,使样品可以利用更多的可见光,有效提高了H-TiO2的光催化效果,H-T-CN-300样品的光催化效率达到H-TiO2样品的2.8倍。
