TOPK抑制剂HI-TOPK-032对胰腺神经内分泌肿瘤BON-1细胞体外恶性表型的影响
2021-06-18郭鑫李刚叶辰阿卜杜海拜尔萨杜拉任思谦袁蒙孟猛钱海利原春辉
郭鑫,李刚,叶辰,阿卜杜·海拜尔·萨杜拉,任思谦,袁蒙,孟猛,钱海利,原春辉
(1.北京大学第三医院 普通外科,北京 100191;2.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院 分子肿瘤学国家重点实验室,北京 100027)
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,pNETs)是一类起源于胰腺神经内分泌细胞的罕见肿瘤。随着诊断水平的提高和对该疾病认识的加深,pNETs发病率和检出率正逐年上升。根据临床表现,pNETs可分为功能性和无功能性,pNETs确切的病因和发病机制目前尚不明确。由于pNETs早期无明显症状,大多数患者确诊时已经远处转移,这严重影响患者预后[1]。寻找新的有效治疗方法,对于pNETs的治疗和预后至关重要。
TOPK(T-LAK cell-originated protein kinase),也被称作PBK(PDZ-binding-kinase),是一种丝氨酸/苏氨酸激酶[2-3],TOPK属于MAPK激酶家族成员,与细胞有丝分裂纺锤体的形成相关,TOPK在染色体的正确分离和细胞分裂中发挥重要作用[4]。TOPK主要表达于高增殖水平的组织,在成年人正常组织中,睾丸组织的表达最高[2]。TOPK在结肠癌[5]、食管癌[6]、淋巴瘤[7]、肺癌[8]等多种肿瘤中高表达。研究表明,TOPK可以调控肿瘤细胞周期,影响肿瘤细胞的增殖、凋亡、侵袭和转移[9],并与多种肿瘤的不良预后相关[10]。在胰腺癌中,TOPK高表达与胰腺癌细胞侵袭性密切相关,TOPK通过调节基质金属蛋白酶-2、基质金属蛋白酶-9 和基因启动子活性直接调节胰腺癌细胞的侵袭能力[11]。因此,使用TOPK靶向抑制剂可能成为治疗胰腺肿瘤的一个新方法。HITOPK-032是由Kim等[5]利用体外激酶检测筛选并鉴定出的新型TOPK抑制剂,HI-TOPK-032能强烈抑制TOPK活性,抑制结肠癌异种移植肿瘤模型的生长。基于TOPK在肿瘤发生发展中的重要作用,本研究旨在探讨使用TOPK抑制剂HI-TOPK-032 对胰腺神经内分泌肿瘤BON-1细胞体外表型的影响,期望能以TOPK为突破口为pNETs的治疗寻找新药物。
1 材料和方法
1.1 细胞培养和试剂
胰腺神经内分泌肿瘤BON-1、QGP-1细胞购自于北京北纳生物技术有限公司。HPDE、Mia-2、SW-1990 细胞系均为本实验室自存细胞,细胞培养基为10%胎牛血清的RMPI-1640培养基,培养条件为37 ℃、5% CO2培养箱;6孔板、96孔板、培养皿购自于Corning公司;HI-TOPK-032购自于MCE公司,用DMSO溶解后储存在-80 ℃冰箱冻存备用;TOPK抗体购自于proteintech公司,Tubulin抗体购自于CST公司,PI母液购自于北京普益华科技有限公司,Annexin V试剂购自于赛默飞公司。
1.2 TOPK蛋白表达水平检测
采用Western blotting法。待检测细胞PBS清洗后,加入细胞裂解液在冰上裂解30 min,每10 min振荡一次,将细胞裂解液4 ℃、12 000 r/min离心15 min。测浓度,加入5×缓冲液煮样10 min。计算蛋白上样量后在10% PAGE胶上电泳分离,然后转膜至PVDF膜。转膜完毕后,将膜放置于4 ℃含有50 g/L脱脂奶粉的TBST中封闭1 h,一抗4 ℃过夜孵育。TBST清洗3遍,每次5 min,室温孵育二抗1 h,清洗后化学发光液进行曝光。
1.3 细胞增殖检测
采用CCK-8 法。取生长状态良好的待检测细胞,PBS清洗,胰酶消化,使用完全培养基终止并计数;调整细胞悬液至合适浓度,在96 孔板中每个孔种2×103个细胞,培养基体积定容至100 μL,每种细胞重复3次,置于37 ℃、5% CO2条件下培养,分别培养24、48、72 h后,每孔加入10 μL CCK-8试剂,温箱内孵育2 h;酶标仪测定在450 nm处的吸光度。
1.4 细胞克隆形成检测
平板克隆形成实验法。取生长状态良好的待检测细胞,PBS清洗,胰酶消化,使用完全培养基终止消化后计数;调整细胞悬至合适浓度,每个中皿种2×103个细胞,每种细胞重复3次,充分摇晃均匀后置于37 ℃、5% CO2条件下培养两周左右;每隔4 d更换一次培养基,待每个细胞单克隆长到大于50个细胞时,终止培养;弃去培养基,PBS清洗,甲醇固定,0.5%的结晶紫染色,流水冲洗干净,室温晾干后拍照计数。
1.5 细胞迁移和侵袭检测
Transwell法。迁移实验时,取生长状态良好的待检测细胞,胰酶消化,PBS清洗,使用完全培养基终止消化后计数;用不同浓度HI-TOPK-032的无血清RMPI-1640 培养基调整细胞悬液至合适浓度,取1.5×105个BON-1细胞接种于上室,体积200 μL,下室加入600 μL含20%血清的RMPI-1640 完全培养基和相应浓度药物,待适当数量的细胞穿过小室后,终止实验,甲醇固定,0.5%结晶紫染色,自来水冲洗,擦去未穿过小室的细胞,室温晾干后拍照、计数,每组实验设置3 个重复。侵袭实验,将融化后的Matrigel胶稀释到终浓度为50 mg/L(1:40稀释液);吸取100 μL 1:40稀释后的Matrigel胶溶液加入到Transwell小室,37 ℃、5% CO2培养箱中静置1 h,其他方法同迁移实验。
1.6 细胞周期检测
将适量的BON-1 细胞种于6 孔板中,培养基分别为含0、1、2.5、5 μmol/L HI-TOPK-032的RMPI-1640完全培养基,37 ℃、5% CO2培养箱中培养72 h,胰酶消化,PBS清洗离心,75%乙醇,-20 ℃过夜固定;预先配制PI工作液,1 000 r/min,5 min离心细胞悬液,弃去上清,加入400 μL PI工作液,冰上避光孵育15 min,流式细胞仪检测。
1.7 BON-1细胞凋亡和坏死检测
将BON-1细胞种于6孔板中,培养基分别为含0、1、2.5、5 μmol/L HI-TOPK-032的RMPI-1640完全培养基,37 ℃、5% CO2培养箱中培养72 h;离心收集培养基中的细胞碎片,PBS清洗并离心收集细胞碎片,胰酶消化,PBS清洗,离心;细胞中加入100 μL的1×Binding buffer,加入5 μL的Annexin V和PI工作液室温条件下避光染色15 min;加入400 μL的1×Binding buffer,1 h内进行流式检测。
1.8 统计学分析
使用Image J软件计算Western blotting蛋白条带的灰度值并计算蛋白相对表达量。使用SPSS 22.0进行统计数据,采用ANOVA方差分析比较对照组与实验组间结果差异,组间比较采用LSD-t多重检验,所有数据采用()表示。使用Graphpad Prism软件7.0版制作图片。P<0.05认为差异具有统计学意义。
2 结果
2.1 TOPK在多种胰腺肿瘤中高表达
我们通过Western blotting实验检测正常胰腺导管上皮细胞(HPDE)与胰腺导管腺癌细胞系Mia-2、SW-1990和胰腺神经内分泌肿瘤细胞系BON-1、QGP-1 中TOPK的表达水平。结果显示,与HPDE相比,TOPK蛋白表达水平在胰腺导管腺癌细胞系Mia-2、人胰腺癌细胞系SW-1990细胞系和胰腺神经内分泌肿瘤细胞系BON-1中表达显著上调(TOPK蛋白相对表达量比值分别为1.0:2.6:1.7:2.3:1.0),如图1所示。
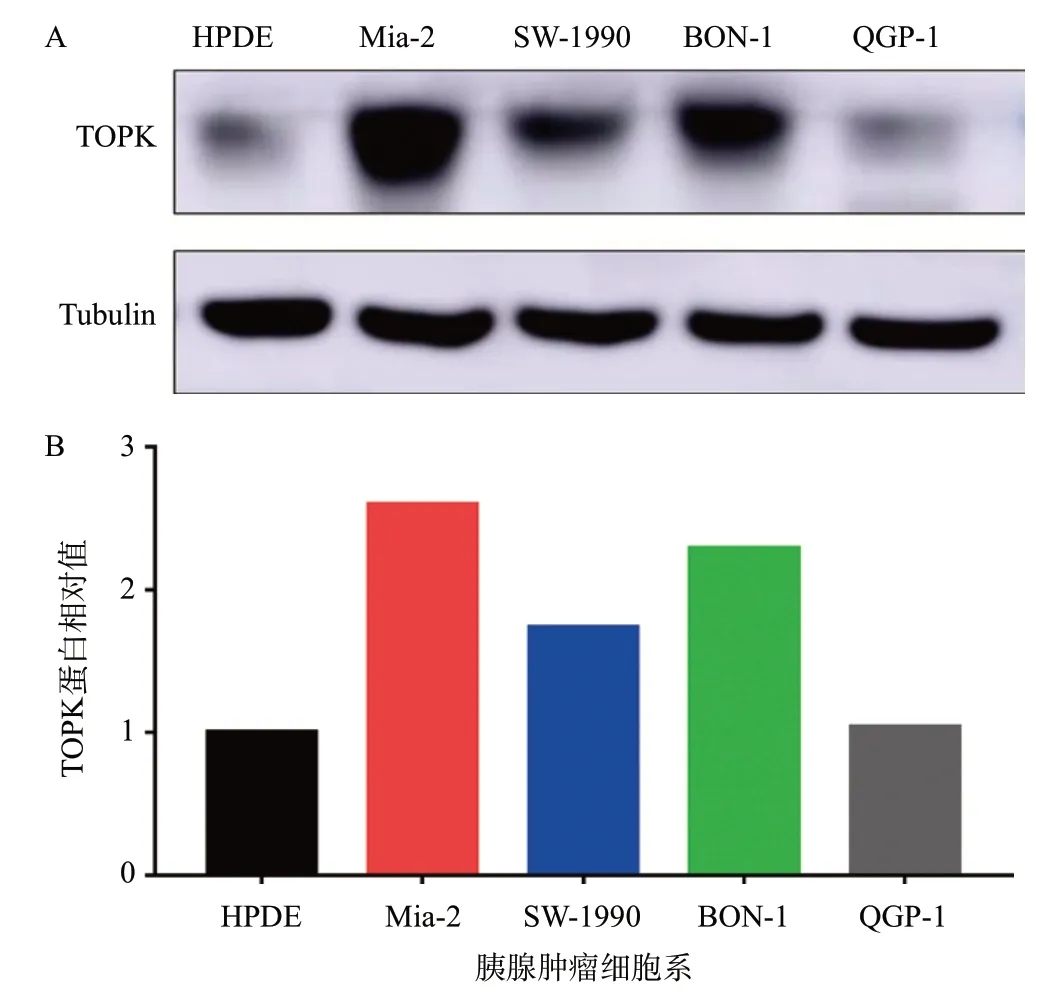
图1 TOPK蛋白在正常胰腺导管上皮细胞(HPED)、胰腺导管腺癌细胞(Mia-2、SW-1990)和胰腺神经内分泌肿瘤细胞(BON-1、QGP-1)中的表达情况
2.2 HI-TOPK-032显著抑制BON-1细胞增殖
我们通过CCK-8 实验检测在含0、1、2.5、5 μmol/L浓度的HI-TOPK-032培养基中BON-1细胞在24、48和72 h生长情况观察细胞的增殖情况。结果显示,与对照组相比,在72 h时,实验组BON-1细胞体外增殖被显著抑制,增殖随浓度增加依次降低(22.2±8.2)%、(90.4±1.0)%、(89.7±0.9)%(P<0.001),如图2A所示。
2.3 HI-TOPK-032显著抑制BON-1细胞克隆形成
分别使用0、1、2.5、5 μmol/L 浓度的HITOPK-032培养基培养BON-1细胞系,计算克隆形成数目,检测其对BON-1细胞克隆形成的作用。结果显示,与对照组相比,HI-TOPK-032处理BON-1细胞后,克隆形成能力被显著抑制,克隆随浓度增加依次减少(19.1±2.1)%、(42.5±5.7)%、(87.0±5.6)%(P<0.001),如图2B、2C所示。

图2 HI-TOPK-032抑制BON-1细胞增殖和克隆形成
2.4 HI-TOPK-032显著抑制BON-1细胞的迁移和侵袭能力
我们通过Transwell实验检测0、1、2.5、5 μmol/L浓度的HI-TOPK-032培养基对BON-1细胞的迁移和侵袭能力抑制效果。结果表明,HI-TOPK-032可有效地抑制BON-1细胞的体外迁移、侵袭能力,与对照组相比,BON-1细胞迁移能力随浓度增加依次减弱(9.3±5.6)%、(70.5±4.0)%、(87.5± 3.5)%(P<0.01),侵袭能力随浓度增加依次减弱(23.0±4.2)%、(60.7±5.4)%、(93.6±3.0)%(P<0.01),如图3所示。

图3 HI-TOPK-032显著抑制BON-1细胞迁移和侵袭形成
2.5 HI-TOPK-032影响BON-1细胞的细胞周期
分别使用0、1、2.5、5 μmol/L 浓度的HITOPK-032培养基培养BON-1细胞系72 h,使用流式检测细胞周期,结果显示,与对照组相比,使用2.5、5 μmol/L浓度HI-TOPK-032后,G0/G1期的细胞比例依次增加(12.2±2.0)%、(18.3±1.4)%(P<0.001),在5 μmol/L浓度时,S期的细胞比例减少(18.4±6.1)%(P<0.01),在2.5、5 μmol/L浓度时,G2/M期的细胞比例依次减少(17.6±8.6)%、(16.4±4.5)%(P<0.001),这提示2.5 μmol/L浓度以上时,HI-TOPK-032可以调控BON-1细胞周期进程,如图4所示。

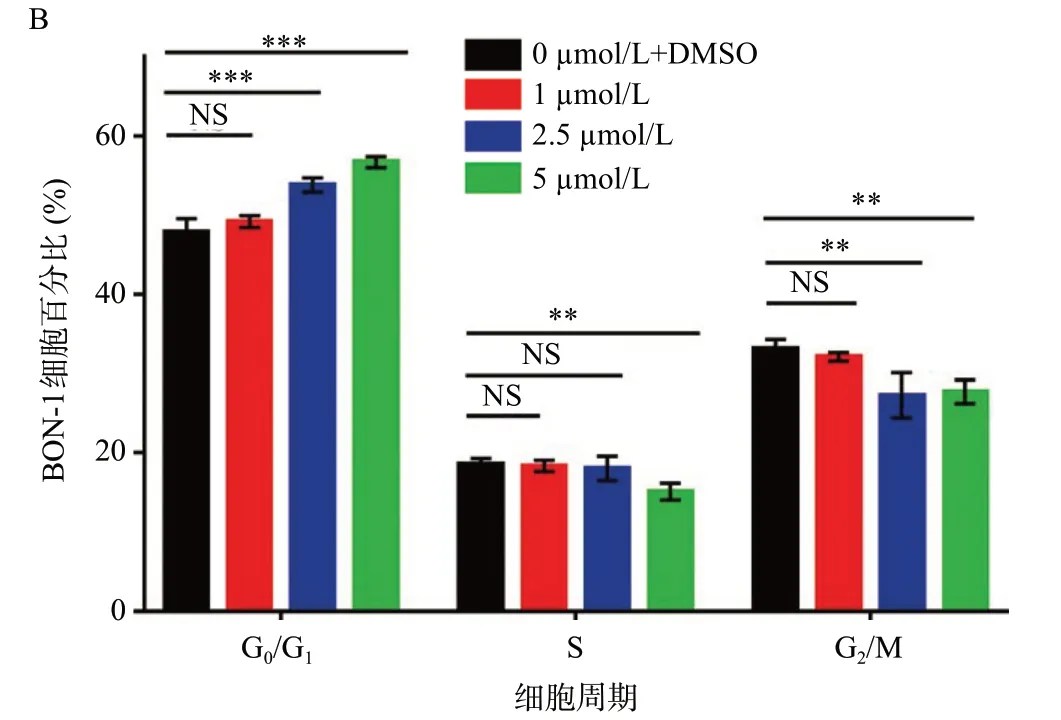
图4 HI-TOPK-032调控BON-1细胞周期
2.6 HI-TOPK-032显著促进BON-1细胞坏死和凋亡
分别使用0、1、2.5、5 μmol/L 浓度的HITOPK-032 培养基培养BON-1 细胞系72 h,使用Annexin V染色,流式检测凋亡。结果显示,HITOPK-032 显著促进BON-1 细胞坏死和凋亡,凋亡随浓度增加依次增加(60.6±30.9)%(P<0.05)、(79.5±27.5)%(P<0.01)、(165.8±34.9)%(P<0.001),5 μmol/L浓度时,坏死显著增加,增加(385.8±67.3)%(P<0.001),如图5所示。
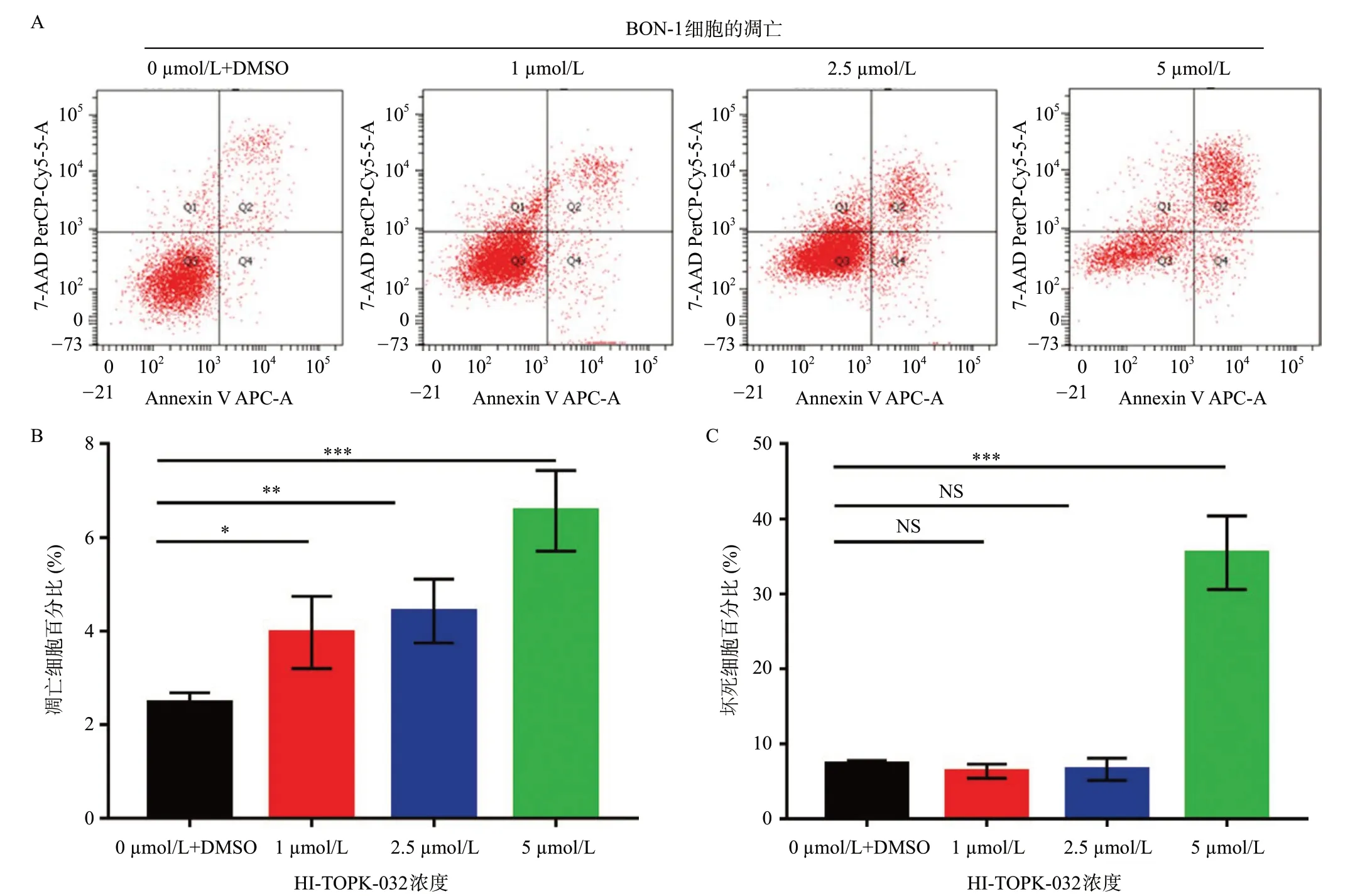
图5 HI-TOPK-032促进BON-1细胞凋亡和坏死
3 讨论
TOPK通过持续维持致癌底物的磷酸化,使癌细胞克服细胞死亡信号通路,绕过调控检查点控制,从而促进肿瘤的生长和进展,抑制TOPK是克服肿瘤侵袭性、转移性生长和治疗耐药性的一种重要的治疗策略[9,12]。
HI-TOPK-032作为一种TOPK特异性抑制剂,在多种肿瘤中显示出良好的抑制肿瘤的效果[13-19]。HITOPK-032 通过抑制ERK磷酸化从而抑制结肠癌肿瘤细胞增殖[5],通过抑制c-Jun磷酸化从而抑制皮肤癌细胞增殖和克隆形成[12],可以抑制鼻咽癌、胶质瘤异种移植瘤的生长[14-15]。HI-TOPK-032 可以阻滞淋巴瘤细胞周期,诱导肿瘤细胞发生凋亡[16]。
在本研究中,使用不同浓度的HI-TOPK-032均可以抑制胰腺神经内分泌肿瘤BON-1细胞的体外增殖和克隆形成,且抑制效果呈剂量依赖式。TOPK在有丝分裂过程中起到重要作用,TOPK能强烈促进了细胞分裂[4,17]。本研究中,使用HI-TOPK-032可以特异性抑制BON-1 细胞中TOPK活性,从而抑制BON-1细胞分裂,使BON-1细胞的增殖和克隆形成能力减弱。本研究结果表明,使用HI-TOPK-032可以显著抑制BON-1细胞的迁移和侵袭能力,这提示HI-TOPK-032具有防止肿瘤转移的潜力。肿瘤细胞最显著的特征之一是细胞周期异常,探索调控肿瘤细胞周期的方法成为肿瘤治疗的重要方法[18]。本研究核心之处是通过流式检测了使用不同浓度HITOPK-032 对BON-1 细胞周期和凋亡坏死的影响,结果表明,在HI-TOPK-032浓度大于2.5 μmol/L后,G0/G1期的细胞比例增加,S期和G2/M期细胞比例减少,证明了较高浓度的HI-TOPK-032能够提供调控BON-1细胞周期,将BON-1细胞的分裂阻滞在G0/G1期。同时,使用HI-TOPK-032 抑制TOPK活性导致BON-1细胞凋亡和坏死显著增加,在5 μmol/L浓度时,促进BON-1细胞凋亡和坏死的效果均最显著。
HI-TOPK-032在多种肿瘤中以剂量依赖的方式抑制肿瘤的增殖和活力[5,19]。在本研究表明,HITOPK-032 浓度在1~5 μmol/L时,在胰腺神经内分泌肿瘤BON-1 细胞增殖、克隆形成、迁移和侵袭等体外恶性表型被显著抑制。较高浓度的HITOPK-032可以调控细胞周期,促进凋亡和坏死。
本研究首次表明,HI-TOPK-032能调控胰腺神经内分泌肿瘤BON-1 细胞周期,促进肿瘤凋亡坏死,显著抑制BON-1细胞体外恶性表型,证明了HITOPK-032 作为TOPK靶向抑制剂在胰腺神经内分泌肿瘤中的应用价值,同时也为胰腺神经内分泌肿瘤动物体内移植瘤模型的药理实验研究提供重要依据。
本研究不足之处,一是未阐明HI-TOPK-032在BON-1细胞中发挥抑制恶性表型作用的分子生物学机制;二是未开展动物体内实验验证其抑制效果和量效关系。
4 结论
本研究表明,在体外试验中,HI-TOPK-032 显著抑制胰腺神经内分泌肿瘤BON-1 细胞系的恶性表型的效果,有效抑制了BON-1 细胞的增殖、克隆形成、侵袭和迁移,调控BON-1 细胞周期,促进BON-1细胞的凋亡和坏死。目前针对HI-TOPK-032的药物策略的开发仍处于临床前阶段。预期在未来,在pNETs患者中,经免疫组化检查,对TOPK阳性表达的患者使用TOPK抑制剂可能有效抑制肿瘤的生长,提高患者生存率,改善不良预后。
