机器人辅助手部运动神经康复系统的进展与趋势研究
2021-06-17程绮颖王友好罗静静王洪波
程绮颖,王友好,杜 强,李 阳,罗静静,2,3,王洪波,2,3
(1.复旦大学 工程与应用技术研究院 智能机器人研究院,上海 200043;2.复旦大学 智能机器人教育部工程研究中心, 上海 200433;3.复旦大学 上海智能机器人工程技术研究中心, 上海 200433;4.北京航空航天大学 自动化科学与电气工程学院,大数据精准医疗高精尖创新中心,大数据脑机智能高精尖创新中心,北京 100191)
0 引言
我国是脑卒中高发地区,该疾病是我国居民的第三位死亡原因[1]。近年来,患者数量因人口老龄化加剧而逐年上升,且发病人群呈现年轻化趋势[2]。作为一种急性脑血管疾病,脑卒中引起脑组织损伤,具有极高的致死致残率,由脑卒中引起的偏瘫患者占人口总数的3‰~5‰[3]。研究表明,卒中后上肢功能愈后效果较差[4],约70%的患者会遗留偏瘫、痉挛等上肢功能障碍,尤其是远端精细功能。
脑卒中神经损伤导致的手部功能障碍问题亟待解决。手指伸展是最可能受损的运动功能[5],然而患者往往只注意训练步态和移动,欠缺针对手部运动功能恢复的训练,导致手部运动技能的恢复水平通常较低[6]。在长时间未激发情况下,手部肌肉及神经慢慢退化,且神经损伤时间越久,运动功能恢复越困难。手部功能直接影响患者的独立生活能力,且对于增强自尊更重要[7-8],手部功能的长期缺失将给家庭、社会带来沉重的精神和经济负担。减轻卒中后神经损伤导致的手功能残疾,已成为全球性公共卫生问题[9]。
运动神经功能可通过大脑重组或补偿实现神经修复[10]。这种大脑可塑性是神经康复的基础[11]。运动功能的恢复训练关键在于尽可能地提高强度,并基于特定任务重复训练[12]。脑机接口(Brain-Computer-Interface, BCI)技术利用智能算法和脑信号采集装置可实时检测人脑主动活动的电信号,利用反馈对人体相应部位产生刺激或引导活动,人工建立起神经-肌肉的运动通路,刺激原神经回路的重建,被广泛研究应用于脑卒中的治疗。这种融合脑机接口的运动神经康复方式简称为BCI康复。然而,大多数针对卒中后手部运动功能恢复的BCI系统训练对大脑功能的干预效用不稳定,处于临床转化与应用研究的关键阶段[13]。
从BCI系统的神经康复机制出发,研究手部运动神经反馈的训练模式,对提高恢复程度、实现精准康复具有十分重要的理论意义和应用价值。本文针对机器人辅助手部运动神经康复系统进行深入的调研,通过分析运动中枢神经活动的不同诱发范式、基于机械外骨骼的运动反馈方式、神经解码方式以及康复训练的功能评价方式,探究融合手康复机器人的神经反馈训练系统的研究现状以及存在的问题,发掘可能的解决途径。
1 运动神经反馈系统概述
基于BCI的运动神经反馈系统一般由信号采集与处理模块、控制系统、反馈环节[14]以及康复评估组成(图1)。信号处理模块是对解码神经信号的分类器进行训练,使用机器学习和深度学习等人工智能算法能够让BCI系统更准确地辨识大脑活动。信号处理模块将辨别出的大脑活动模式以指令的形式发送给控制系统,后者通过控制算法调控机械反馈机构进行患侧手的康复运动训练。反馈环节是BCI系统识别到患者意图后的执行对象,系统可以通过视觉、听觉、触觉和体感等方式结合显示屏、扬声器、电极或机器人机构等设备提供反馈。如此,BCI便将神经活动干预改变外围行为的由上至下的方法与作用外围身体神经诱发神经水平变化的从底向上的方法相结合,实现了神经-肌肉回路的闭环训练[15]。当前,对康复评估可以从临床功能评估、运动参数和脑功能评估等方面考察,并以临床提升为主要目的,通过数据或图像计算的大脑功能性变化辅助分析。
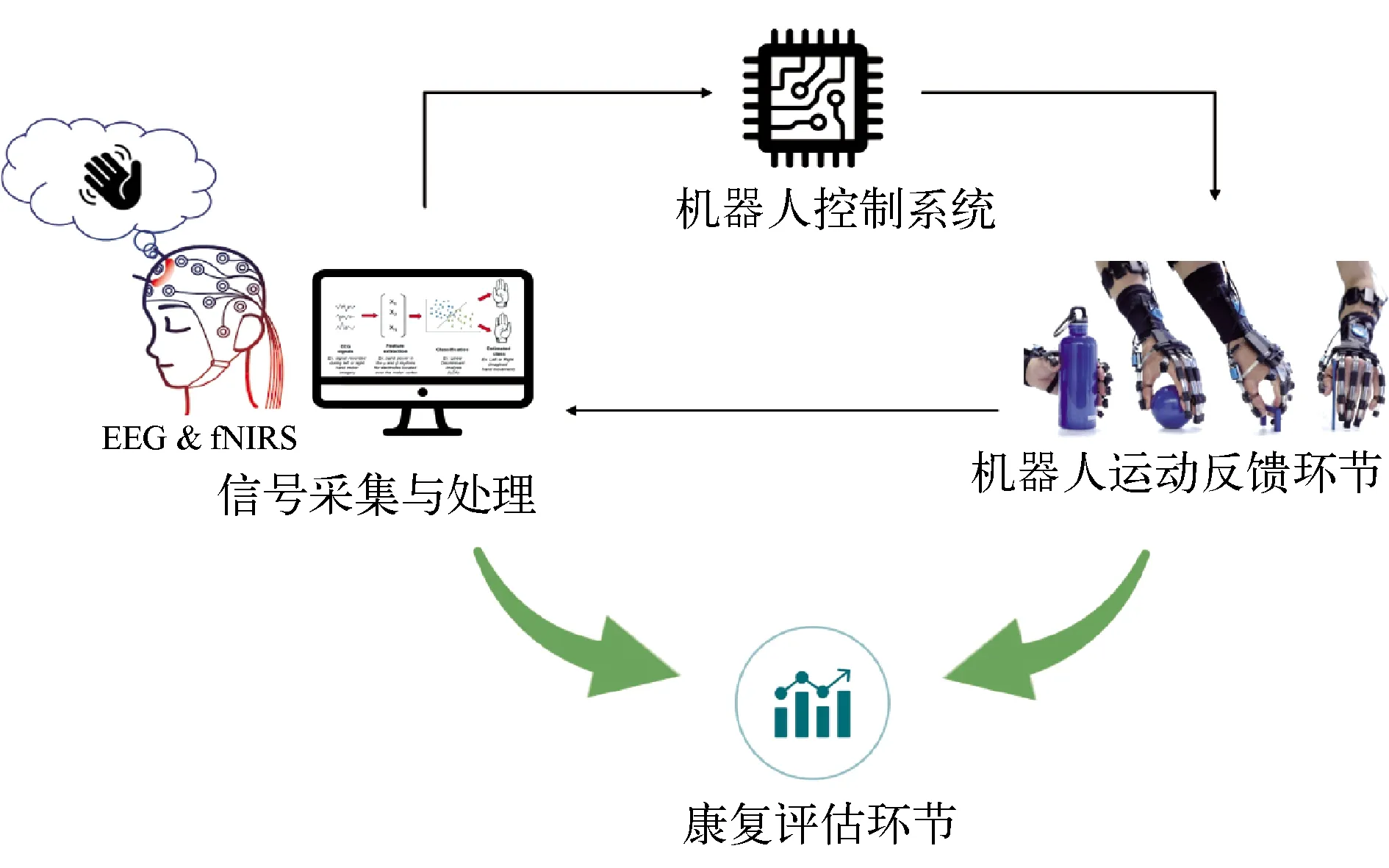
图1 基于BCI的运动神经康复系统组成
神经可塑性是运动神经康复的基础。神经可塑性是指神经系统可以在损伤后从功能和结构上进行自我调节[16]。稳态可塑性机制可确保神经元收到足量的突触输入,Hebbian可塑性机制可重新分配突触强度,以促进同时活跃的通路的连接,两种可塑性机制可同时作用促进大脑功能重塑[17]。无论对于健康人还是患者,不仅大脑连接可以重组,还能够通过训练调节大脑活动[18]。此外,有反馈的任务训练可以促进大脑皮层的可塑性[19]。
脑损伤康复过程中神经可塑性会改变脑皮层功能活动。研究发现,在一个基于反馈的虚拟环境中进行上肢训练,相比于训练前的双边SM1、病灶对侧PMC区域和双侧的SMA区域的激活情况,有更多病灶同侧SM1区域被激活。Bajaj等[20]提出PMC/SMA/M1区域间因果依赖,计算出的有向效应链接(EC)模式显著增强。运动神经康复呈现患侧感觉运动皮层、皮质脊髓投射等不同层级多区域的神经激活增强,以及患侧区域间、双侧脑功能活动功能连接和左右制衡恢复[21-22]。
成功的康复训练有以下几种关键特点:多次重复、高强度、调动多感官、多类别反馈[23],这样能增强患者的主动参与度,同时激发他们的能动力。手功能康复机器人的运动神经反馈训练作为一种神经调控技术,可以帮助患者进行主动性、高强度、针对性和互动性的康复训练,促进大脑受损功能区域重建,使患者的手部运动功能得到科学有效的恢复。本文第二节将重点针对手部运动功能神经康复的关键环节,包括诱发范式、运动反馈方式、神经解码方式、手部康复训练的功能评价方式等,分别介绍与分析对应的研究现状。
2 各关键环节的研究现状
2.1 手部运动神经活动诱发范式
运动想象(motor imagery, MI)任务是持续、稳定且可控制的心理活动之一,也是使用最广泛的运动康复训练诱发范式。MI属于内源性EEG信号,即系统须采集在没有外界刺激下,受试者本身的心理活动,或者说脑部活动。定量计算表明,运动想象与运动执行(motor execution, ME)任务在人脑可以激活相同的一块脑区网络,包括辅助运动区(SMA)、对侧中央后回、对侧顶上小叶和同侧前额叶皮层等区域[24]。MI技术主要通过人在进行运动想象时,大脑的运动感觉区(Sensorimotor Cortex, SM)特定频带会出现相应的反应,也就是所谓的运动感觉节律(Sensorimotor Rhythms, SMR)来提取脑活动特征。比较明显的是μ(8~12 Hz)节律和β(12~30 Hz)节律在运动想象进行时会产生明显的衰减,而这种根据想象任务出现前后的信号频带活动增强和衰减的现象分别称为事件相关同步(Event-Related Synchronization, ERS)和事件相关去同步(Event-Related Desynchronization, ERD)。这种特征使得MI-EEG信号具有较高的区分度。然而,MI-EEG信号也存在一些缺点:有实验证明,稍长时间的运动想象任务会逐渐使人疲劳,从而降低分类精度[25];且纯粹的运动想象(不看运动视频,完全依靠想象)能力在不同个体间存在着天生的差异性,完成康复训练的难易有别。而大部分脑卒中患者是认知能力衰退的年老者,这种认知问题将会很大程度上限制他们的康复疗效[26]。
运动意图(Motor Attempt, MA)是患者在想要运动患侧手却无法实现时的大脑活动,可以诱发大脑产生与MI和ME相同的ERD/ERS现象。患者进行MA任务时不涉及故意抑制肢体活动的努力,不容易产生疲劳,研究表明,这样的心理活动任务相比于MI信息量更大[27]。神经成像研究表明,运动意图的皮层活动紧密跟随着脊髓受损后运动执行时的躯体特定区域组构[28]。MA可以诱发Hebbian神经可塑性机制,即突触前神经元向突触后神经元的持续重复的刺激,可以导致突触传递性能的增加。虽然卒中患者失去了主动运动能力,但是保留了运动规划的能力[30]。基于MA的BCI系统可促进患者的运动准备、执行和外围肌肉效应的正常时序恢复[31]。
动作观察(Action Observation, AO)起源于非人类灵长动物的“镜像神经元”相关实验[32],在这些实验中,人们发现执行动作所激活的脑区与观察动作所激活的脑区相同[33]。可以使用动作观察作为MI的替代方案。日本大阪的村田医院与明治大学合作[34],通过实验证明,AO可以促进偏瘫卒中患者的运动皮层活动,从而提高康复设备的分类精度。Robert M.Hardwick等[35]从运动科学的角度对运动想象、动作观察和运动执行三者的激活脑区进行了对比分析,发现三种任务在双侧运动前区、顶叶和运动感觉区组成的脑网络重叠,证明了MI与AO用于神经康复的可行性。而且,将MI与AO结合,可以弥补互相的缺陷,在激活更多脑区的同时,提高分类精度(表1)。

表1 三种手部运动神经活动诱发方式比较
运动想象是使用最广泛的诱发范式,但是患者训练的体验不佳且会受到个人能力的影响。运动意图则是运动前自发产生的大脑活动,动作观察能引起与运动执行相似脑区活动,这两者都可以规避运动想象的缺点,是目前研究的新趋势。目前大多数BCI运动神经反馈训练系统的解码系统对不同侧手运动和同侧手运动进行二分类,在这种训练范式下,大脑不同类别的激活模式差别明显,识别任务简单。而同侧手的不同活动,比如手掌的握拳、伸展,腕关节的背伸、掌曲,桡尺关节的桡偏、尺偏,以及拇指与其他手指的对指运动等精细手指活动的生物神经信号在现有的人工智能算法中较难区分。本文认为,研究MI与AO或MA与AO的结合有助于增强大脑活动特征,不仅可以提高解码准确度,还能够改善患者的训练体验,提高参与度,进而有望改善康复效果。
2.2 手部康复机器人的运动反馈方式
机器人矫正器是BCI上肢康复系统中使用最多的反馈设备[29],它对身体损伤小且康复疗效较好。机器人辅助治疗是一种基于神经生理学学习机制来促进神经可塑性的方法,它能够为特定功能提供高强度的重复练习,且低成本不费力,因此可以用来辅助康复治疗师进行持续重复的训练。分析表明,精心设计的机器人辅助治疗可以产生比传统康复技术等同或者稍好的疗效[46],但单一的机器人辅助治疗优势不明显。与BCI结合的机器人反馈机构可以检测患者移动手指的意图,同时辅助增强他们的肌力[47],带动手指完成相应的动作。这种方法可以通过调节操作条件来规范有利于运动的脑部状态,或者通过将与运动相关的脑部状态与时间相关的感官反馈相结合来增强运动恢复[48]。
高自由度的外骨骼机器人模拟人体手部的解剖学结构,可以牵引患侧手完成精细的上肢远端运动任务。Norman等[49]使用FINGER外骨骼机械手牵引患者的患侧手进行食指和中指的协同伸展动作训练,对8名患者进行了4周的干预训练。FINGER沿着自然的抓握/释放轨迹辅助食指和中指的屈伸,它还记录了食指和中指的近端和中指骨的位置、加速度和力,以便计算掌指(MCP)关节的扭矩,直到患者达到约0.034Nm的扭矩才启动辅助模式。FINGER帮助参与者完成自己可能无法独立完成的手指伸展运动。该实验设计了三个阶段训练患者调节自己的感觉运动节律(Sensorimotor Rhythm,SMR),结果表明,至少两名受试者可能获得了专注于在侧向或中央感觉运动皮层区域SMR频段的控制能力。Carino-Escobar等[50]对9位患有缺血性并处于亚急性阶段的卒中病人同样进行了长达4周的基于机器人外骨骼的BCI康复干预试验,大部分患者在干预训练后,临床指标得到了显著提升。
通过传感器测量运动学和动力学参数,机器人设备设定阈值开启辅助模式帮助患者使用患侧手完成自身不能完成的动作进行训练。力敏电阻(force-sensitive resistor,FSR)是常用的手部矫正器传感器之一,通常将其放置在机械手的指尖来感受手指微小的移动,这种移动数据被用来控制外骨骼动作的伸展和弯曲。Chowdhury等[51]为了激发患者使用残余肌力,将外骨骼设置为需要时辅助的模式。通过附在手指间和机构手指帽之间的FSR获取力的大小,并将其转化为外骨骼的移动。他们使用PP(物理训练)加MP(心理训练),机器手外骨骼与视觉反馈相结合的康复方式对4名患者进行了持续6周的干预实验。实验中,研究者将单个手指伸展动作分解为8个步骤量化患者训练的过程(图2)。实验结果显示,随着训练次数的增加,除了患者的临床指标的改善,BCI系统的性能也得到提升,ERD/ERS特征变化显著。
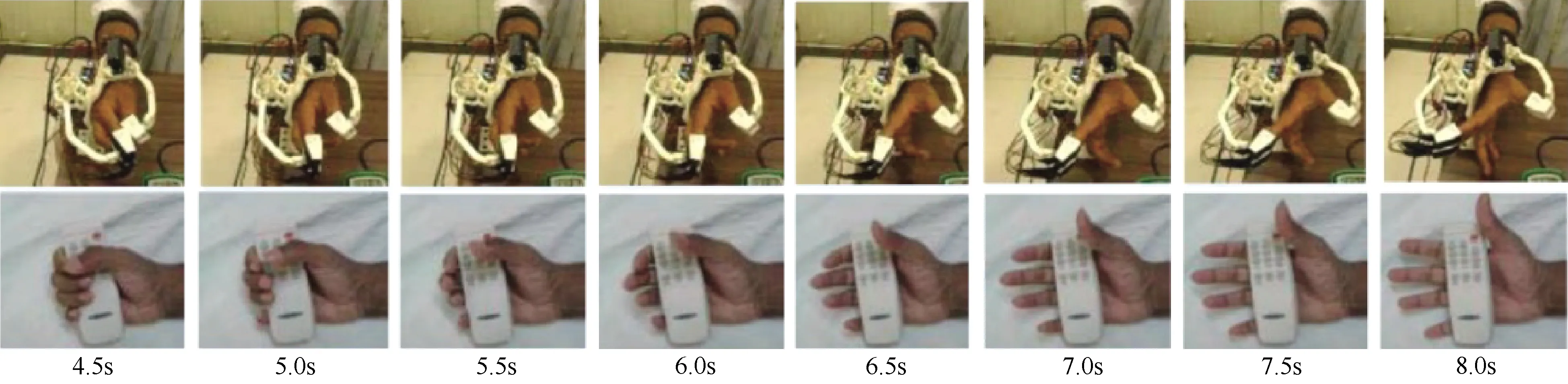
图2 外骨骼机器手引导的分解手指抓握动作
机器人设备记录高分辨率的运动学和动力学参数,可以作为康复训练效果的量化参考。Krebs等[52]使用临床量表和机器人设备在卒中发生后7天、14天、21天、30天和90天测量了208位中度至重度急性缺血性卒中患者的手臂运动。将机器人测量的速度、位置和力量与临床评估进行比较。结果表明,机器人测量可以很好地预测临床测量。如果适当地缩放并通过人工神经网络进行组合,机器人测量值可以在衡量从第7天到第90天的患者恢复情况方面显示出更高的敏感性。Silvoni等[53]使用6个自由度的PHANTOM Premium机器人对一位中度偏瘫卒中患者进行2周的BMI上肢训练,观察到手臂在运动学上(包括平均速度、峰值速度等)的显著改善与体感节律变化的增加和集中化。
患者进行运动训练时会产生上行神经信号,驱动运动再学习,使得大脑神经元间产生新的连接和重组,恢复大脑的运动控制能力[54]。手部康复机器人可以模拟自然肢体动作,完成高强度可重复的训练,改善动作的协调性。此外,机器人传感器参数不仅可以设定辅助模式的阈值,其变化还可以作为训练的量化指标提供康复评估参考。机器人设计应该符合人体工程学,并在运动控制上保证患者使用的安全性,提高机器人关节和手指间联动的柔顺控制。
2.3 神经解码方式
常用于手部运动神经训练的范式有感觉运动节律(Sensorimotor Rhythms, SMR)和事件诱发P300电位等。SMR是运动想象中使用最广泛的范式之一。患者可以通过想象患侧手运动调节大脑活动,具体来说,就是当患者进行MI或MA任务时,在他/她的感觉运动皮层会产生ERD/ERS调制。识别SMR在μ和β频带能量的变化可以操纵机器人外骨骼引导患者进行患侧手的运动训练,实现有效的反馈。Norman等[49]使用FINGER机器人外骨骼辅助卒中患者进行手指伸展训练,并在多模态反馈下练习对大脑运动感觉节律(SMR)的调控。P300表现为在事件发生后220~500 ms,EEG信号出现大小为5~10 μV的一个正峰值。视觉P300电位是研究最多的事件诱发电位之一,它由不经常出现的事件诱发。大多数受试者可高效地使用视觉P300,并在几分钟内完成校准。
传统的机器学习算法在提取信号特征后进行模式分类,EEG信号常使用时频域和空域类的特征提取方法。时频分析可以提取时频域上能量的变化特征,适用于SMR范式。典型的时频算法有短时傅里叶变换(Short-time Fourier Transform, STFT)、小波变换(Wavelet Transform, WT)和离散小波变换(Discrete Wavelet Transform, DWT)等。尤其是后两种方法可以多分辨率和多尺度地分解EEG信号。通常使用空域的独立成分分析(Independent Component Analysis,ICA)和主成分分析(Principal Component Analysis,PCA)提取P300信号的特征。广泛使用的分类方法包括支持向量机(Support Vector Machines, SVMs)和线性判别分析(Linear Discriminative Analysis, LDA)。已有的很多实验表明,同等条件下,高斯核SVM的分类性能优于其他分类器例如LDA、K近邻(k-NN)、朴素贝叶斯(naïve Bayes)和自回归树(Regression Tree, RT)等。过拟合问题使用Regularization LDA或通过调整SVM的训练方案来解决。
随着数据量的增加和计算能力的提高,深度学习技术受到越来越多的关注,在EEG领域出色的深度网络性能比机器学习算法更稳健[55]。搭建深度学习架构解码EEG信号有两个主要内容:输入网络的数据形式和网络结构的设计。研究表明,相比于计算得到的特征(如CSP)和计算组成图像形式(如连续小波视频图),直接输入原始数据的网络性能较优[56];另一个问题是网络结构的设计,超过70%的研究使用卷积神经网络(Convolutional Neural Network,CNN)[57-60],其他也有循环神经网络(Recurrent Neural Network,RNN)[61-62]和混合神经网络(h-CNN)[63-64]的,少部分使用堆叠自编码器(SAE)[65]等构造,对比表明基于CNN和h-CNN的深度学习网络效果较好。Zhang等[63]根据电极分布系统在二维平面的投影将时间窗内每个采样时刻的信号排布为图片形式,输入一个三层CNN与LSTM级联或并联组成的混合卷积神经网络,保留了信号的时空信息,在PyhsioNet数据集的108个健康人多类MI分类中准确率达到98%以上,相对于传统机器学习和简单网络,解码性能提升了10%~30%。然而,使用深度网络需要大量的训练数据,需要调节的参数较多,网络结构设计也比较复杂。因此,很多学者专注研究轻量型网络结构来解决EEG解码问题。Lawhern等[66]设计的一种针对EEG信号的紧凑小巧型卷积神经网络构架EEGNet,先后使用时间卷积和深度卷积操作,使用更少的网络参数提取时空特征,对P300、ERN、MRCP和SMR四种范式上的通用解码性能具有优势。
脑功能网络(Functional Brain Network,FBN)是不同神经元、神经元簇或大脑皮层区域之间动态神经活动相互作用的直观表达[67]。它可以表征大脑网络的拓扑结构和动态特性。基于不同大脑活动的脑功能网络连接不同,我们可以通过计算患者在不同训练任务下的FBN来识别相应的大脑状态。FBN在情绪和认知状态识别中使用较多[68-69],也逐渐应用于卒中上肢康复状态解码的研究中[70]。一般将EEG传感器电极点作为脑网络图的结点,电极之间的关系作为边。统计学方法以及定向传递函数(DTF)和部分定向相干性(PDC)等其他方法被广泛用来计算EEG图中的边值。例如连贯性(Coh),皮尔逊相关系数(PCC),相位锁定值(PLV)和相位滞后指数(PLI)等。脑功能网络用传统机器学习算法解码时,可以使用特征选择算法,例如顺序前向选择(SFS)降低特征冗余;而针对脑网络图的数据结构特征,可以使用图卷积进行网络学习。Ghazani等[71]提出一种自适应时空图卷积网络(ASTGCN),同时从时间和通道间的空间关系探索MI-EEG信号的特征,在25名受试数据上显示出比CNN-SAE、EEGNet、STGCN更高效稳定的性能。
当前BCI解码系统实时分类性能仍有待提高。机器学习算法模型训练时间短,但特征的选取对分类准确度影响大,并且其采用的实时窗口数据只能体现短时大脑活动。使用机器学习算法,需处理原始信号的噪声(如眼动和肌电等),提取高维生物信号的特征难度大,分类器精度提升有限。深度学习算法可利用端到端优势避免特征选择,但模型训练时间长且需要大量的训练数据集增加泛化能力,正式反馈训练前需要较长时间采集数据并训练模型。脑功能网络的方法基于大脑功能重组机制,可以提取神经生物学特征,结合深度学习算法,有望提高实时解码性能(图3)。
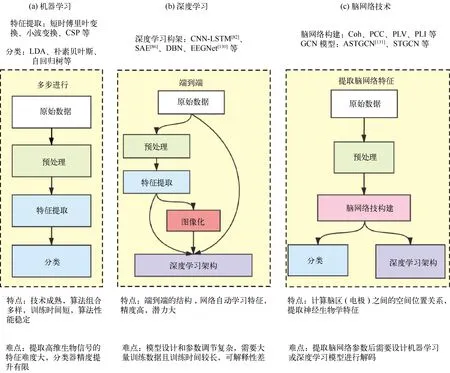
图3 解码技术的比较
2.4 手部康复训练的功能评价方式
融合脑机接口的手部康复机器人关注卒中患者的手部运动功能康复治疗,因此对该BCI系统最直接的评价方式就是使用临床功能评估方式。常用于手部康复治疗评估的主要疗效评测方法有:Fugl-Meyer Assessment of Upper Extremity(FMA-UE)、National Institutes of Health Stroke Scale(NIHSS)、Action Research Arm Test(ARAT)和Grip Strength(GS)等。除了主要临床评测方法外,一般还使用视觉模拟量表(Visual Analog Scale,VAS)[51]对患者的疲劳、情绪和主动性进行评估;mAsh量表用于评估手指、腕部和肘部屈肌以及肩外展肌的痉挛程度;RoM评估肩膀外展和肘部、腕部和手指屈伸的活动范围[72];SIS广泛用于衡量卒中患者愈后的生活质量[73];9HPT是对上肢功能简单、标准化的定量测试[74]。但是,很难通过大多数身体机能评估迅速检测出BCI康复的潜在大脑修复能力,不能足够精细地量化任务改善的具体程度,这样便容易忽视运动恢复的质量。
运动学参数评估使用机器人设备中的传感器记录运动训练时的运动学参数来描述运动恢复情况[75]。Do等[76]总结了应用于13种机器人设备上的超过40种运动学参数,可以从不同角度评估卒中后的运动能力。选取最合适的运动学参数可以节省评估的时间和复杂度,选取最优的参数需要考虑训练使用的机器人设备和训练范式。Koeppel等[75]对InMotion ArmTM的时间、平滑性、距离和准确率这4个维度的9种运动参数进行反复测试评估其可靠性,包括运动时间T、平均速率mV、最大速率MV、平滑误差SE、速率峰值数nP、平均停滞期比率(MAPR)、归一化路径长度(NPL)、直线的均方根误差(RMS)和最后运动点的正交投影(LP)。结果表明,除了RMS、nP和MARP对于变化不敏感外,其他6个运动学参数都有较好的可靠性,可用于临床训练作为便捷客观的运动恢复程度的评价参考。
功能性连接(Functional Connectivity, FC)可以作为更好地了解康复范式效果的标志,对于神经调控水平,应该注重病灶侧和对侧脑结构、功能的评估[21]。FC的临床和治疗意义有两点[77]:首先,静止状态活动的功能性连接测量可以预测卒中后的行为缺陷;其次,静止状态功能性连接的变化可用于纵向跟踪行为的恢复。功能磁共振的数据可计算大脑偏侧化指数,从而用于评估双侧半球间功能活动的差异性;磁共振弥散张量成像(Diffusion Tensor Imaging, DTI)可通过评估脑蛋白质纤维束的损伤情况反应运动功能恢复程度;经颅磁刺激(Transcranial Magnetic Stimulation, TMS)可直接评定双侧半球间的功能抑制,提供手功能代表区兴奋性和面积等信息。Royter等[78]借助TMS的面积分析比较训练前后皮质脊髓束的兴奋性变化来评估训练效果。
临床评估指标是康复训练效果的最终标准,但是其评估需要基于长期缓慢变化的临床表现,且主观性强;运动学参数和功能性评估虽然不能直接反映临床改善效果,却能快速地、量化地辅助单次训练参考。本研究能够在每次训练后及时反映训练效果的评估方法,有助于康复机制的发现,并使得受试者得到快速反馈,保证康复训练的效果。短时评价机制及时返回受试者康复训练效果的评估指标,量化康复训练进程,可以为康复训练计划的制定与调整提供数据支持。
3 存在问题
虽然卒中后BCI运动神经反馈训练系统可以促进大脑的功能性和结构性重组,反映运动规划和执行能力的改善,但是某些系统的实验结果并没有达到可测量的水平或最小临床意义变化值(Minimal Clinically Important Difference, MCID),还处于一个亚临床的效果阶段[13]。导致这个问题的原因可能有以下几点。
3.1 现有研究的实验样本偏少且缺乏控制变量的对照实验分析
由于在医院进行康复训练的卒中患者具有流动性,很多病人出于各种原因无法完成全部实验,采集大量病人数据需要较长时间的研究,目前大部分研究还没有积累如此体量的病人数据。大部分研究的病人受试者数量在4~30不等[40,49-51,72-73],很多学术平台提供的数据来自健康人,但健康人的大脑与病人存在功能性和结构型差异,只能提供相对参考作用。一些实验进行了随机对照实验(Randomized Controlled Trial,RCT)的设计,但是由于样本量较少,而变量较多(如患者的病灶区域、患病严重程度、年龄、患病时间、患病类型、性别等),参考价值有待考证。
3.2 BCI运动神经康复训练系统受到患者个性化差异的影响
每位卒中患者的病灶区域、患病严重程度、患病类型等情况不尽相同,因此,一方面,他们的神经电信号具有差别,目前BCI系统解码器需要为每一位受试训练针对性的分类模型,辨识信号的类别。另一方面,他们适用的神经反馈机制不同,须根据患者的具体情况,分配最佳的反馈方式或多模式的反馈相结合。
3.3 缺乏最优训练范式和训练参数的设计研究
一些BCI运动神经反馈训练系统的训练时间较长,患者容易感到疲劳,从而大脑的参与度降低,康复训练的效果大打折扣。而训练时间较短的实验可能没有激活大脑特定模式就结束了,康复效果也会较差。现有研究的单次训练时长在30 min[79]~2 h[73]不等。此外,还需对BCI治疗频率和疗程数进行更多研究,以确定促进上肢运动康复的最佳剂量。
4 总结
融合脑机接口的手部运动神经康复机器人基于突触可塑性原理,通过运动学习(如密切观察运动任务、激发运动意图或想象运动任务)来激发大脑产生特定的脑信号,同时得到与任务直接关联的体感反馈激发大脑功能的恢复。尽管患有获得性运动障碍的人经常表现出皮质受损或运动连接完整性受损,但EEG-BCI方法仍能根据信号的变化提取出有意义的信息[80]。融合BCI的训练可以克服传统疗法(如物理疗法和约束诱导运动疗法)需要患者残存的运动功能的缺点,涉及大脑的主动参与,激发患者的康复能动力,有益病灶脑区的功能性重构,为更广泛的卒中人群提供康复治疗的新途径和新方法。
本文详细阐述了BCI神经康复训练系统中,脑运动功能活动诱发范式设计、机器人机构反馈环节、神经解码方式和评估方法的研究情况。运动想象是比较常用的脑电信号诱发范式,然而想象任务对患者的认知能力具有一定的要求,这种能力却又常常在卒中发生后受到影响。不仅如此,持续的想象任务很容易让患者产生疲劳。而运动意图任务不涉及主动抑制肢体活动的情绪,是一种潜意识的意愿,更容易完成。动作观察是另一种可以补偿MI的任务,让患者边观察边想象相应的手部动作可以辅助患者进行想象任务,且涉及更广泛的脑区参与。
机器人反馈机构将传统的机器人治疗方案与BCI技术相结合,利用机器人外骨骼提供低成本、不费力、高强度的重复练习,将肢体训练与心理训练相结合,建立起大脑到手部的人工通路,形成中枢神经-手部肌肉-周围神经-中枢神经的运动感觉环路,调动大脑康复潜能。神经解码是BCI系统实现的关键,本文介绍了SMR和P300两种范式及其解码技术,此外,基于人工神经网络和脑网络的解码技术也是研究的热点。手部运动功能的康复是基于BCI手部康复机器人的根本目标,因此临床指标如FMA-UE和ARAT等是检验康复效果的主要方式,而为了及时观察训练后脑功能变化,利用机器人外骨骼的运动学参数和基于EEG或fNIRS等生物电信号计算大脑功能性连接的变化大有裨益。
最后,本文针对当前BCI手部运动神经康复系统存在的问题进行总结,因为病人的患病情况存在个体性差异,所以针对每位患者选择效果最好的诱发方式和反馈方式,并训练针对性解码模型十分必要;另外,康复治疗的临床效果需要长时间定期训练积累,这种表现在功能性上的质变需要的周期较长,研究可以根据每次康复训练前后大脑功能性连接网络的变化来量化每次训练的效果,无论是给患者及时提供效果反馈,还是给康复治疗师提供康复方案的参考都十分重要。此外,对精细手指动作的解码算法探究和训练范式的规范性研究有望进一步提高康复机器人的整体性能。
综合分析,BCI基于计算机将大脑信号翻译为指令传递给外部设备来实现病人的运动学习和恢复,可以被认为是传统物理治疗方法的辅助解决方案[81]。目前,处于转化与应用研究阶段的BCI系统与传统物理疗法相结合的方法取得了一定成果[80]。使用融合脑机接口的手部运动神经康复系统有望突破传统疗法瓶颈,让更多卒中患者重返家庭和社会。
