磁共振-超声融合的前列腺靶向穿刺导航方法
2021-06-17胡冀苏钱旭升周志勇戴亚康
胡冀苏,马 麒,钱旭升,周志勇,戴亚康
(1.中国科学技术大学 生物医学工程学院(苏州), 江苏 苏州 215163;2.中国科学院 苏州生物医学工程技术研究所, 江苏 苏州 215163;3.苏州大学 附属第二医院, 江苏 苏州 215000;4.济南国科 医工科技发展有限公司, 山东 济南 250000)
0 引言
经直肠超声(transrectal ultrasound,TRUS)引导的前列腺穿刺活检目前仍然是临床确诊前列腺癌的金标准。然而,由于TRUS空间分辨率低、成像对比度较差,前列腺癌病灶往往难以识别甚至不可见,因而临床通常将前列腺分为等体积的多个区域进行10~12针系统性穿刺活检[1-3]。尽管如此,临床医生仍然很可能错过目标病变,造成重复穿刺,给患者带来额外的痛苦和费用。另一方面,磁共振成像(magnetic resonance imaging,MRI)已成为前列腺癌的重要诊断技术[1-3]。与TRUS相比,MRI具有更高的空间分辨率,提供多种成像对比度,可以极大地帮助临床医生检测目标病变并进一步判断其恶性程度。但是MRI成像速度过慢,更重要的是所有活检设备必须与高场环境兼容,从而限制了MRI引导前列腺活检的推广应用。
为了结合MRI和TRUS的优势,将术前MRI和术中TRUS融合是目前前列腺靶向穿刺的最通用方法。这方面的研究主要分为MRI-TRUS配准方法研究[4-7]和靶向穿刺系统构建研究[8-11]。TRUS和MRI的图像灰度差异、前列腺受探头挤压形变等问题,一直是前列腺MRI-TRUS配准方法研究中的重点和难点。许多学者[4-6]将形状统计模型、生物力学模型和有限元分析等融入传统配准方法中,实现了高精度的3D TRUS-MRI弹性配准,但计算过程复杂且耗时。近年来,Hu等[7]提出了基于弱监督深度学习的MRI-3D TRUS配准方法,基于MRI和3D TRUS中前列腺分割区域的弱标注就可实现快速精准的弹性配准。然而,不管是传统配准方法还是基于深度学习的配准方法,都需要在TRUS和MRI中准确分割出前列腺区域。尤其对于TRUS的前列腺分割问题,TRUS存在的噪声和伪影会极大影响分割结果的准确性和稳定性,进而影响上述这些配准方法的实际应用效果。另一类研究主要关注靶向穿刺系统构建方法,这类研究虽然采用了较为简单的配准方法,但也达到了较好的靶向穿刺精度,更具临床应用价值。早在2008年,Xu等[8]就提出了基于电磁定位的靶向穿刺引导系统,通过自由臂三维超声手动扫描二维超声的三维重建图像建立术前MRI与书中实时二维超声的转换关系,但手动扫描二维超声易影响三维重建精度,从而影响超声和磁共振图像的融合精度。为此,许多学者[9-11]直接选用三维超声探头替代自由臂三维超声,并达到了较好的穿刺精度。然而,这些方法均使用三维超声作为中介建立术前MRI与术中2D TRUS的关系,而目前三维超声探头仅在少数高端机型配备,尚未普及应用,因此本研究将直接建立术前MRI与术中2D TRUS的空间位置关系,实现前列腺靶向穿刺引导。
本研究使用电磁定位技术获取2D TRUS的空间位姿,在不使用3D TRUS数据的情况下,基于互信息测度对所选的MRI层面与2D TRUS进行刚性配准,进而建立术前MRI图像与术中2D TRUS图像的空间转换关系。根据术中TRUS的实时空间位姿对术前MRI重切面,通过观察重切面图像与术前规划3D可视化模型的相对位置关系,并将术前规划病灶区域映射到TRUS中,从而指导穿刺进针,实现精准的前列腺靶向穿刺引导。本研究采用双平面腔内超声探头针对经会阴穿刺方式实现了整个靶向穿刺引导流程,并使用前列腺仿体进行了实验验证。
1 方法
本方法直接建立了术中2D TRUS到术前MRI图像的转换关系m=Tm←wTw←sTs←uu,其中u=[xu,yu,0,1]T和m=[xm,ym,zm,1]T分别为TRUS坐标系和MRI坐标系下的坐标点,Ts←u为TRUS坐标系到磁定位传感器坐标系变换矩阵,由超声探头标定方法计算得到,Tw←s为磁定位传感器坐标系到磁定位空间坐标系变换矩阵,由磁定位传感器度数直接获得,Tm←w为磁定位空间坐标系到MRI图像空间坐标系变换矩阵,由本文所提出的半自动图像配准方法计算得到。该方法无需通过3D TRUS建立2D TRUS与MRI之间的转换关系,而是以半自动方式通过选择同平面TRUS和MRI层面进行二维配准直接建立2D TRUS与3D MRI图像空间的转换关系。穿刺引导时将术前MRI确定的靶区映射到TRUS中,并根据TRUS实时空间位置对术前MRI图像进行重切面,通过观察前列腺三维模型与实时重切面MRI图像的位置关系确定超声成像位置,根据病灶与超声探头的距离在专用穿刺夹具选择合适的穿刺路径,实现前列腺靶向穿刺的引导。
1.1 术前规划
首先根据术前MRI图像分割出前列腺、尿道和病灶区域,其中前列腺区域使用预先训练的Vnet[12]卷积神经网路自动分割得到,尿道与病灶区域由手动逐层勾画得到。对于病人图像,病灶区域需要结合T2W和DWI高b值图像综合确定,此时需在T2W和DWI联动显示下对病灶进行勾画。最后我们根据分割结果生成前列腺、尿道和病灶区域的三维模型,可帮助医生观察病灶在前列腺三维空间中位置。

图1 前列腺体模的前列腺、病灶、尿道分割区域以及三维模型
1.2 超声标定
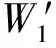

图2 探头夹具、标定仿体和标定原理示意图
1.3 磁定位空间与MRI图像空间坐标转换关系
为了求解磁定位空间到MRI图像空间的转换矩阵Tm←w,需要获取两个空间中对应位置的特征点集。因此,我们提出了一种基于选择同平面MRI和TRUS图像对的配准方法。首先,确定术前MRI图像目标层面,使用超声探头的横向屏幕模式进行扫描,移动超声探头直至TRUS显示与所选MRI层面相同的解剖结构,记录此时的TRUS图像和此时的磁定位传感器数据。其次,对所选的MRI和TRUS图像对进行二维刚性配准:使用归一化互信息[15]作为配准测度,由f(A,B)=(H(A)+H(B))/H(A,B),其中H(A)和H(B)为待配准图像A和B的熵,H(A,B)为联合熵,设计算互信息的灰度级为32;配准前对所选MRI和TRUS进行预处理,根据术前MRI前列腺分割区域将所选MRI图像非前列腺区域像素置零,在TRUS图像中截取图像区域,去除其他显示标注信息;使用Powell优化方法,步长设为2,最大迭代次数设为100,误差设为0.0001,并设置变换矩阵角度及平移的惩罚系数为1000和1,放置求解得到的角度参数过大;这样可得到TRUS到所选MRI图像层面的配准矩阵T2D。最后,在TRUS图像空间随机生成n个二维坐标点,得到点集u′,通过T2D变换到所选MRI层面图像空间,得到点集m′。将点集u′和m′转换到三维空间得到点集u″和m″,其中u″点集第三个维度坐标值为0,m″ 点集第三个维度的坐标值为所选MRI层面在整个3D MRI图像空间层方向的坐标。根据m″=Tm←wTw←sTs←uu″,Tw←s由记录的磁定位传感器数据得到,Ts←u由超声探头标定过程得到,则可求得磁定位空间到MRI图像空间的转换矩阵Tm←w。
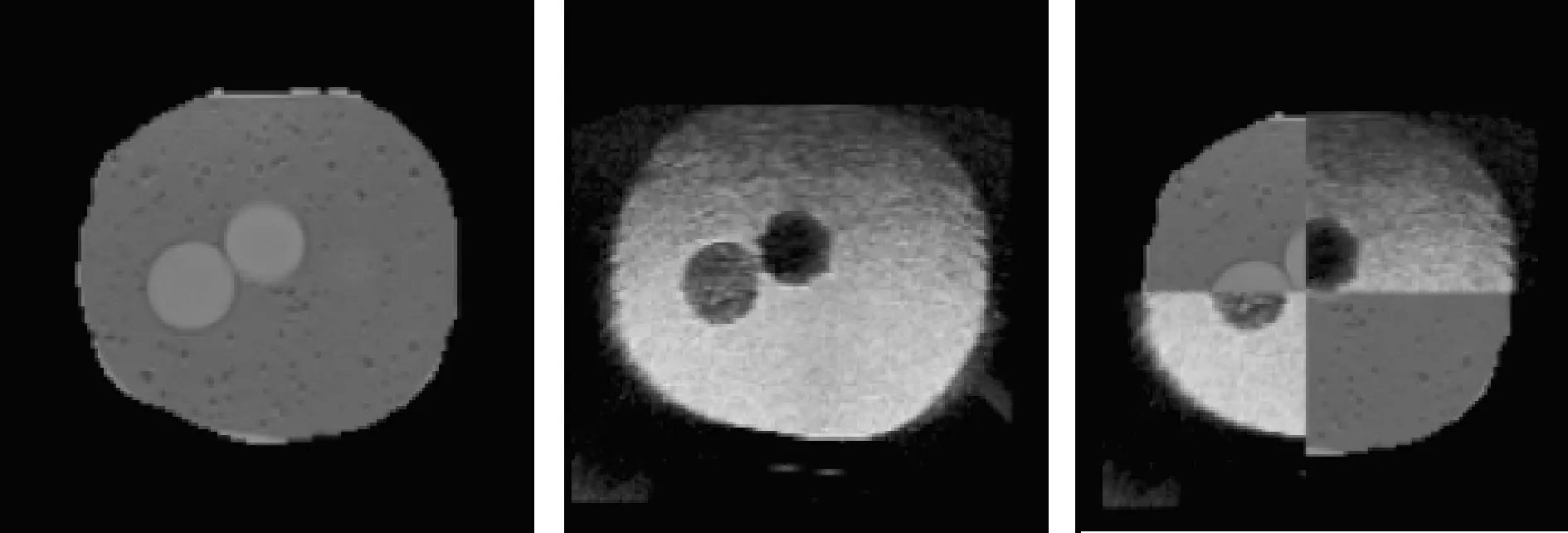
图3 MRI图像、TRUS图像及配准结果
1.4 穿刺引导
当开启实时引导后,将超声探头切换至矢状面扫描模式。在任意时刻,根据m=Tm←wTw←sTs←uu将当前TRUS成像平面转换到MRI图像空间,计算得到与当前TRUS对应的MRI重切面图像。同理,对MRI图像病灶分割区域进行重切面,将病灶区域显示在MRI重切面图像上,同时将病灶区域反向转换到TRUS图像空间,在TRUS图像中进行显示,提示当前TRUS图像中病灶区域的有无与位置。此外,为了展示当前TRUS图像平面与术前规划三维模型的相对位置关系,将重切面MRI图像显示在三维视图中,可引导使用者更高效地移动超声探头,使病灶区域与TRUS图像屏幕相交。当病灶区域出现在TRUS图像中,根据病灶与超声探头的距离调整穿刺架位置,穿刺进针。由于穿刺针在TRUS图像屏幕内移动,当观察到穿刺针达到病灶区域后,即完成穿刺过程。

图4 穿刺引导中的MRI重切面图像、三维模型和TRUS图像
1.5 系统实现
靶向穿刺硬件平台由计算机、磁定位仪(Patriot, Polhemus)、视频采集卡、双平面腔内探头和专用探头夹具组成。其中视频采集卡可实时截取超声设备的屏幕输出,专用探头夹具将磁定位传感器与超声探头刚性连接,并集成穿刺架功能。导航软件使用C++编程语言在Visual Studio 2015开发,使用了Qt、VTK、ITK及Eigen工具包,其中Qt用于软件框架搭建,VTK用于医学图像的二维三维显示,ITK用于医学图像配准、Eigen用于矩阵计算。此外,MRI图像的前列腺自动分割模型由PyInstaller工具包打包为可执行程序,以便导航软件术前规划模块调用。
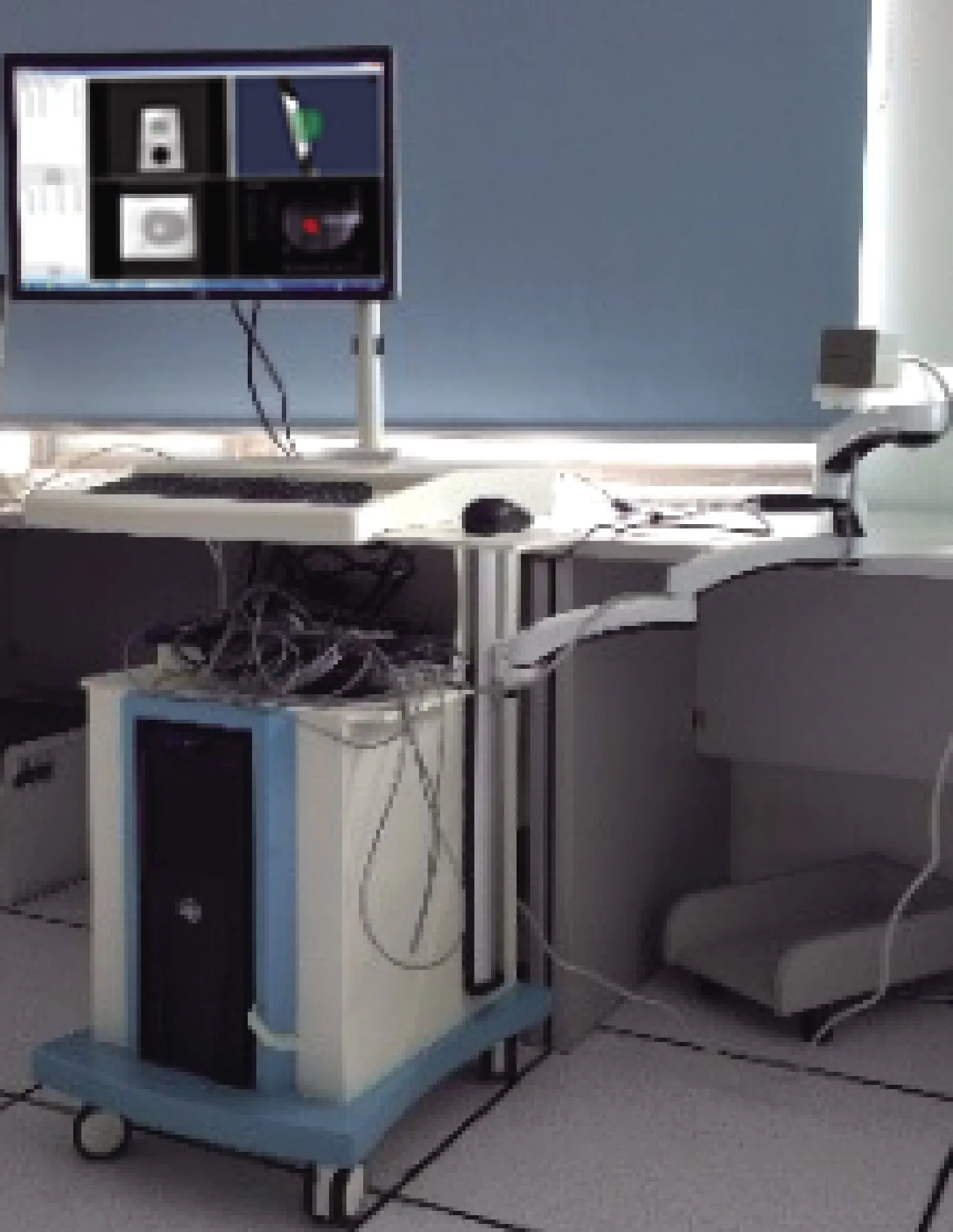
图5 靶向穿刺系统平台
2 实验结果
本小节采用目标配准误差(target registration error,TRE)评价超声标定误差、所选MRI层面与TRUS二维配准误差以及三维配准误差。其定义为TRE(p,p′)=|Tp-p′|,其中p和p′ 分别为两个坐标系下相对应的坐标点,T为两坐标系的转换关系,‖表示距离。首先给出超声标定的验证过程和标定误差,接着使用前列腺体模验证本文靶向穿刺引导方法,并计算评估配准误差和穿刺引导误差,最后分析了本文方法的局限性。
2.1 超声标定
本研究首先通过实验评估了超声标定的精度。由于使用了双平面超声探头,需要对两个成像平面分别进行标定。对于每个成像平面,通过扫描标定仿体获得5组配对的TRUS图像与磁定位传感器数据。对于每副TRUS图像,仅使用距探头最近的3到4条网格点,在软件中点选网格点在TRUS图像中的坐标。使用90%的网格点进行标定矩阵计算,10%的网格点进行标定矩阵的验证,计算得到TRUS横断面和矢状面的标定误差分别为1.23 mm和1.68 mm。
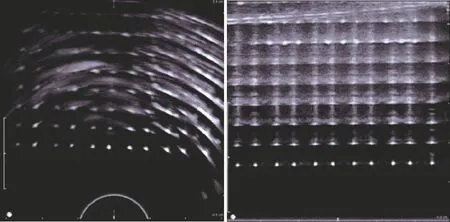
图6 超声标定网格点图像
2.2 穿刺引导
本研究采取商用前列腺体模(053L, CIRS, Norfolk, USA)进行实验验证,该体模包含模拟的直肠壁、前列腺、尿道和精囊模拟结构以及三个直径约1 cm的模拟病灶。使用3T MRI扫描仪(Ingenia,飞利浦医疗)对该体模进行扫描得到层厚为4 mm的T2W图像。根据1.1小节的方法分割前列腺、尿道和病灶区域,生成三维模型。将3个模拟病灶的中心作为计划穿刺靶点,并记录穿刺靶点在MRI图像空间的坐标。根据3个病灶在MRI图像中的最大层面,记录相应的TRUS图像和磁定位传感器数据,根据1.3小节的方法进行配准。
由于MRI层面与TRUS的二维配准精度决定了后续穿刺引导精度,在每组配准中分别从MRI层面和TRUS中选取病灶或尿道的中心位置,将该位置在TRUS的坐标经过二维配准矩阵变换到MRI层面中,与选取的MRI层面中坐标计算差值作为配准误差,得到6组配准平均误差为(1.91±0.29)mm。
每组图像对配准后,根据1.4小节的方法对三个模拟病灶进行穿刺实验,共计进行18次穿刺实验。每次穿刺时,保证当前TRUS显示的病灶区域最大。由于在TRUS矢状面成像平面中可直接观察穿刺针行进,且穿刺针道位置可调,可保证穿刺针在当前TRUS平面中准确到位病灶区域中心。因此,我们记录下该TRUS图像病灶中心的TRUS图像坐标,并变换到MRI图像空间中,与该病灶中心在MRI图像空间的规划坐标计算差值作为当前穿刺误差。穿刺误差如表1所示,计划穿刺点与实际穿刺点的平均误差为(1.98±0.28)mm。
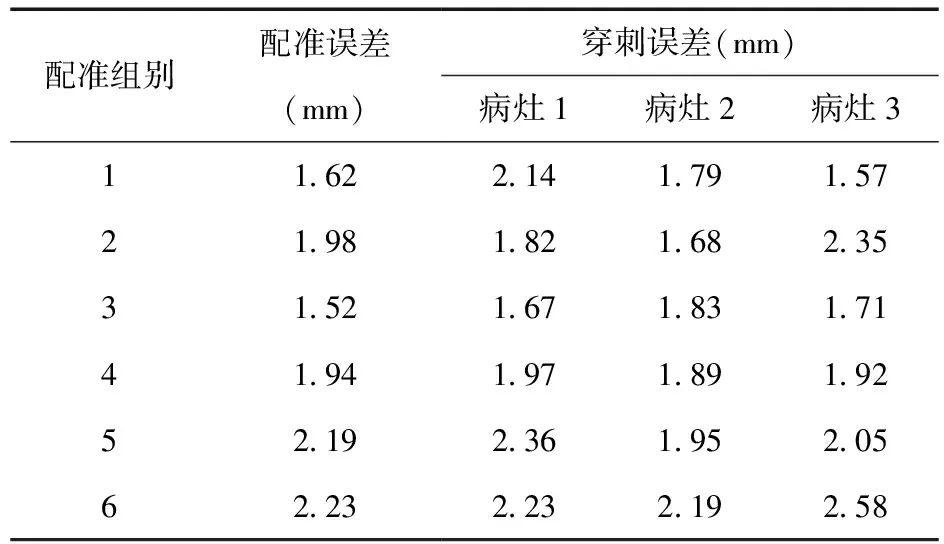
表1 配准误差与穿刺误差
2.3 局限性
上述结果证明,本研究在超声标定和穿刺引导方面均达到了良好的性能,但也存在一些局限性。首先,超声标定的精度有待进一步提高。参考文献[9]报道了标定误差小于1 mm,优于本文所展示的结果。这说明,如果能更精确地构造标定仿体,那么有可能将标定误差控制在1 mm以下,从而进一步降低系统误差。其次,虽然本文方法无需经由3D TRUS建立术前MRI与术中2D TRUS的空间转换关系,但需人工选择同平面的MRI与TRUS图像对,若所选图像有明显偏差则会导致明显的穿刺引导误差,因此需要由专业临床医生完成图像对的选择。最后,由于实际临床应用中会引入更多的形变和运动干扰,本文方法还需要通过临床实验来验证实际使用效果。
3 结论
本文提出了一种MRI-TRUS融合的前列腺靶向穿刺导航方法。基于所选的MRI-TRUS图像对直接建立术前MRI与术中2D TRUS的空间位置关系,显示术前MRI的实时重切面图像以及与术前规划三维模型的实时相对位置关系,将病灶区域映射到TRUS中,从而指导前列腺靶向穿刺进针。本文通过前列腺体模实验初步验证了该方法的可行性。未来我们将在标定仿体构造、配准方法、运动补偿等方面进行改进,进一步提升靶向穿刺导航方法的精度与稳定性,并在临床实验中进行验证。
