脑栓通胶囊对ApoE-/-小鼠主动脉炎症因子表达的影响
2021-06-17李子洁刘婷婷赵学庆郑文荣王宇峰祝自新孙芳玲
李子洁,刘婷婷,赵学庆,郑文荣,王宇峰,田 欣,祝自新,孙芳玲*,王 文*
(1.遵义医科大学基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州遵义 563006;2.首都医科大学宣武医院实验动物室,北京市老年病医疗研究中心,北京 100053)
动脉粥样硬化(atherosclerosis, AS)是一种慢性炎性疾病。 由血小板聚集和血栓形成引起不稳定的动脉粥样硬化斑块破裂,血管狭窄或闭塞可导致急性心血管疾病[1]。 相关研究发现,动脉粥样硬化病典型表现为动脉最内层内膜的不对称局灶性增厚,伴随着内皮细胞(endothelial cells, EC)的血流介导的炎症变化。 发病时许多免疫细胞表现出激活的迹象,并产生促炎细胞因子[2]。 因此,抑制IL-1β、IL-6、TNF-α、ICAM-1 和 MMP-9 等相关炎症因子以改善心血管疾病,从而减少动脉粥样硬化及其并发症,可能为AS 的治疗提供新的思路[3-4]。 脑栓通胶囊有活血化瘀,祛风化痰的临床应用,可用于治疗动脉粥样硬化性血栓性脑梗死,但机制尚不清楚[5]。 本研究采用 ApoE-/-(apolipoprotein E)动脉粥样硬化小鼠模型[6],探讨脑栓通胶囊对AS 小鼠炎症相关因子 IL-1β、IL-6、TNF-α、ICAM-1 和 MMP-9 表达的影响,旨在为脑栓通胶囊治疗AS 的作用机制提供理论依据。
1 材料和方法
1.1 实验动物
33 只SPF 级8 周龄雄性健康ApoE-/-小鼠 (品系: C57BL/6J),体重(24±2) g,由北京大学医学部(实验动物科学部)提供[SCXK(京) 2016-0010]。饲养于首都医科大学宣武医院实验动物室全封闭SPF 级动物房[SYXK (京) 2015-0016],室温(23±2)℃,空气相对湿度55%±5%,每日光照12 h。 所有动物实验遵循实验动物福利3R 原则,经首都医科大学宣武医院实验动物福利伦理审查委员会审核并批准(XW20170703)。
1.2 主要试剂与仪器
脑栓通胶囊(广东华南药业有限公司生产,国药准字Z20040093);饱和油红O 染色液(G1260,北京 索 莱 宝 科 技 有 限 公 司 ); 电 泳 仪(BioRad043BR1549,美国BIORAD 公司);化学发光凝胶成像系统(FlourChem HD2,美国Alpha 公司);IL-1β 抗体(ab205924,美国 abcam 公司);MMP-9 抗体(13667T,美国 cell signaling 公司);ICAM-1 抗体(ab179707, 美 国 abcam 公 司); TNF-α 抗 体(ab6671,美国 abcam 公司)、IL-6 抗体(ab6672,美国 abcam 公司)。
1.3 实验方法
1.3.1 实验动物分组及给药
8 周龄雄性ApoE-/-基因敲除小鼠,给予高脂饮食喂养(含0.15%胆固醇、21%脂肪),建立动脉粥样硬化模型[7-8],高脂饲料喂养12 周后,将小鼠随机分为三组,每组11 只:模型对照组、脑栓通小剂量给药组和脑栓通大剂量给药组。 模型对照组灌胃给予等体积双蒸水,脑栓通小剂量给药组灌胃给药(0.5 g/(kg·d)),脑栓通大剂量给药组灌胃给药(1 g/(kg·d))。 连续给药 12 周,每天给药 1 次。
1.3.2 整体主动脉油红O 大体染色
喂养时随机抽取小鼠,进行油红O 染色,观察有无斑块形成,判断ApoE-/-小鼠动脉粥样硬化发展情况并确定模型是否稳定。 用1%戊巴比妥钠麻醉后,充分暴露腹腔、胸腔,用眼科器械仔细分离心脏周围组织,剪断气管、食管,剪掉肺;从近心端主动脉根部和远心端髂动脉剪取整体主动脉。 在体式显微镜下,剥离干净整体主动脉上的脂肪组织和结缔组织。 生理盐水充分漂洗后,沿着上升主动脉外缘、主动脉弓外缘剪至下降主动脉上端,再沿着上升主动脉内缘、主动脉弓内缘至髋动脉剪开整体主动脉。 生理盐水充分洗涤。 60%异丙醇浸洗后用油红O 染色工作液染色30 min[9]。 在体式显微镜下拍照。
1.3.3 Western blot 方法检测整体主动脉炎症因子表达
将整体主动脉在冷的生理盐水中于体式显微镜下将脂肪组织和结缔组织剥离干净置入离心管中匀浆、超声。 4℃,4000 r/min 离心 20 min,取上清进行BCA 法测定蛋白浓度,通过SDS-PAGE 垂直电泳,转移到硝酸纤维素(NC)膜,根据蛋白分子量确定电转时间。 转膜结束后,室温条件下5%脱脂牛奶封闭2 h。 并按说明书的稀释比例以及预实验确定 IL-1β、IL-6、TNF-α、ICAM-1 和 MMP-9 一抗抗体浓度,并与β-肌动蛋白(β-actin)4℃孵育过夜;1×TBST 漂洗,10 min×3 次,置于摇床上充分漂洗;加入用1×TBST 稀释的二抗,室温孵育2 h;洗膜后用ECL 发光液显色,于化学发光成像仪中曝光拍照。将数据导入AIC.AlphaView 软件中进行分析,分别计算出目标蛋白条带灰度值,与β-actin 的比值作为蛋白水平的定量指标。
1.4 统计学方法
实验数据采用SPSS 20. 0 软件进行统计,结果以平均数±标准差()表示。 用单因素方差分析(one-way analysis of variance,ANOVA) 进行组间样本均数比较,P<0.05 表示具有统计学意义。
2 结果
2.1 脑栓通对ApoE-/-小鼠动脉粥样硬化斑块的影响
油红O 染色检测整体主动脉动脉粥样硬化斑块形成情况。 结果显示:与模型对照组相比,脑栓通小剂量给药组动脉粥样硬斑块面积有减少趋势,但无统计学差异(n=8,P>0.05);脑栓通大剂量给药组动脉粥样硬化斑块面积明显减少(n=8,**P<0.01,图1)。
2.2 脑栓通对 ApoE-/-小鼠主动脉 IL-1β、IL-6、TNF-α 表达的影响
脑栓通对小鼠主动脉相关炎症因子的检测结果表明,与模型对照组相比,脑栓通胶囊小剂量和大剂量给药组IL-1β 和IL-6 表达水平明显降低(n=3,*P<0.05);大剂量给药组 TNF-α 蛋白表达水平明显减少,而小剂量给药组无明显差异(n=3,**P<0.01,图 2)。
2.3 脑栓通对ApoE-/-小鼠主动脉内皮ICAM-1表达的影响
与模型对照组比较,脑栓通胶囊小剂量给药组与模型对照组相比虽有下降趋势,但是没有统计学差异差异(n=3,P>0.05);脑栓通胶囊大剂量给药组与模型对照组相比ICAM-1 的表达量明显降低(n=3,*P<0.05,图 3)。
2.4 脑栓通对ApoE-/-小鼠主动脉MMP-9 表达的影响
与模型对照组比较,脑栓通胶囊小剂量给药组和脑栓通胶囊大剂量给药组的主动脉MMP-9 表达水平有所降低,但是没有统计学差异,其中,脑栓通胶囊小剂量给药组和大剂量给药组之间也没有明显差异(n=3,P>0.05,图4)。
3 讨论
AS 是动脉壁内的炎性疾病,可引起冠状动脉疾病,心肌梗塞,中风和外周动脉疾病。 由于大多数人生活饮食的不规律,动脉粥样硬化在世界范围内的发病率正逐年上升,并有年轻化的趋势[10]。 以前动脉粥样硬化仅仅被认为是动脉壁脂肪沉积引起的管道阻塞。 如今,有部分学者认为动脉粥样硬化的发生包括死细胞和低密度脂蛋白的氧化促炎和免疫刺激特性,以及各种细胞参与者之间不断相互作用的结果[11-12]。 活跃的炎症过程可能会触发斑块破裂并增加冠状动脉血栓形成的风险,从而导致血管或局部组织缺血[13-14]。 因此,炎症反应可能是造成小鼠动脉粥样硬化病变的重要机制。

图1 各组ApoE-/-小鼠整体主动脉油红O 染色Note. A, Model-control group. B, Naoshuantong-Low. C,Naoshuantong-High. Compared to the model group, **P<0.01.Figure 1 Oil red O staining of the whole aorta of ApoE-/-mice in each group
脑栓通胶囊是一种由蒲黄、赤芍、郁金、漏芦、天麻组成的中药制剂,主要用于缺血性脑卒中、脑梗塞等病症[15]。 其疗效显著且稳定,但作用机制尚不清楚。 ApoE 基因编码的蛋白于1985 年第一次测得,分子量大小为34×103,位于19 号染色体上[16]。它通过结合低密度脂蛋白受体(LDLR)和乳糜微粒残基受体来调节脂蛋白清除[17]。 因此缺乏ApoE 预计会导致血浆中富含胆固醇的残留物的积累,这些残留物的循环延长可能引起动脉粥样硬化。 1992年,有研究报道构建了ApoE 基因敲除小鼠。 并在喂食普通饲料的条件下,都出现了血胆固醇高的情况,不需要对照组比较,就可以证明大部分模型在冠状动脉和肺动脉根部近主动脉处有明显病变[18-19]。 目前国内外在ApoE-/-小鼠AS 后炎症反应的研究甚多,但关于脑栓通治疗AS 的作用效果还未见报道。 本实验室前期研究发现,脑栓通能降低ApoE-/-小鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C) 和高密度脂蛋白胆固醇(high density lipoproteincholesterol, HDL-C) 水平[7]。 本研究进一步通过对ApoE-/-小鼠斑块面积以及炎症相关因子表达的检测,深入探讨脑栓通胶囊治疗动脉粥样硬化的机制。 在动脉粥样硬化慢性炎症反应过程中,IL-1β是心血管疾病的重要调节因子,主要由活化的巨噬细胞、平滑肌细胞、内皮细胞等产生,导致IL-6 和c反应蛋白水平升高,使血管壁内早期沉积的胆固醇结晶与巨噬细胞单核细胞相互作用,引发脂肪纹并促进局部动脉粥样硬化生成[14,20-21]。 同样,TNF-α也可介导全身的炎症和免疫反应,其主要由活化的单核巨噬细胞分秘,参与脂质浸润过程,诱发病变与斑块形成。 本研究提示脑栓通胶囊能够显著降低 ApoE-/-小鼠主动脉 IL-1β、IL-6 和 TNF-α 的表达水平,减少脂质在内皮损伤部位的沉积,抑制动脉粥样硬化的形成。 细胞间黏附因子ICAM 属于免疫球蛋白超家族的糖蛋白,被认为是细胞聚集到炎症区的重要黏附因子,在稳定细胞间相互作用和促进白血球和内皮细胞的迁移起到重要作用[22]。 本研究显示,与模型组相比,ApoE-/-小鼠给与大剂量脑栓通后,能显著降低ICAM-1 的表达,提示大剂量脑栓通能够减少巨噬细胞等炎症细胞聚集和内皮细胞的黏附,减少炎症因子引发的后续炎症反应,从而抑制动脉粥样硬化斑块的形成[23]。 基质金属蛋白酶(matrix metalloproteinases, MMPs)属于水解酶家族,能够降解胞外基质,比如:弹性蛋白、蛋白多糖和胶原蛋白,参与血管弹性和修复。 MMP-9 过量表达可能破坏内皮细胞周围的基底膜,促进单核细胞在内皮细胞间的迁移,导致斑块不稳定[24]。ApoE-/-基因敲除小鼠在动脉粥样硬化模型后,连续给予脑栓通12 周,小剂量和大剂量给药组与模型组相比,MMP-9 蛋白表达量虽有减少趋势但无统计学差异。 我们推测这与MMP-9 参与血管生理和病理机制复杂有关。 MMP-9 蛋白除参与炎性反应,还在血管修复中起关键作用[25]。 研究表明,血管内皮细胞可通过分泌MMP-9,促血管内皮生长因子表达,进而促进血管修复。 同时,血管生成因子又能反馈调节MMP-9 的表达,促进血管结构稳定[26-27]。 因此,脑栓通作为有效的脑血管病治疗药物,对MMP-9 的活性调节可能不局限于炎症反应,后续将从多个角度观察其对血管功能的调控作用。
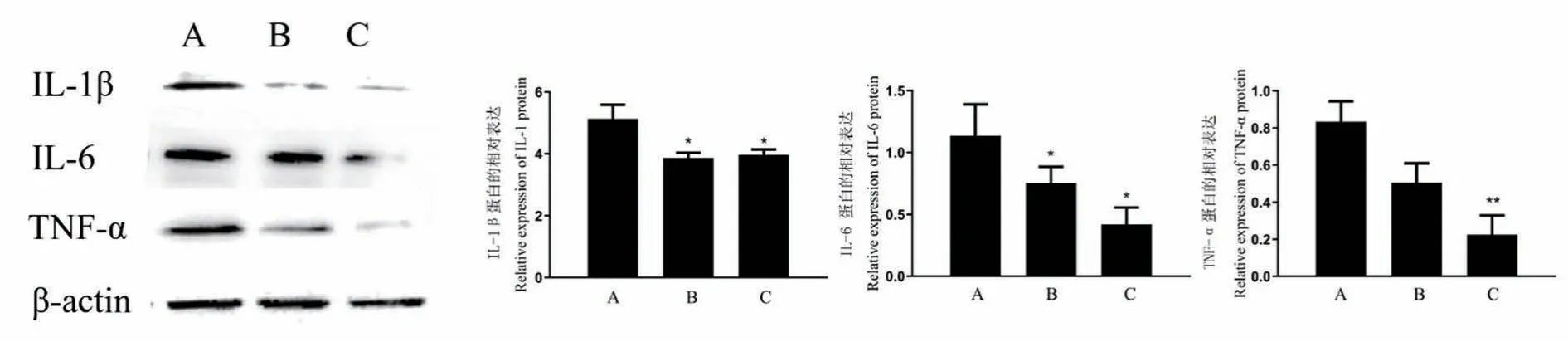
图2 脑栓通对 ApoE-/-小鼠主动脉IL-1β、IL-6、TNF-α 蛋白表达水平的影响Note. A, Model-control group. B, Naoshuantong-Low. C, Naoshuantong-High. Compared with the model group, *P<0.05, **P<0.01.Figure 2 Effect of Naoshuantong on expression of IL-1β、IL-6、TNF-α protein in aorta of ApoE-/- mice

图3 脑栓通对ApoE-/-小鼠主动脉内皮ICAM-1 蛋白的表达Note. A, Model-control group. B, Naoshuantong-Low. C, Naoshuantong-High. Compared with the model group, *P<0.05.Figure 3 Effect of Naoshuantong on ICAM-1 protein expression in aortic endothelium of ApoE-/-mice
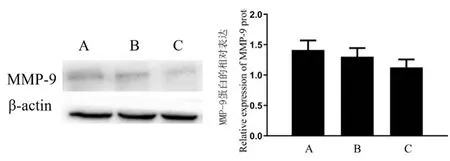
图4 脑栓通对ApoE-/-小鼠主动脉MMP-9 蛋白的表达Note. A, Model-control group. B, Naoshuantong-Low. C,Naoshuantong-High. Compared wsith the model group, P>0.05.Figure 4 Effect of Naoshuantong on MMP-9 protein expression in aortic endothelium of ApoE-/-mice
综上所述,ApoE-/-基因敲除小鼠的动脉粥样硬化模型在给予脑栓通治疗后,可减少主动脉斑块面积,抑制动脉粥样硬化的形成,其作用机制可能与降低炎症相关因子 IL-1β、IL-6、TNF-α 和 ICAM-1 的表达有关。
