CD32 在艾滋病潜伏感染恒河猴模型的表达特征
2021-06-17张京京陆佳涵卢秋翰
张京京,童 玲,陆佳涵,卢秋翰,丛 喆,薛 婧
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,国家卫生健康委员会人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
联合抗逆转录病毒疗法( combination antiretroviral therapy, cART)可以有效地抑制HIV复制并缓解患者的疾病进程,但由于病毒长期潜伏使HIV 治愈成为难题[1]。 病毒潜伏库是造成停药后病毒快速反弹的重要原因之一,它是含有可复制的完整的HIV 前病毒DNA 但转录并不活跃的细胞和组织。 潜伏库细胞以静息CD4+T 细胞为主[2],近年来国内外有多篇关于潜伏库细胞标志物的研究报道[3-6],CD32 能否作为HIV 潜伏库的标记物成为国际上备受关注的热点之一。
CD32(FcγRII)是一种以低亲和力与IgG Fc 段相结合的免疫球蛋白Fc 受体,其主要表达于中性粒细胞、单核细胞、血小板和内皮细胞表面[7],分为CD32a ( FcγRIIa), CD32b ( FcγRIIb) 和 CD32c(FcγRIIc)三个亚型[8]。 CD32 参与了巨噬细胞、NK细胞等免疫细胞介导的免疫反应,是连接先天免疫和适应性免疫应答的关键分子[9]。 研究发现CD32在HIV 感染的静息CD4+T 细胞上高表达,含有前病毒DNA 的CD32a+CD4+T 细胞占潜伏库细胞的26.8%至 83.3%[10],并且 CD32+CD4+T 细胞与PBMC 中的前病毒DNA 水平成正相关[11]。 但也有研究证明CD32 与多种活化标志物共表达,可能并不是潜伏库的标志物[12]。 CD32 与HLA-DR 共表达可高达79.2%[13],CD32+静息CD4+T 细胞中含有的前病毒DNA 与潜伏库细胞的比值小于3%[14]。由此,CD32 能否作为病毒潜伏库的标志物是值得商榷的,它能否成为治愈艾滋病的关键靶标也有待深入探究。
本研究中,利用建立的模拟HIV 患者全病程的艾滋病潜伏感染恒河猴模型,研究感染前与cART不同的治疗阶段中CD32 在CD4+T 细胞各亚群中的表达量变化,从而初步探索CD32 与潜伏库的关系及其在艾滋病疾病进程中发挥的作用及功能。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
本实验选用4 只SPF 级恒河猴,1 只雌性,3 只雄性,购自北京协尔鑫生物资源研究所[SCXK(京)2015-0011],年龄为 3 ~4 岁,体重约 4 kg。 实验前采用免疫荧光法进行筛查,排除猴单纯疱疹病毒I型(BV),猴逆转录病毒(SRV),猴免疫缺陷病毒(SIV)及猴T 细胞白血病病毒(STLV)。 实验动物饲养及动物实验研究经中国医学科学院医学实验动物研究所审批通过(IACUCXJ19005)。 实验动物饲养及实验操作在生物安全三级实验室进行[SYXK(京)2017-0027],所有动物实验遵循3R原则。
1.1.2 毒株
实 验 毒 株 为 SIVmac239。 由 美 国 Aaron Diamond 艾滋病研究中心的Preston Marx 博士惠赠,经实验室使用CEMx174 细胞株扩增制备,半数组织培养感染剂量(TCID50)为3×105/mL。
1.2 主要试剂
APC mouse anti-NHP CD45(货号:561290)、PerCP mouse anti-human CD3(货号:552851)、PE mouse anti-human CD8(货号:555367)、BD FACSTM lysing solution(货号:9224600)、BD TrucountTM tubes(货号:19276)购自美国BD Pharmingen 公司;FITC anti-human CD4 (货 号: 317408)、 APC/Cy7 antihuman CD25(货号:302614)、Brilliant Violet 421 anti-human CD69(货号:310930)、Brilliant Violet 605 anti-human HLA-DR(货号:307640)、Brilliant Violet 650 anti-human CD197(CCR7,货号:353234)、APC mouse anti-human CD45RA (货 号: 561210)、 PE mouse anti-human CD32 (货 号: 550586)、 BV786 mouse anti-human CD3(货号:563918) 购自美国Biolegend 公司。
1.3 实验方法
1.3.1 实验样本收集与处理
分别于感染前(第0 天),攻毒后(第525 天),治疗中(第637 天),停药后(第700 天)采集猴外周血,用于全血流式CD4+T 淋巴细胞计数分析,血浆病毒载量监测,及外周血单核细胞(PBMC)分离纯化。
1.3.2 SIVmac239 潜伏感染恒河猴模型建立
将本实验室保藏的SIVmac239 毒株从液氮罐取出,于 37℃水浴融化,用 RPMI 1640 稀释至 500 TCID50/mL,静脉途径感染恒河猴,建立SIVmac239感染恒河猴模型。 从病毒接种后的第525 天至第672 天感染猴接受cART,治疗方案为拉米夫定片30 mg/kg、富马酸替诺福韦二吡呋酯片20 mg/kg、克立芝20 mg/kg。 上述药物研磨后分别溶于0.5 mL 三蒸水中混匀,再与等体积的30%环糊精混匀过滤,放置-20℃保存,治疗期间拉米夫定、富马酸替诺福韦二吡呋酯每日肌肉注射给药一次,克立芝每日肌肉注射给药两次[15],由此建立艾滋病潜伏感染恒河猴模型。 实验期间,若实验动物体重低于25%即为仁慈终点,由兽医执行安乐死,尸体按医疗垃圾做无害化处理。
1.3.3 血浆病毒载量监测
利用QIAGEN 公司的 Viral RNA Mini Kit 试剂盒从实验猴血浆中提取病毒RNA,使用荧光定量PCR 方法对血浆病毒载量进行定量分析[16]。
1.3.4 外周血中CD4+T 细胞绝对数及CD4/CD8比值的监测
将50 μL 外周血置于流式管内,加入 APCCD45, PerCP-CD3,FITC-CD4,PE-CD8 荧光抗体孵育30 min,然后裂解红细胞,使用TrucountTM tubes进行细胞计数,应用C6 流式细胞仪上机检测[17]。
1.3.5 静息CD4+T 细胞群及细胞亚群中CD32 表达量测定
2×106个 PBMC 中加入 BV786-CD3,FITC-CD4,APC-CD45RA, BV650-CCR7, APC/Cy7-CD25,BV421-CD69,PE-CD32,BV605-HLA-DR 荧光抗体孵育30 min,固定后24 h 内使用BD FACS ArialⅡ流式细胞仪上机检测。
1.4 统计学方法
使用Flowjo 10 软件对多色流式细胞仪进行结果分析,Graphpad 8.0 软件进行绘图和数据统计分析。 实验结果以平均数±标准差()表示,P<0.05,具有统计学差异。
2 结果
2.1 SIVmac239 潜伏感染恒河猴模型中血浆病毒载量、CD4+T 细胞计数,CD4+/CD8+比值的动态变化
SIVmac239 静脉感染的恒河猴(cART-1, cART-2, cART-3, cART-4)建立稳定的慢性感染后,经cART 连续治疗5 个月,血浆病毒载量在治疗期间被完全抑制,由(5.04±0.51) log10copies/mL 至给药后第3 周全部降低达检测线2.00 log10copies/mL;停药后第686~714 天观察到血浆病毒载量反弹为(5.18±0.77) log10copies/mL(图 1A)。 感染猴在慢性感染期,外周血CD4+T 细胞绝对数处于较低水平每毫升(529±102)个(图1B),且CD4+/CD8+比值出现倒置现象(图1C);cART 治疗期间,CD4+T 细胞绝对数增加至每毫升(1525±611)个(图 1B),CD4+/CD8+比值升高至正常范围并维持在(1.30±0.48)(图1C),完成了部分免疫重建;停药后,随着病毒载量的反弹,CD4+T 细胞再次受到攻击,CD4+T 细胞绝对数降低,CD4+/CD8+比值再次出现倒置(图1B、1C)。
2.2 SIVmac239 潜伏感染恒河猴模型不同阶段CD32 在静息型、活化型或总CD4+T 细胞中的表达变化
从恒河猴外周血中分离得到PBMC 并进行流式分析,根据CD32 同型对照确定CD4+T 细胞亚群中CD32+的表达量(图2A)。 与第0 天处于未感染状态相比,恒河猴在SIVmac239 感染后CD32+CD4+T 细胞亚群在总CD4+T 细胞中的比例显著升高,由未感染时的(1.53±0.58)%分别上升至治疗前(3.90±1.30)%、治疗中(4.56±1.58)%和治疗后(5.04±2.36)%(图 2B)。 进而,将 CD4+T 细胞分为静息CD4+T 细胞亚群(CD25-CD69-HLA-DR-)及活化CD4+T 细胞亚群。 研究发现,恒河猴处于未感染状态时,CD32+CD4+T 细胞亚群在静息CD4+T 细胞中的比例低至(1.01±0.66)%,且在感染后的不同阶段虽略有升高但无显著差别(治疗前(2.28±1.37)%、治疗中(3.53±2.08)%、治疗后(3.04±1.17)% vs 未感染(1.01±0.66)%;P>0.05)(图2C)。 CD32+CD4+T 细胞亚群在活化 CD4+T 细胞中的比例较高((4.10±1.63)%),且在感染后治疗前(18.93±4.50)% vs (4.10±1.63)%、治疗中(32.05±14.17)% vs (4.10±1.63)%、治疗后(26.42±17.58)% vs (4.10±1.63)%三个阶段均具有显著性差异(P<0.01)(图2D)。
2.3 SIVmac239 潜伏感染恒河猴模型不同阶段CD32 在不同活化标记物CD4+T 细胞亚群的表达变化
活化型CD4+T 细胞又可细分为早期活化型(CD69+)、中间活化型(CD69+HLA-DR+)和晚期活化型(HLA-DR+)CD4+T 细胞。 根据 SIVmac239 潜伏感染恒河猴模型未感染、治疗前、治疗中及治疗后四个阶段的研究发现,同未感染状态相比,CD32在治疗前CD69+CD4+早期活化型T 细胞的比例显著增加((10.79±3.76)% vs (2.91±0.75)%),CD32 在治疗前((37.78±12.28)% vs (10.66±1.47)%)及治疗中((49.53±19.30)% vs (10.66±1.47)%)HLA-DR+CD4+晚期活化型T 细胞的比例显著增加(P<0.05,图 3A、3B)。 图 3C 为 CD32 在四个阶段的早期、中间和晚期活化型CD4+T 细胞的表达变化,结果显示早期活化型CD32+CD4+T 细胞的比例在感染后持续下降,晚期活化型CD32+CD4+T 细胞比例逐渐上升,中间活化型CD32+CD4+T 细胞的比例基本维持不变。
2.4 SIVmac239 感染前后CD32 在静息型或活化型记忆性CD4+T 细胞亚群中的表达变化
接下来,我们比较了病毒感染前后,即未感染组(第0 天取样)和感染组(第525 天取样),CD32分别在静息或活化状态下中心记忆T 细胞(TCM)、幼稚 T 细胞(T naive)、效应记忆 T 细胞(TEM)、终末分化T 细胞(TEMRA)等各记忆性T 细胞亚群的表达变化。 结果发现,在静息记忆性CD4+T 细胞亚群中,恒河猴在 SIVmac239 感染后,CD32 在静息TCM((0.74±0.57)% vs (0.47±0.44)%)、静息TEM((1.89±1.11)% vs (0.46±0.15)%)、静息Tnaive((0.17 ± 0.13)% vs (0.07 ± 0.07)%)、TEMRA((0.36±0.34)% vs (0.09±0.07)%)各记忆性T 细胞亚群均无显著性差异(P>0.05,图4A)。在活化的记忆性 CD4+T 细胞亚群中,CD32 在SIVmac239 感染后的活化型 Tnaive ((12.33 ±2.13)% vs (2.41 ± 0.72)%) 和 活 化 型 TEMRA((2.85±1.35)% vs (0.64±0.56)%)两个记忆性CD4+T 细胞亚群中的比例显著增加,但在活化型TCM((2.37±1.87)% vs (0.89±0.75%))和活化型TEM((1.33±1.09)% vs (0.37±0.31)%)两个亚群的比例无显著性差异(P>0.05,图4B)。
3 讨论

图1 SIVmac239 潜伏感染恒河猴模型血浆病毒载量、CD4+ T 细胞计数、CD4+/CD8+比值的动态变化Note. A, Dynamics of viral loads in SIVmac239-infected rhesus macaques with cART. B, Dynamics of viral loads and CD4+ T lymphocyte counts in SIVmac239-infected rhesus macaques with cART. C, Dynamics of viral loads and CD4+/CD8+ ratios in SIVmac239-infected rhesus macaques with cART.Figure 1 Dynamics of viral loads, CD4+ T lymphocyte counts and CD4+/CD8+ ratios in SIVmac239-infected rhesus macaques with cART
恒河猴感染SIVmac239 后,血浆病毒载量长期维持在较高水平,出现CD4/CD8 比值倒置、CD4+T细胞耗竭等现象;处于稳定慢性感染的恒河猴在cART 的治疗下,血浆病毒载量被完全抑制在检测线以下,CD4+T 细胞计数和CD4/CD8 比值逐渐恢复;但一经停药后,病毒载量在一周内出现反弹,再次呈现病毒血症。 由此, 本研究成功建立了SIVmac239 潜伏感染的恒河猴模型,实现了cART治疗有效地控制了病毒复制,并在停药后出现病毒反弹情况,这都与临床上艾滋病患者表现出的全病程类似[18]。
鉴于有文献报道CD32 在HIV 感染的静息CD4+T 细胞上高表达,被认为是可能的潜伏库标记物之一[10]。 本研究选取SIVmac239 潜伏感染恒河猴模型的未感染、治疗前、治疗中、治疗后的四个阶段,利用PBMC 分析在cART 抑制病毒复制的治疗期间,CD32能否在静息型CD4+T 细胞、尤其是静息型CD4+TCM细胞上高表达。 我们的结果发现恒河猴在感染后CD32 在静息状态的CD4+T 细胞中比例并未出现增加,却在活化状态的CD4+T 细胞中显著升高。 而且,CD32 的表达变化在cART 治疗的不同阶段没有显著性差异,提示CD32 的表达与cART 对病毒复制的抑制没有直接关系。 进而,通过我们对CD32 在早期活化型(CD69+)、中间活化型(CD69+HLA-DR+)和晚期活化型(HLA-DR+)CD4+T 细胞中的表达分析,发现晚期活化型CD4+T 细胞中CD32 表达显著增加,提示了HLA-DR+CD4+T 细胞是促成SIV 感染后CD32 表达上升的主要细胞亚群,推测CD32 可能是T 细胞晚期激活的标志之一,这与CD32,CD38,Ki67 等活化标志物共表达的结果相一致[14]。
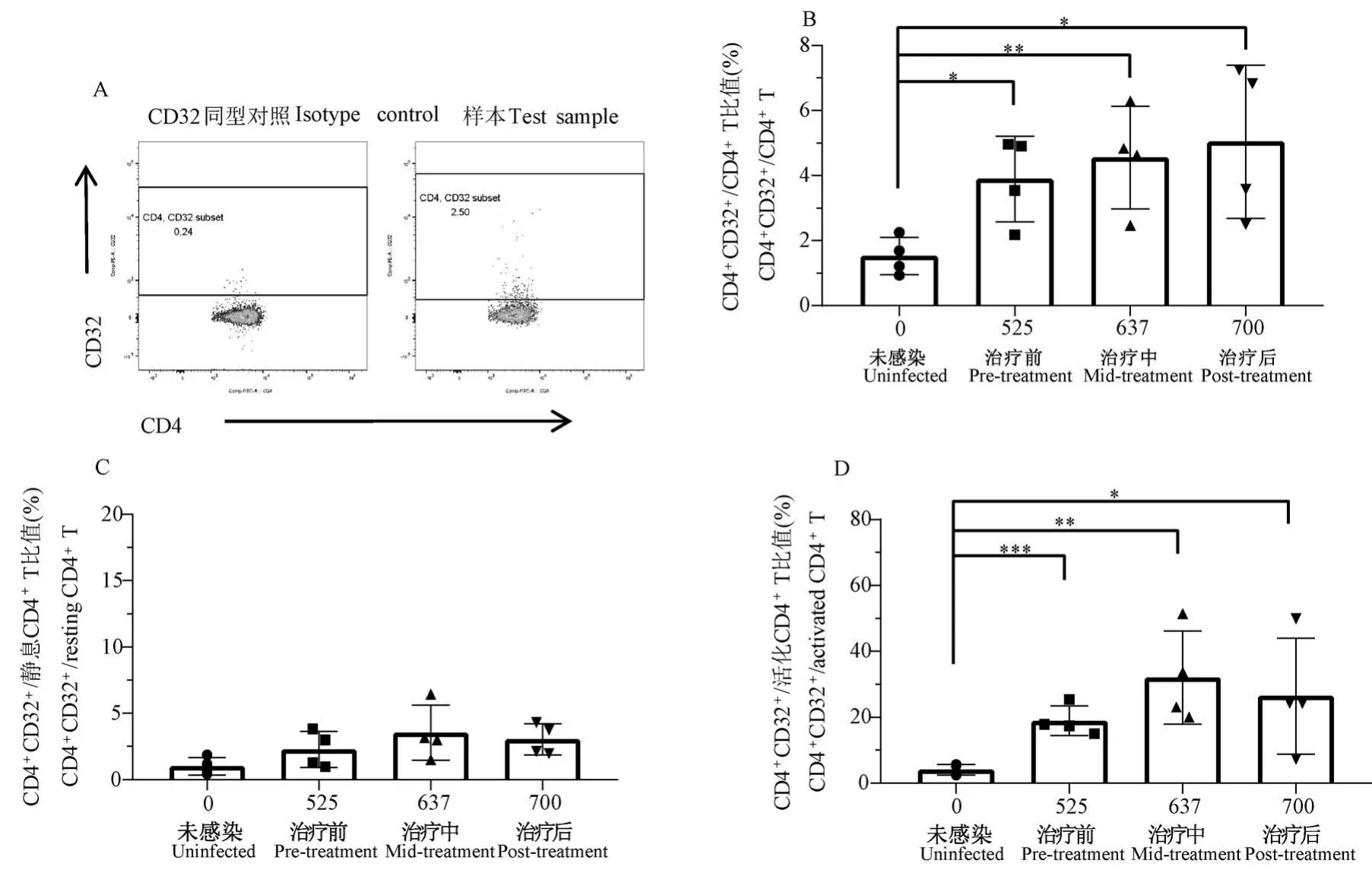
图2 SIVmac239 潜伏感染恒河猴模型各阶段CD32 在CD4+T 细胞亚群在的比例变化Note. A, Gating of CD32+CD4+ T cell subsets by flow cytometry. B, The percentage of CD32 expression in CD4+ T cells at the indicated stage of monkey model. Compared with uninfected group,the percentage of CD32 expression in CD4+ T cells in pre-treatment group, mid-treatment group and post-treatment group are significantly increased, *P < 0.05, **P < 0.01. C, Percentage of CD32 expression in resting CD4+ T cells (CD45+ CD3+ CD4+ HLA-DR- CD69- CD25-) at the indicated stage of monkey model. D,Percentage of CD32 expression in activated CD4+ T cells at the indicated stage of monkey model. Compared with uninfected group, the percentage of CD32 expression in activated CD4+ T cells in pre-treatment group, mid-treatment group and post-treatment group are significantly increased. *P<0.05, **P<0.01, ***P<0.001.Figure 2 Percentage of CD32 expression in CD4+ T-cell subsets at the indicated stage of monkey model
静息型CD4+T 细胞被认为是主要的HIV 细胞潜伏库[19],其中以静息型TCM 细胞更为重要[20]。我们的研究发现CD32 在静息或活化状态的CD4+TCM 细胞中均未有显著增加,而在活化型的CD4+Tnaive 细胞中比例上升,提示了CD32 可能与Tnaive细胞的免疫活化相关。 由于Tnaive 有干细胞的特性,具有高度分化能力[21],可以分化为TCM、TEM、Tfh、Th1、Th2 等细胞亚群,因此 CD32 在 SIV 感染后表达升高可能有助于促进Tnaive 细胞分化成其他免疫相关细胞。

图3 CD32 在SIVmac239 潜伏感染恒河猴模型各阶段处于不同活化状态的CD4+ T 细胞中的比例变化Note, A,The percentage of CD32 expression in CD69+CD4+ T cells at the indicated stages. Compared with uninfected group, the percentage of CD32 expression in CD69+CD4+ T cells in pre-treatment group are significantly increased, *P <0.05. B, The percentage of CD32 expression in HLA-DR+CD4+ T cells at the indicated stages. Compared with uninfected group, the percentage of CD32 expression in HLADR+CD4+ T cells in pre-treatment group and mid-treatment group are significantly increased, *P<0.05. C, The percentage of CD69+,CD69+HLA-DR+, and HLA-DR+ in CD32+CD4+ T cells at the indicated stages.Figure 3 Percentage of CD32 expression in CD69+, CD69+HLA-DR+, and HLA-DR+activated T-cell subsets at the indicated stages
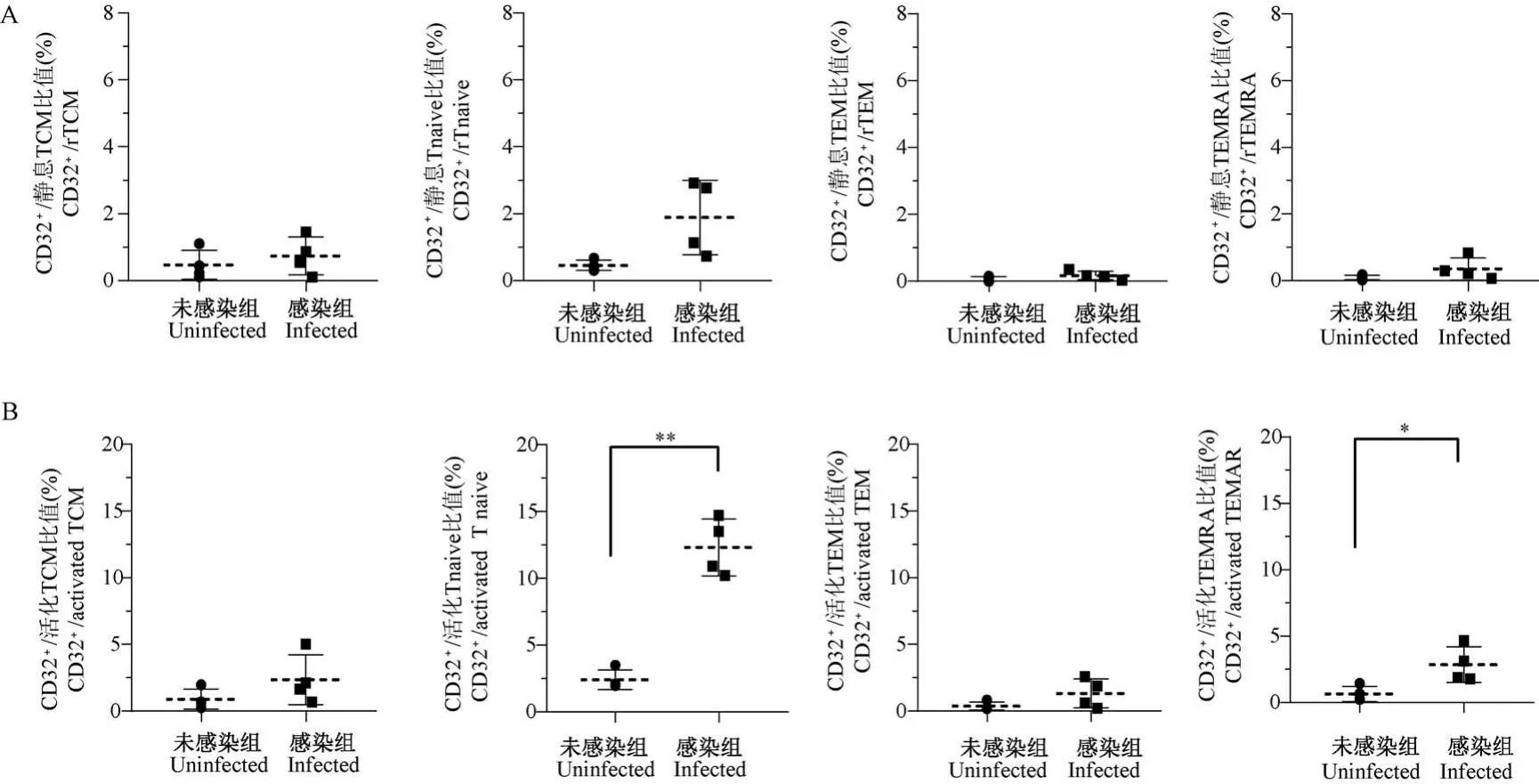
图4 CD32 在SIVmac239 感染前后记忆性CD4+ T 细胞亚群中的比例变化Note. A, The percentage of CD32 expression in resting TCM, Tnaive, TEM, and TEMRA at the pre- and post-infection stage. B, The percentage of CD32 expression in activated TCM,Tnaive,TEM,and TEMRA at the pre-and post-infection stage. Compared with uninfected group,the percentage of CD32 expression in activated Tnaive and TEMRA are significantly increased after infection, *P<0.05, **P<0.01.Figure 4 Percentage of CD32 expression in resting or activated memory CD4+ T cells at the pre- and post-infection stage
综上所述,我们的研究表明在SIVmac239 潜伏感染恒河猴模型中,CD32 与晚期活化型CD4+T 细胞和活化的Tnaive 细胞相关,与静息型CD4+T 细胞、静息型CD4+TCM 细胞无关。 这些为CD32 不是艾滋病潜伏库标记物这一观点提供数据支持,并为后续艾滋病治愈研究提供信息。
