亚基水平上大豆蛋白凝胶性的研究进展
2021-06-17付洪玲范宏亮单单单于寒松
付洪玲,范宏亮,吕 博,孙 贺,单单单,于寒松,
(1.吉林农业大学食品科学与工程学院,吉林长春 130118;2.国家大豆产业技术体系加工研究室,吉林长春 130118;3.东北农业大学食品学院,黑龙江哈尔滨 150030)
近年来,大豆以其“全蛋白质”成分,富含多不饱和脂肪酸和有益的生物活性成分而闻名[1]。随着人们对现代食品加工技术的要求以及消费者健康观念的转变,大豆蛋白被广泛用作食品加工原料,用来提高食品的高营养价值和改善产品质地特性[2],如大豆蛋白替代动物蛋白促进了混合蛋白产品的开发[3],或添加到烘焙食品中以提高产品的持水性,或利用其乳化性作为表面活性剂将其应用在冷冻食品中[4]。另外,大豆蛋白的功能特性也备受研究者的关注,比如大豆蛋白在降低胆固醇含量,降低高血脂和在心脑血管疾病中的功能作用已被证明[4-8]。
一直以来,大豆蛋白的凝胶性备受关注[9],主要表现为蛋白分子之间的交互作用,大豆蛋白质分子受热,结构展开,暴露出分子内部的疏水基团,并通过疏水相互作用、静电相互作用、氢键相互作用或者二硫键进行交联,形成空间网络结构[10]。很多国家已经对大豆蛋白的分子结构及凝胶特性进行了大量的研究,日本和加拿大已经开发出多种高凝胶型的大豆蛋白产品,而我国在专用大豆蛋白产品的研究上起步较晚,也多停留在通过改变处理条件改善加强其凝胶特性。
大豆蛋白亚基之间的解离缔合反应在凝胶受热变性过程中起决定性的作用[11]。有研究结果显示,β-伴大豆球蛋白(简称为7S球蛋白)和大豆球蛋白(简称为11S球蛋白)不同比例会影响产物的最终品质,这些可以通过育种来开发适用于不同类型食品加工的品种[1]。此外,不同的亚基组成也会对加工性能产生差异[12],Yamagishi等[13-14]研究大豆11S球蛋白的凝胶化过程,结果表明其酸性亚基的聚合会引发或加速大豆球蛋白的热凝胶形成。Milica等[15]对不同基因型大豆分离蛋白的亚基组成及其凝胶性进行系统研究,表明β亚基的基因型制备的凝胶显示出较低的弹性。Amir等[16]的研究表示大豆球蛋白亚基的类型也影响豆浆的聚集行为。目前并没有彻底的从亚基的角度系统的深入阐述凝胶化机理,这一难点将会成为大豆蛋白加工研究的重中之重。因此,研究亚基水平上大豆蛋白的凝胶特性对探索大豆蛋白凝胶形成体系具有极其重要的意义,为大豆蛋白产品的开发提供理论依据。
本综述基于大豆蛋白亚基组成对凝胶形成的影响,从蛋白组成、化学结构、以及亚基缺失类型大豆品种等方面对其凝胶特性的影响进行归纳总结,并分析了蛋白热聚集行为的图解描述,以期探究亚基组成对大豆蛋白凝胶体系的影响作用,为大豆蛋白功能性质的改善提供理论依据。
1 大豆蛋白的组成和化学结构
大豆在平均干物质的基础上含有40%左右的蛋白质和20%的脂肪[4,17]。经过低温脱脂,碱溶酸沉的方法获得大豆分离蛋白(Soy Protein Isolate,SPI)[18]。SPI是各种蛋白质的混合物,按照其沉降系数可分为2S(15%)、7S(34%)、11S(42%)和15S(9%)四种蛋白质类别[18-19]。7S球蛋白和11S球蛋白占70%以上[20],其也是影响大豆蛋白成分加工功能的两种主要大豆蛋白。尽管7S球蛋白和11S球蛋白的四级结构互不相同,但由于它们的氨基酸序列具有部分同源性且蛋白质水解模式有限,因此它们被认为是源自共同祖先基因,已经通过X射线晶体学证实了这种假设[21]。另外,根据研究表明,因为品种不同,大豆蛋白的7S/11S的比值范围在0.5~1.3之间,其加工特性表现出较大差异[22]。
7S球蛋白是一种三聚体糖蛋白(150~200 kDa),主要由α(72 kDa)、α′(76 kDa)和β(53 kDa)三种亚基组成。这三种亚基主要通过疏水相互作用力以不同的排列组合方式以平面三角形紧密堆积的形式形成7S球蛋白分子,Thanh[23]根据7S球蛋白及其亚基的分子量,将三种亚基随机组合分为B1,α′ββ;B2,αββ;B3,αα′β;B4,ααβ;B5,ααα′;B6,ααα这6种异构体形式,基于这些结构,还可分为3组分别为A组(B1和B2)每个7S分子含有两个β亚基,B组(B3和B4)含有一个β亚基,C组(B5和B6)不含β亚基,结构如图1所示,也有研究表明可能还存在βββ的类型[24]。

图1 β-伴大豆球蛋白及其六个异构体的亚基结构示意图[23]Fig.1 Schematic representation of the subunit structure of β-conglycinin and its six isomers[23]
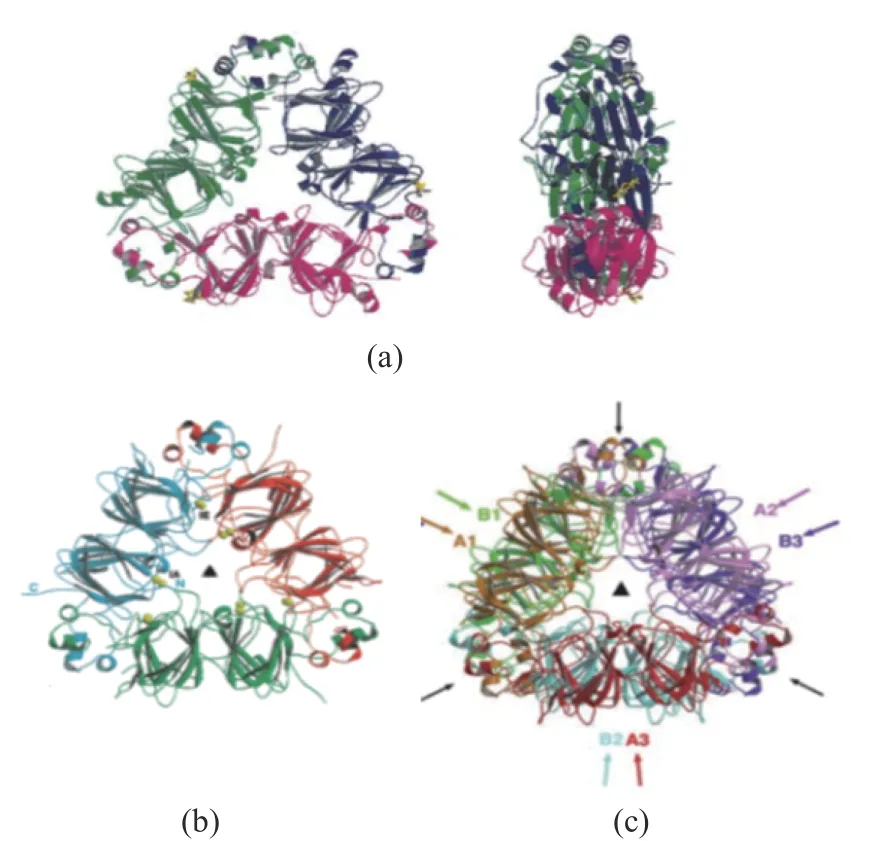
图2 大豆蛋白晶体结构图[26,28]Fig.2 The crystal structure of soy protein [26,28]
7S球蛋白亚基具有较高含量的天冬氨酸、谷氨酸、亮氨酸和精氨酸。α和α′亚基富含酸性氨基酸残基,在N-末端带有缬氨酸,而β亚基则富含碱性氨基酸残基(如赖氨酸和精氨酸)[10],在N-末端带有亮氨酸,因此赋予了不同的亚基结构性的差异[25]。Maruyama和Adachi[26-28]已经通过X射线晶体学描述出7S球蛋白的晶体结构图,如图2(a)所示为天然β-同源三聚体的带状模型,该同源三聚体的外径均约为96 Å,单体的每个模块细分为一个核心区域和一个环状结构域,该环状结构域包含多个α螺旋,从一对单体的任一侧伸出,形成与其他亚基相互作用的钩子。Utsumi和Maruyama发现该蛋白质主要由10%~15%的α-螺 旋,33%~39%的β-折 叠 和21%的β-转角组成,并且蛋白质的三个亚基通过疏水相互作用力、氢键和果冻卷型结构的盐桥结合在一起[26]。
每个11S球蛋白单体(300~380 kDa)由分子量约35 kDa的酸性亚基A(Acidic polypeptides,A)以及分子量约20 kDa的碱性亚基B(Basic polypeptides,B)在二硫键连接作用下组成[26]。有研究表明AB亚基通过静电相互作用和氢键相互作用联合形成两个空心圆柱体的六边形环[29-30]。Utsumi依靠11S球蛋白酸性亚基和碱性亚基的N-端氨基酸序列判断出五个主要的亚基:A1aB1b、A2B1a、A1bB2、A3B4和A5A4B3。并根据它们的氨基酸序列将不同的大豆球蛋白分类为I组由三个亚基A1aB1b、A1bB2、A2B1a组成,IIa组由A5A4B3组成,IIb组由A3B4亚基[31-32]组成。Adachi等[33]已经通过X射线晶体学描述出11S球蛋白前原蛋白A1aB1b和A3B4的三维晶体结构图,如图2(b)(c)所示,其研究结果表明,A1aB1b前原蛋白由两个类似果冻卷状的三聚体叠放组成,该结构通过氢键和离子桥连接在一起,但是疏水相互作用在六聚体的形成中可能起主要作用。A3B4前原蛋白由两个三聚体在链间二硫化物面上堆积成六聚体,并且还提出,存在移动的无序区域移至三聚体一侧的现象,并将六聚体解离为三聚体,从而抑制六聚体的形成。
2 大豆蛋白的凝胶性
凝胶能力是大豆蛋白的最重要属性之一,它赋予大豆蛋白较高的粘性、可塑性和弹性,在产品应用中既能做水的载体,也可做风味添加剂、糖及其他配合物的载体,这对食品加工极为有利[34]。其成胶方式很多,如热诱导[35]、加盐[36]、加酶等,均可使蛋白形成凝胶。凝胶性受多种因素的影响,例如:亚基组成、表面疏水性大小、巯基含量等,除此之外,蛋白质量浓度、加热温度、pH[37]、离子强度等[38]也是影响凝胶作用的重要元素。
2.1 7S球蛋白与11S球蛋白凝胶形成过程
由于大豆蛋白的复杂性,凝胶过程受众种因素制约,所以人们对其凝胶化过程知之甚少,Nakamura[39-40]提出了11S球蛋白的凝胶化机理:在较短时间内加热时(100 ℃加热约15 s),六个蛋白分子组成短链,每个链均展开但仍保持球形(链I),链I通过与自身结合,形成较长的直链(链II),链II与其自身和或与链I结合形成支链和非支链(链III),然后链III形成凝胶网络结构。其过程如图3所示。Guo等[41-42]通过小角度X射线散射和动态光散射分析了两种蛋白可溶和不可溶聚集体的结构,结果表明7S球蛋白可溶性的聚集体具有有限的尺寸和较不紧密的构象,11S球蛋白的不可溶聚集体具有较密的核心和较不致密的外壳颗粒,还表明,11S球蛋白的不溶性聚集体大小的增加会被7S球蛋白终止,可能是因为7S球蛋白与11S球蛋白的最不可溶的碱性多肽的互相作用[43],这提高了它的溶解度。因此提出了7S球蛋白在大豆蛋白热聚集中的作用如图4所示。
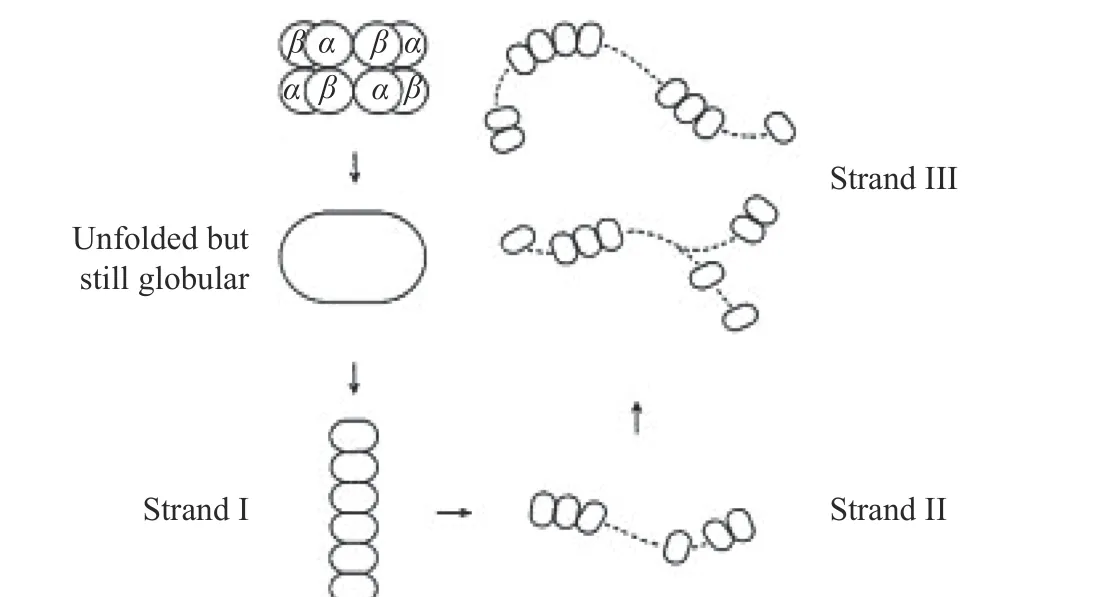
图3 大豆球蛋白凝胶化过程中可溶性聚集体的形成[39]Fig.3 Formation of soluble aggregates during the gelation of glycinin[39]
7S球蛋白和11S球蛋白在凝胶形成过程中相互作用机理,归纳总结如下:a.大豆蛋白溶液受热使蛋白分子解离成α、α′、β、以及酸性亚基A和碱性亚基B;b.当蛋白溶液进一步加热时,在解离的亚基中间因彼此互相作用形成了可溶性的肽链;c.在合适蛋白浓度下,β亚基与碱性亚基B相互作用产生沉淀,由α、α′亚基与酸性亚基A相互作用形成的寡聚体集中在上清液中。然而,7S球蛋白和11S球蛋白对凝胶网络的形成,所做的贡献是不同的[12,44]。通过差示扫描量热法(Differential Scanning Calorimetry,DSC)分析,得到7S球蛋白的变性温度为74 ℃,11S球蛋白的变性温度为90 ℃[45]。有研究表明,单独加热两组分时,发现7S球蛋白不会生成凝胶(浓度原因)或形成透明柔软的凝胶[32,45],而11S球蛋白则会形成坚硬和具有较高粘弹性的凝胶,这主要是因为在11S球蛋白凝胶形成的过程中产生较多的二硫键[41]。Nakamura等[46]研究发现保证7S球蛋白和11S球蛋白凝胶形成的最低蛋白浓度分别为7.5%与2.5%,而且随着7S球蛋白的比例加大,大豆蛋白的凝胶硬度降低。因此,可以通过增加11S球蛋白的量或11S球蛋白与7S球蛋白的比例来增加凝胶的储能模量,从而改善凝胶质量。并且有研究表明,在11S球蛋白较低浓度条件下,7S球蛋白对其热聚集产生抑制作用[41,47]。Jacoba 等[45]研究了pH对大豆蛋白热变性和凝胶形成特性的影响,结果表明,pH为7.6时,SPI凝胶体系中7S球蛋白的作用似乎不太重要,造成这种现象的原因可能是在7S球蛋白受热变性开始时并没有出现凝胶的大量形成,并且在加热过程中,由11S球蛋白的酸性多肽和碱性多肽之间形成的二硫键被破坏了。综上所述,大豆分离蛋白凝胶是一个极其复杂的系统,凝胶过程中受到众多要素的影响,因此,在选用具有特殊蛋白组分的专用大豆品种进行蛋白质加工研究是今后发展的趋势之一。
2.2 亚基组成对凝胶性的影响
亚基组成作为打开大豆蛋白构效关系的一把“钥匙”,可以很好地解释大豆蛋白的许多功能特性[48]。陈海敏等[49]研究品种差异对大豆蛋白功能性的影响,研究发现11S球蛋白含量越高,大豆蛋白凝胶特性越好,随着7S/11S比例越大,凝胶的硬度和粘度越低。袁德保[50]对大豆蛋白热聚集行为及其机理进行研究,探讨了α、α′、β与碱性亚基组合体系的热聚集行为,并提出了各亚基相互作用及机制,结果显示,α、α′和β亚基都对蛋白的热聚集反应起到抑制作用,但是α、α′亚基抑制效果强于β亚基。因此,研究大豆蛋白特定亚基与其功能特性关系是大豆蛋白加工的新领域。
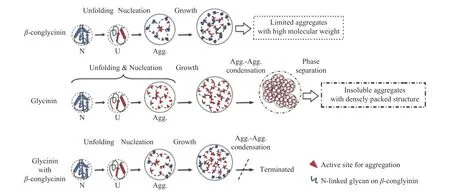
图4 在pH7.0下7S球蛋白和11S球蛋白的热聚集行为的图解描述[41-42]Fig.4 Diagrammatic depiction of thermal aggregation behavior of β-conglycinin and glycinin at pH 7.0 [41-42]
2.2.1α、α′对凝胶性的影响 因7S球蛋白的α′亚基(76 kDa)与α亚基(72 kDa)分子质量极其相似,研究者们多将其作为一个研究对象。在α′与α亚基对大豆蛋白的凝胶特性的影响研究中,表示出显著相关。张国敏[51]研究亚基缺失对其蛋白质功能性评价中表明,蛋白凝胶硬度与α亚基含量呈负相关关系,与α′亚基含量呈正相关关系。Salleh等[52]探讨了α及α′亚基缺失对大豆蛋白凝胶性的影响,表明在相同的试验条件下,亚基组成对凝胶硬度的影响依次是α′亚基缺失、7S全亚基、α亚基缺失,并通过扫描电子显微镜结果推测形成的原因可能是当亚基缺失时,蛋白质部分厚度产生差异导致/引起形成的凝胶网状结构密度有所不同。周宇锋[53]对河南省16个大豆品种的亚基含量与豆腐的质构特征进行相关性分析,表明蛋白凝胶的硬度、弹性、黏聚性和回复性与α′亚基含量呈极显著负相关,凝胶硬度与α亚基含量密切相关且呈现极显著负相关。Wang等[54]根据豆腐质量评价模型推断出α亚基、11S球蛋白等可预测豆腐的质量,为产生理想的大豆品种提供指导,以生产优质的食用豆腐。
2.2.2β亚基对凝胶性的影响 张国敏[51]的研究表明大豆分离蛋白凝胶硬度与7S球蛋白的β亚基含量呈负相关。王显生等[55]却表示蛋白凝胶硬度与β亚基呈正相关,这种差异的原因可能是试验材料与实验条件存在不同。周宇锋[53]的研究表明7S球蛋白的β亚基含量与豆腐黏聚性指标呈极显著正相关。孟岩[56]以缺少或缺失β亚基的大豆为原材料,探讨了β亚基对大豆加工特性的影响,结果表明,当7S球蛋白中的β亚基含量增加时,豆腐的硬度、粘弹性等质构特性皆下降,针对不同品种SPI的功能特性进行检测,研究结果表明,β亚基缺失的品种凝胶质构特性较差,因此,证明β亚基在大豆的加工过程中对蛋白质存在形态和凝胶空间网络结构的形成起着极其重要的作用。
2.2.3 11S球蛋白组分对凝胶性的影响 11S球蛋白中的酸性亚基A和碱性亚基B对大豆蛋白凝胶特性有着重要的影响。对于豆浆而言,11S球蛋白I组(含A1,A2亚基)的样品比不含I组的样品含有更多的颗粒。在豆腐体系中,无论凝结剂如何,与IIa组相比,I组和IIb组(包含A3)形成了更坚硬的凝胶,而IIa(A4)亚基与豆腐的质量呈负相关[32,57]。Poysa[32]研究表示具有I组(A1,A2)亚基的大豆所产生的豆腐的质地特性比不含I组亚基的大豆制备的豆腐高约三分之一(以Harovinton′s值表示),还表示A1对GDL豆腐质量产生负面影响,A2产生正面影响。因此,11S球蛋白的亚基组成对豆腐的凝胶性起着重要的作用,这与石彦国[58]总结的结果保持一致。在大豆蛋白形成凝胶时,11S球蛋白的碱性亚基B与7S球蛋白的β亚基进行交互作用,11S球蛋白中的酸性亚基A和7S球蛋白中的α、α′亚基相互作用,对SPI的凝胶性起主要作用[59-60]。Fukushima等[61]的研究结果表明对大豆分离蛋白凝胶形成速率以及其透明度起主要作用的是A5A4B3亚基,而A3B4亚基与大豆蛋白凝胶的硬度有着密切的关系,A3亚基的缺失可能提高了凝胶硬度,这与豆腐体系结果有所不同,这个差异也表明对酸诱导和热诱导凝胶的机理缺乏了解。张国敏[51]的研究表明大豆分离蛋白的凝胶硬度与酸性亚基A的含量呈现正相关关系,与碱性亚基B含量呈负相关。王显生等[55]却表示,蛋白的凝胶硬度与A3、B4两个亚基均显示正相关,与其他酸性亚基、碱性亚基呈负相关,这种差异的原因可能是试验所用材料条件的不同。Bainy等[1]研究大豆11S球蛋白中亚基组成与大豆蛋白凝胶强度的关系,结果表明大豆蛋白的凝胶强度从大到小依次是:大豆蛋白、Ⅰ和Ⅱa亚基缺失型、Ⅰ和Ⅱb亚基缺失型、Ⅱa亚基缺失型、Ⅱa和Ⅱb亚基缺失型、Ⅰ亚基缺失型、Ⅱb亚基缺失型。此外,亚基组成的差异也会影响网络结构,Bainy等[1]在蛋白质亚基组成对大豆分离蛋白的凝胶特性的的影响研究中表示11S球蛋白的A3亚基的存在阻碍了凝胶网状结构的发展。
3 蛋白亚基缺失型的研究进展
随着大豆蛋白亚基组成与其加工特性研究的不断深入,研究者已经将重点逐渐转移到通过育种方法改变蛋白亚基的组成,从而获得某亚基缺失的大豆品种,使之成为特定加工特性的专用大豆原材料,为大豆产品的开发提供便利。在本方面的研究,国外的科学家走在前列,我国在亚基组成对大豆加工特性影响的报道较少,在大豆亚基缺失型品种的创新上也比较落后,但是发展的速度却比较迅猛,并创制出具有中国遗传背景的亚基缺失型大豆品系,为我国大豆产品开发提供重要的材料。表1是国内外关于亚基缺失型大豆品种的研究进展。
为了验证亚基缺失对大豆蛋白加工特性的影响,国内外的专家也做了很多研究。Salleh等[52]研究表明因亚基缺失导致蛋白凝胶硬度产生差异。Kawamura[70]为了阐明大豆蛋白中11S球蛋白的酸性亚基A5对凝胶特性的影响,通过动态粘弹性测量研究了豆浆的凝胶化过程,发现A5亚基缺失品种制备的豆腐凝胶更坚硬。Tosh[1]表明缺少A3亚基和11S组分的A1、A2和A4亚基的组合可能形成了较硬的凝胶结构。Amir[71]表示当大豆中不含大豆球蛋白或缺乏大豆球蛋白的I组(A1,A2)时,豆浆显示出较小的粒度分布,并且加热后,IIa和IIb组的溶液比I组溶液具有更多的颗粒蛋白质。刘春等[55]以A3B4亚基缺失、A1aA1b亚基缺失、A5A4B3亚基缺失、M11SR(11S含量极低)的SPI和南农大黄豆粗7S蛋白为原料,对大豆蛋白功能特征进行评价,结果表明:11S球蛋白中单个亚基缺失对蛋白乳化特性和乳化稳定性无显著影响,11S球蛋白的含量减少或缺失显著提高大豆分离蛋白的乳化特性和乳化稳定性,同时凝胶特性测定结果表明,7S球蛋白含量与大豆分离蛋白凝胶粘弹性呈显著正相关,11S球蛋白含量则与蛋白凝胶粘弹性之间呈现极显著负相关,与蛋白凝胶硬度和破裂强度之间呈显著正相关。Li等[72]表示SPI的亚基变化,尤其是11S球蛋白亚基含量的下降,可以较好地反映SPI的预热诱导凝胶变性程度。综上所述,不同亚基构成对凝胶特性的影响是不尽相同的,因11S球蛋白的亚基组成比7S球蛋白复杂,所以需要更系统的研究其凝胶体系的形成机理,从而剖析亚基在凝胶形成过程中的作用机制。因此,明确单个亚基对加工特性的贡献,对大豆蛋白产品的生产及应用有更重要的意义。
改变大豆蛋白的亚基组成不仅可以影响其加工特性,还可以直接影响其营养特性。拓云等[73]对两个致敏蛋白α亚基缺失型大豆分离蛋白氨基酸的营养价值进行评价,探讨α亚基缺失型大豆的氨基酸组成特征以及其营养指标,结果表明,当α亚基缺失时,其氨基酸总量(TAA)、必需氨基酸总量(TEAA)、蛋白质、脂肪含量未发生变化,另外,其必需氨基酸含量接近或高于FAO/WHO标准,证明了α亚基缺失时大豆蛋白氨基酸组成平衡,11S/7S比值更优,营养品质更高。国博闻等[74]对具有中国大豆遗传背景的7S球蛋白与11S球蛋白多亚基缺失型大豆新品系进行氨基酸组成分析,结果表明,当7S球蛋白与11S球蛋白多个亚基缺失时,既可以有效的去除致敏蛋白,也可以改善其氨基酸的组成及特征,优化氨基酸之间的最优比。因此,选择特定的大豆品种进行加工,既可以改善产品质量,也可以提高其营养价值。
虽然亚基组成直接影响大豆蛋白的加工特性与营养特性,但是其具体作用机理还不是很明确。因此,从大豆蛋白亚基组成的方向分析其功能特性,对我国丰硕的大豆品种资源开发,确立专用特性、专用品种的加工研发具有深远的意义。

表1 亚基缺失型大豆品种Table 1 Subunit- deficiency soybean varieties
4 前景与展望
大豆蛋白虽然是最重要的植物蛋白,但是其结构复杂,各个组分分别决定着不同的特性,因此,基于结构与性质的关系,大豆蛋白亚基缺失型的特性研究成为目前的一个研究热点。亚基组成在一定程度上影响豆制品的加工特性、品质与应用范围,因此,掌握亚基组成对加工特性的影响机理,有利于实现国家大豆产业技术体系“专一产品,专用品种”的行业趋势。近年来,开展这项工作的主要是日本和加拿大的研究者,其研究热点主要集中在合适豆腐加工的特殊品种和11S球蛋白亚基缺失类型品种的加工特性上,其研究体系以单组分为主,故需要确立在混合体系中亚基组成对其影响。另外,国内外多数研究主要集中在乳化性和凝胶性上,对其他加工特性如溶解性、起泡性等的研究并未完善,所以其他加工特性的研究还需更深更广的展开。而亚基组成对酶制凝胶和冷凝胶的影响尚未明确,仍需进一步探讨研究。因此,有目的性的选用具有特殊蛋白亚基或组分的专用大豆品种进行蛋白质加工研究,可以为大豆蛋白产品的开发和应用提供重要的理论指导。
