外泌体介导miR-106a靶向Smad7调控间皮细胞MMT对胃癌腹膜转移的影响
2021-06-17朱萌,张宁,陶伟
朱 萌,张 宁,陶 伟
腹膜转移是进展期胃癌最常见的转移方式。关于腹膜转移,目前推测胃癌细胞、腹膜屏障之间的沟通与“对话”是形成移植瘤的关键,而在此之间起着传递“对话”作用的外泌体可能具有非常重要的作用。外泌体是一种细胞外物质,由肿瘤细胞分泌的外泌体称为肿瘤源性外泌体(tumor-derived exosomes, TDEs),在其生成和释放过程中可以携带原发肿瘤重要信息物质miRNA,随外泌体以旁分泌的方式扩散到周围细胞或环境中,或经循环系统运输至远隔器官,目的性地调整受体细胞的信号转导,参与并促进癌组织的侵袭、转移[1-2]。然而,外泌体是否参与胃癌的腹膜转移,外泌体在其中发挥的作用及机制,尚未有统一认识。腹膜是癌细胞种植的场所,但癌细胞如何改造或调整以使其适宜于自身的种植尚有待于阐明。随着外泌体研究不断深入,证实胃癌细胞分泌的TDEs高表达miR-106a,TDEs搭载miR-106a进入腹腔,在miR-106a与靶标的作用下引发腹膜屏障损坏,腹膜间皮细胞形态与功能发生改变,有可能参与腹膜转移的过程[3]。本实验基于以上理论,拟在分子水平探讨TDEs-miR-106a-Smad7参与胃癌腹膜转移的可能机制。
1 材料与方法
1.1 主要材料、设备细胞培养:RPMI-1640培养基(Hyclone公司),胎牛血清(Gibco公司),青链霉素,胰蛋白酶(Genview公司)。转染:Lipofectamin 2000(Invitrogen公司),hsa-miR-106a mimic(Genepharma公司)。试剂盒:外泌体提取试剂盒(Invitrogen公司),EdU检测试剂盒(Ribobio公司)。其它试剂:Transwell小室(Costor公司),GW788388 Hydrate(Sigma公司),Recombinant Human TGF-β Protein(Sigma公司)。Western blot抗体:Smad7兔多克隆抗体(Proteinteck公司),SMA兔多克隆抗体(SAB公司),Fibronectin兔多克隆抗体(Abcam公司),E-cadherin、N-cadherin兔多克隆抗体(Immunoway公司)。
1.2 外泌体提取培养高转移能力人胃癌细胞系AGS,无血清培养基处理2天后,吸取细胞上清液置于离心管内,2 000 r/min离心20 min,采用微孔滤膜过滤,按1 ∶2比例加入外泌体提取试剂至细胞上清液中,颠倒混匀;4 ℃过夜;次日4 ℃ 10 000g离心1 h,弃上清,PBS重悬,获得PBS-Exos。
1.3 细胞造模实验分组:(1)HMrSV5、HMrSV5+Exos-control、HMrSV5+Exos-NC、HMrSV5+Exos-mimic;(2)HMrSV5、HMrSV5+Exos-TGF-β、HMrSV5+Exos-GW788388;(3)HMrSV5+TGF-β+Exos+OE-NC、HMrSV5+TGF-β+Exos+OE-Smad7。将获得的PBS-Exos(8 μg)与HMrSV5细胞共培养48 h,分别加入miRNA mimic转染试剂、10 ng/mL TGF-β、10 μmol/L TGF-β抑制剂GW788388、过表达质粒pCMV-Smad7。
1.4 细胞转染取生长至80%的细胞,PBS洗涤2次,加入胰蛋白酶消化液,制备单细胞悬液;按每毫升5×105个接种6孔培养板,37 ℃、5%CO2常规培养过夜;次日制备转染溶液:250 μL MEM中加入5 μL miRNA,柔和混匀;250 μL MEM中加入5 μL Lipofectamine 2000,柔和混匀;放置5 min后将两者混合,再放置20 min,形成RNA/Lipofectamine 2000复合物;加入细胞板中,继续孵育4 h,更换完全培养基,培养48 h,进行后续实验。
1.5 EdU检测细胞增殖能力取上述处理后的细胞,消化离心后置于96孔板,每孔加入100 μL浓度为50 μmol/L EdU培养基孵育2 h,PBS洗涤2次,每次5 min;加入50 μL 4%多聚甲醛室温固定30 min;按顺序加入2 mg/mL甘氨酸溶液50 μL,0.5%TritonX-100渗透液100 μL,1×Apollo染色液100 μL,0.5%TritonX-100渗透液100 μL,甲醇溶液100 μL,PBS洗涤;加入1×Hoechst 33342反应液100 μL,室温避光孵育30 min,PBS洗涤,Leica DMI6000B倒置显微镜观察拍照。每组3个复孔。
1.6 Western blot法检测蛋白表达取6孔板中常规培养的HMrSV5细胞,PBS洗涤后加入PMSF裂解液(稀释比1 ∶100),将细胞裂解液吸入EP管,4 ℃ 14 000 r/min离心10 min。取蛋白行BCA法定量,并绘制标准曲线。SDS-PAGE凝胶电泳分离蛋白,蛋白上样量为20 μg,电泳耗时1.5 h。然后转膜至PVDF膜,电流300 mA。取出TBS漂洗,5%脱脂奶粉-TBS封闭,4 ℃摇床过夜。次日取出TBS洗膜,加一抗Smad7(稀释比1 ∶1 000)、SMA(稀释比1 ∶2 000)、Fibronectin(稀释比1 ∶1 000)、E-cadherin(稀释比1 ∶1 000)、N-cadherin(稀释比1 ∶1 000)、GAPDH(稀释比1 ∶10 000)室温孵育1 h,TBST洗涤,加HRP标记山羊抗兔二抗IgG,TBST洗涤,ECL化学发光,凝胶图像分析。
1.7 Transwell实验检测细胞迁移HMrSV5细胞无血清培养基培养12 h,按每毫升2×105个细胞100 μL加入24孔培养板中的Transwell小室,下室加入700 μL含有10%FBS的完全培养基,常规培养48 h;取出刮取小室上层细胞,PBS洗涤后,4%多聚甲醛固定20 min,置入结晶紫染色液中5 min,流水冲洗,封固,OLYMPUS CX41正置显微镜取6个互不重叠视野,用IPP软件进行细胞计数。
2 结果
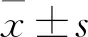
2.1 胃癌细胞分泌外泌体传递miR-106a对间皮细胞增殖的影响采用胃癌细胞系AGS来源的外泌体,作用于腹膜间皮细胞HMrSV5,观察间皮细胞在外泌体miR-106a作用下的表型改变。EdU检测结果显示,与Control组相比,Exos-control与Exos-mimic组阳性着色细胞数减少(图1),且以后者为甚,初步表明腹膜间皮细胞在AGS-Exos的作用下增殖活力减弱,外泌体传递miR-106a具有抑制腹膜间皮增殖的能力。
ControlExos-controlExos-mimic
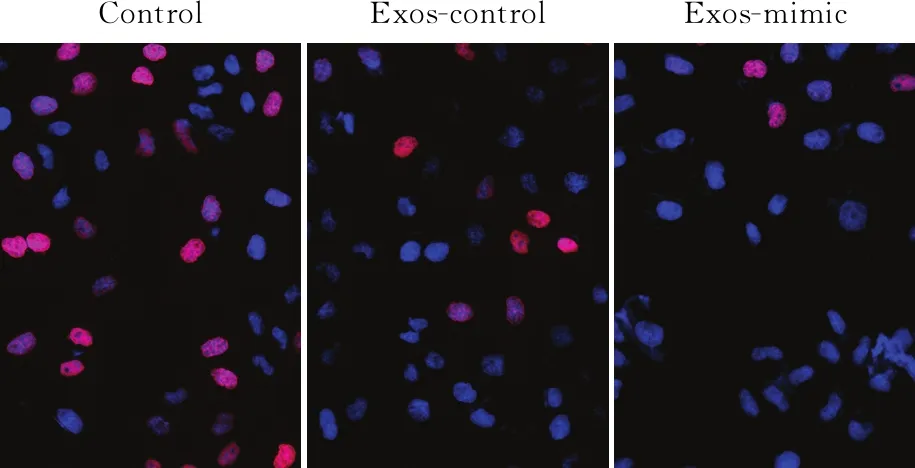
2.2 外泌体介导miR-106a-Smad7对间皮细胞间质性转化(mesothelial-to-mesenchymal transition, MMT)的影响前期已经证实miR-106a直接靶基因Smad7,为进一步分析外泌体作用下间皮细胞的基因表达,采用Western blot法检测Smad7及相关蛋白表达,结果显示,HMrSV5细胞在给予外泌体处理后,Smad7、E-cadherin表达下降,N-cadherin表达升高(图2),四组间相比差异均有统计学意义(FSmad7=228.420,FE-cadherin=118.699,FN-cadherin=461.912,P均<0.000 1)。提示miR-106a-Smad7在外泌体作用下可能影响间皮细胞MMT。
图2 Western blot法检测Smad7、E-cadherin、N-cadherin的表达:
2.3 TGF-β干预对间皮细胞增殖、MMT的影响TGF-β是细胞MMT转化的关键信号分子。给予TGF-β抑制剂GW788388后,EdU检测HMrSV5细胞增殖活力的变化,结果显示,与Control组相比,给予Exos-TGF-β处理后,HMrSV5细胞增殖活力下降,但给予Exos-GW788388后,细胞增殖活力有所恢复(图3),说明TGF-β诱导的信号可能参与间皮细胞表型的改变。Western blot法检测显示,Exos-TGF-β处理后,SMA、Fibronectin表达升高;但当给予Exos-GW788388后,SMA、Fibronectin表达降低(图4),三组差异均有统计学意义(FSMA=61.449,FFibronectin=665.186,P均<0.000 1);提示间皮细胞表型和MMT的改变可能是TGF-β信号所诱导。
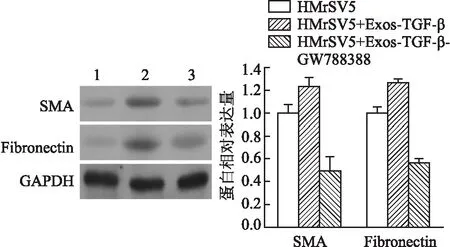
图4 Western blot法检测SMA、Fibronectin的表达:1.HMrSV5;2.HMrSV5+Exos-TGF-β;3.HMrSV5+Exos-TGF-β-GW788388
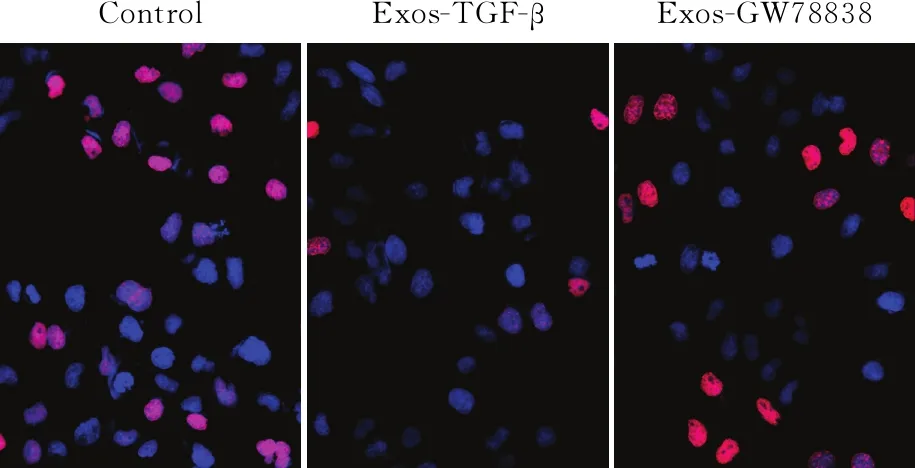
ControlExos-TGF-βExos-GW78838
2.4 Smad7过表达逆向观察间皮细胞MMT及迁移能力AGS-Exos与pCMV-Smad7共同作用于HMrSV5细胞,再用TGF-β处理,逆向观察靶基因的表达改变能否影响TGF-β/Smad7信号通路和间皮细胞表型。采用Western blot法检测MMT相关蛋白表达,结果显示,Smad7过表达组SMA、Fibronectin表达下降(图5),两组相比差异均有统计学意义(tSMA=7.772,P=0.001;tFibronectin=13.194,P<0.000 1)。Transwell实验检测显示,给予Smad7过表达后,HMrSV5迁移能力下降,穿膜细胞数显著低于对照组(图6),差异有统计学意义(t=20.094,P<0.000 1),表明Smad7的过表达可以抑制外泌体介导的间皮细胞MMT。
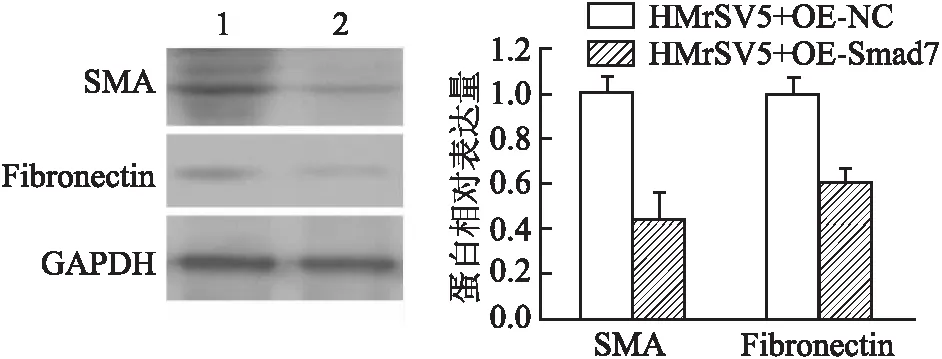
图5 Western blot法检测SMA、Fibronectin表达:1.HMrSV5+TGF-β+Exos+OE-NC;2.HMrSV5+TGF-β+Exos+OE-Smad7
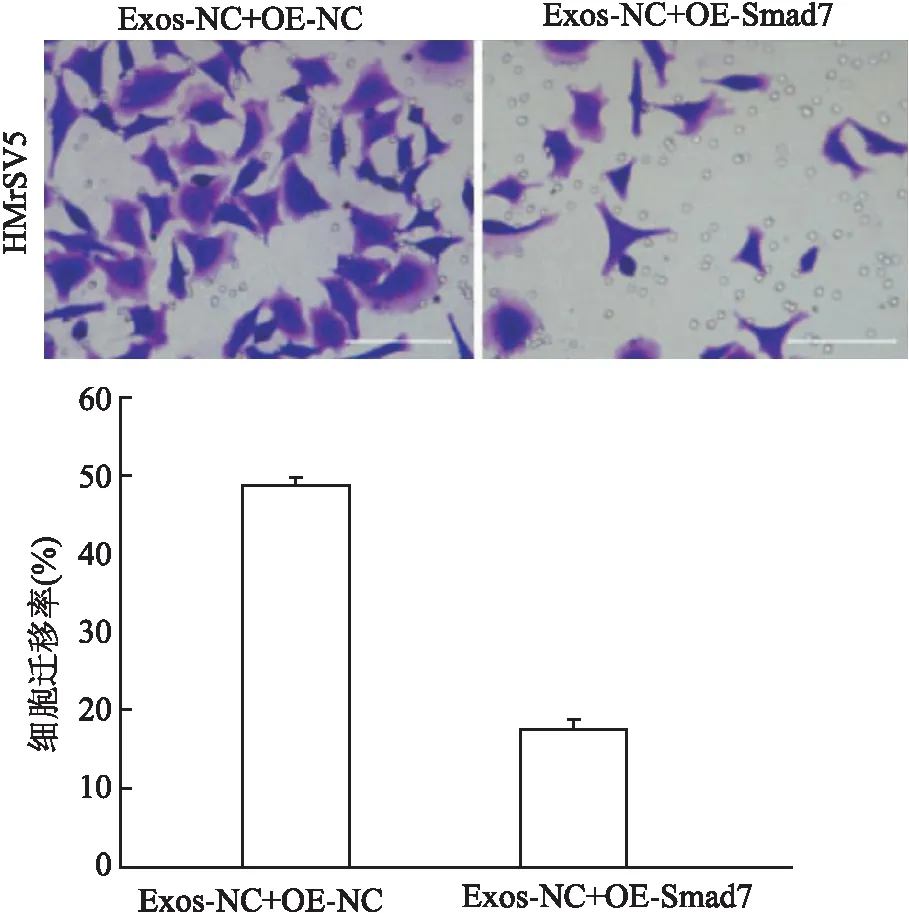
图6 Transwell实验检测细胞的迁移能力
3 讨论
外泌体是由细胞所分泌的小的细胞器,富含选定的蛋白、脂类、核酸和糖复合物。在其生物发生过程中,通过质膜内陷和出芽释放,具有重塑细胞外基质、传递信号、调控生命活动等作用,在人体发育、免疫、内稳态、肿瘤等疾病中发挥重要作用[4]。研究显示,核酸类物质由外泌体在宿主细胞和受体细胞之间的传递可能影响了肿瘤细胞的生物学进程,包括转移等,如三阴型乳腺癌细胞外泌体在乏氧条件下通过传递miR-221/222基因簇促进癌细胞上皮-间质转化(epithelial-mesenchymal transition, EMT),迁移和侵袭能力加强[5]。巨噬细胞源性外泌体包裹miR-223对胃癌细胞转移的影响在于靶向PTEN激活PI3K/AKT信号通路促进癌的侵袭[6]。本组前期实验亦发现,胃癌中特异性表达的miR-106a富集于外泌体中,胃癌细胞源性外泌体包裹miR-106a可能与癌的腹膜转移相关[3],但是对于TDEs-miR-106a-靶标模式如何调控腹膜转移以及参与腹膜转移的哪一方面尚未完全阐明。
胃癌腹膜转移是一种器官特异性的转移方式。腹膜微环境的构建是打造适宜于肿瘤细胞种植的必要前提[7]。而肿瘤细胞可分泌外泌体,一定程度上充当了先锋或可以对腹膜局部微环境的构建起一定的促成作用。腹膜是一层由表层的间皮构成的屏障,生理上起着阻隔癌或其它感染源侵入的作用,但如果这种刺激长期存在就有可能使间皮细胞发生转化,如长期腹膜透析的慢性肾脏病患者腹膜纤维化的发生就是由于间皮细胞的EMT[8]。目前,肿瘤转移对间皮的影响尚未有详细的报道。有限的研究显示,间皮细胞MMT对间皮完整性的破坏、增殖凋亡紊乱、间质性转化的调控和诱导作用参与肿瘤转移前微环境的构建[9-10]。Li等[11]报道外泌体miR-21-5p自胃癌细胞分泌后,被人腹膜间皮细胞内化,MGC-803、SGC-7901外泌体均可以导致间皮迁移能力增强,miR-21 mimic促进该作用,inhibitor抑制该作用,且间皮细胞MMT导致裸鼠腹膜转移灶的增大。本实验采用人胃腺癌细胞系AGS富集外泌体,作用于间皮细胞HMrSV5,初步表明TDEs-miR-106a促进间皮细胞表型改变,表现为细胞增殖活力减弱。关于间皮细胞MMT的研究,文献报道高转移能力肝癌细胞分泌外泌体miR-1247靶向B4GALT3激活NF-κB通路,促使肺正常纤维细胞转化为肿瘤相关成纤维细胞(carcinoma-associated fibroblasts, CAFs),活化的CAFs进一步分泌细胞因子IL-6/8促进肿瘤生长,形成肺转移灶[12]。本实验在TDEs-miR-106a的作用下,检测miR-106a靶基因及MMT相关蛋白表达,发现Smad7表达的同时伴随上皮性标志物E-cadherin和间质性标志物N-cadherin表达异常。可见,外泌体影响肿瘤转移的过程应包含传递miR-106a诱导间皮间质化的步骤。
Smad7是TGF-β/Smad信号通路的抑制因子,参与TGF-β应答反应的负反馈调节[13]。为验证TDEs-miR-106a是否通过该靶点对间皮细胞产生功能调控作用,本实验采用TGF-β干预检测间皮细胞表型、功能和MMT蛋白表达,结果显示:TGF-β明显减弱HMrSV5细胞增殖活力,并促使间质标志物SMA、Fibronectin表达升高,说明TGF-β信号参与调控腹膜间皮细胞表型。以上作用在合并外泌体TGF-β抑制剂处理后,可见部分恢复HMrSV5细胞的增殖和MMT转化。此外,从逆向思维证实,Smad7的过表达也使得间质性标志物SMA、Fibronectin表达下降,间皮的迁移能力减弱,部分逆转了间皮在TDEs-miR-106a作用下所发生的表型和MMT改变。进一步说明外泌体介导miR-106a靶向Smad7调控间皮细胞MMT,参与腹膜转移的过程。
肿瘤转移是肿瘤性疾病发展到顶峰的极盛状态。外泌体实验结果初步证实其作为一种必要的介质为胃癌细胞和腹膜之间的“对话”搭建了桥梁,有可能在一定程度上促成了种植反应。本实验结果表明,TDEs-miR-106a-Smad7的构成模式可能通过调控间皮细胞MMT,参与促进胃癌腹膜转移。
