hnRNPA3通过影响mRNA出核调控hESCs多能性
2021-06-17杨嘉宾陈仲扬周凡琦马艳妮
杨嘉宾,陈仲扬,周凡琦,余 佳,马艳妮
(中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室 北京 100005)
人胚胎干细胞(human embryonic stem cells,hESCs)是研究早期胚胎发育的细胞模型。hESCs从囊胚期的内细胞团分离而来,在体外可无限增殖并可分化成各种不同类型的体细胞[1],因而具有极其重要的研究和临床应用价值。hESCs中基因表达调控在多层次之间存在复杂相互作用,其自我更新调控机制在转录水平得到了广泛而复杂的描述[2],但是缺乏对RNA运输等转录后水平的了解。
真核生物在进化上区别于原核生物的特点之一是有核膜包被的细胞核,因此mRNA运输是调节哺乳动物基因表达途径中潜在的重要节点。多种生物过程包括DNA修复、基因表达、应激反应、细胞增殖、细胞存活和造血细胞分化都可以通过mRNA的选择性出核来调控[3]。在经典的mRNA运输途径中,mRNA加工完成后会募集出核相关蛋白,形成具有出核能力的mRNP,与核孔蛋白进行对接,交换信息后通过核孔进入到细胞质中,进一步运输到翻译机器上进行翻译,在这个过程中,核孔作为看门人发挥着重要作用[4]。
RNA结合蛋白异质核核糖核蛋白A3(heterogeneous nuclear ribonucleoprotein A3,hnRNPA3)在调节RNA的胞质运输方面发挥着非常重要的作用[5]。本研究旨在探究hnRNPA3在hESCs维持自我更新中的生物学功能,探讨其在RNA运输过程中的新机制。
1 材料与方法
1.1 材料
1.1.1 细胞: hESCs为H1细胞系(中国医学科学院血液学研究所赠送)。
1.1.2 主要试剂: Matrigel(Corning公司);mTESR1、ReLeSR和Accutase(Stem Cell公司);NPC抗体(Abcam公司);protein A磁珠、核质分离试剂盒(Thermo Fisher Scientificals公司);RT-qPCR试剂(TaKaRa公司);构建质粒所需的内切酶(NEB公司);Mouse IgG 抗体、AP染色试剂盒(Millipore公司);Trizol、M-MLV反转录试剂盒(Invitrogen公司);NPC抗体(Abcam公司);抗Nup62抗体、抗Nup88抗体、抗HSP90抗体、抗fibrillin抗体、抗tubulin抗体、抗-laminB抗体和抗hnRNPA3抗体(Proteintech公司),山羊抗兔、山羊抗小鼠二抗(上海碧云天生物有限公司);多能分化基因qPCR引物(天一辉远测序公司);FISH试剂盒:RNAscope® Fluorescent Multiplex Kit、polyA+RNA探针、OCT4 mRNA探针(ACD公司)。
1.2 方法
1.2.1 体外培养hESCs:将matrigel 铺至6孔板4 ℃过夜后接种H1克隆。使用mTeSRTM1培养,观察密度。4~6 d传代1次:DPBS(Dulbecco’s Phosphate-Buffered Saline)清洗细胞,加入1 mL ReLeSR室温静置1 min后吸净。将细胞放至37 ℃孵箱中6~8 min。加入3 mL mTESR1将克隆重悬,传代至6孔板中进行培养。
1.2.2 免疫共沉淀(co-immunoprecipitation,Co-IP)检测:收集新鲜的细胞6×106个,用1mL含有蛋白酶抑制剂的裂解液冰上裂解30 min,4 ℃ 16 000×g离心15 min,取40 μL裂解液作为input备用,分成两管裂解液分别加入5 μg NPC抗体和鼠IgG抗体,4 ℃ 旋转孵育过夜。将100 μL蛋白A磁珠分别加入到两管裂解液中,4 ℃旋转孵育4~6 h。用磁力架吸附磁珠并清洗3次,加SDS上样缓冲液 50 μL煮沸洗脱蛋白。
1.2.3 分离细胞核和细胞质:使用核质分离试剂盒,按照细胞体积加入适量预冷Cytoplasmic Extraction Reagent Ⅰ(CER Ⅰ)重悬细胞,涡旋振荡15 s,冰上孵育10 min,加入预冷Cytoplasmic Extraction Reagent Ⅱ(CER Ⅱ)涡旋振荡5 s,冰上孵育1 min,涡旋振荡5 s后 16 000×g离心5 min,立即转移上清至干净的管中,此为细胞质成分。向剩余沉淀部分中加入适量预冷Nuclear Extraction Reagent(NER),涡旋振荡15 s后冰上孵育40 min且每10 min振荡混匀15 s,16 000×g离心10 min,转移上清至新管中,此为细胞核成分。
1.2.4 Western blot检测蛋白表达:提取蛋白后进行SDS-PAGE电泳,湿转法转到PVDF膜上,5%脱脂牛奶室温封闭1 h,一抗4 ℃孵育过夜。TBST洗涤后加入二抗室温孵育40 min,TBST洗膜后用化学发光法显影。
1.2.5 shRNA载体的构建:通过shRNA干扰片段在线设计网站http://rnaidesigner. Thermofisher.com/ rnaiexpress/以及hnRNPA3的序列,设计1条shRNA并在两端连接相应的酶切位点黏性末端,序列由天一辉远生物技术有限公司合成。合成的片段退火,退火得到的片段与pLKO.1载体连接。
1.2.6 克隆形成能力检测及碱性磷酸酶(alkaline phosphatase,AP)染色:6孔板每孔5×103个单细胞,培养5~7 d,进行碱性磷酸酶染色,用4%多聚甲醛固定细胞2 min后,PBS洗1次,试剂按照FRV∶Naphthol∶water=2∶1∶1配置好后加入细胞中,室温避光放置15 min,去掉染色试剂加PBS洗1次后镜下观察。
1.2.7 实时荧光定量PCR(RT-qPCR)检测RNA: Trizol法提取细胞总RNA,测定RNA样品的浓度和纯度。M-MLV合成cDNA第一链,每个样品实验设置3个复孔,检测总体积为20 μL。程序如下:94 ℃ 10 s,58 ℃ 10 s,72 ℃ 20 s,共 40个循环。RT-qPCR用到的引物见表1。

表1 RT-qPCR引物Table 1 Primer sequences for RT-qPCR
1.2.8 RNA 荧光原位杂交(fluorescenceinsituhybridization, FISH)技术:前1 d将细胞铺到腔室盖玻片上过夜。用PBS洗1次后加4%的多聚甲醛固定30 min,PBS洗2次,梯度脱水后用蛋白酶A通透10 min,加RNA探针40 ℃孵育2 h,依次加入扩大信号试剂AMP1、AMP2、AMP3、AMP4孵育,用含有DAPI的封片剂封片,次日用Leica显微镜DM6B拍照,使用Cellprofiler软件进行荧光信号统计。
1.2.9 蛋白质互作网络预测网站:https://string-db.org/。
1.3 统计学分析
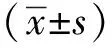
2 结果
2.1 抑制内源hnRNPA3的表达降低了hESCs自我更新能力
在hESCs细胞中构建一条位点特异的shRNA能显著抑制hnRNPA3蛋白表达(图1A),可用于后续功能实验。抑制hnRNPA3的表达导致hESCs细胞克隆变小(图1B),hESCs克隆形成能力降低(P<0.05)(图1C),并且在分子水平上促进了分化标志基因的表达(P<0.001),但多能性标志基因RNA水平未发生明显的变化(图1D)。
2.2 hnRNPA3定位在细胞核中并与核孔复合物互作
分离hESCs细胞核与细胞质后,可见细胞质标志蛋白 HSP90和tubulin 蛋白主要定位在细胞质中, 细胞核标志蛋白 fibrillin和tubulin 主要定位在细胞核中,在核质分离成功的情况下,RNA结合蛋白hnRNPA3主要定位在细胞核中(图2A)。由于hnRNPA3在过去报道中参与胞质RNA转运[9],选择核孔复合物进行Co-IP,在核孔主要组分NUP88、NUP62[5]高度富集的情况下,hnRNPA3与核孔复合物发生特异性结合(图2B)。
2.3 抑制内源hnRNPA3的表达减弱了OCT4 mRNA及polyA+ RNA的出核能力
抑制hnRNPA3的表达后检测OCT4 mRNA核质分布发现,WT(wide type) hESCs中OCT4 mRNA 主要分布在细胞质中,当hnRNPA3表达降低后其出现了显著的核滞留(图3A)。为探究hnRNPA3对mRNA出核的调控是否具有广谱性,抑制hnRNPA3的表达后检测polyA+RNA 核质分布发现,WT hESCs中polyA+RNA 核质均有分布,当hnRNPA3表达降低后在核内有明显聚集,核质信号比增大(图3B)。
2.4 hnRNPA3与约1/3的已知出核相关蛋白质结合
过去文献共报道68个出核相关蛋白质[5],从蛋白质互作网站预测到hnRNPA3与其中近1/3(20个)数量的蛋白相互作用(图4A),将其通过蛋白互作网络进行展示(图4B),其中包括RNA加帽蛋白NCBP1[6]、NCBP2,剪接相关蛋白SRSF家族[7],核孔蛋白NUP98[5]、hnRNPA3还与已报道特异性调控多能性mRNA出核的THOC2[8]有互作关系。
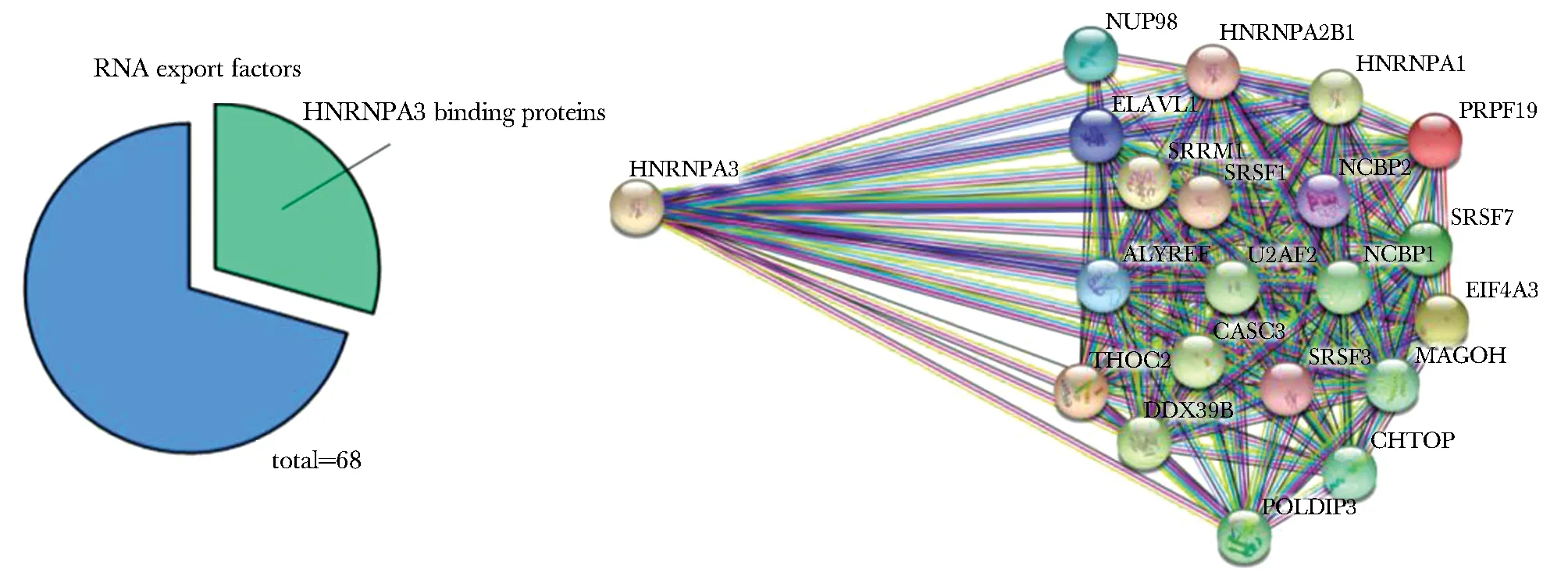
图4 hnRNPA3与出核调控因子的联系Fig 4 A association between hnRNPA3 and the RNA export factors
3 讨论
hESC有一个复杂的基因表达程序,控制自我更新和分化之间的微妙平衡。Oct4是hESCs多能性维持必不可少的基因,其表达的改变会导致hESCs命运发生不可逆转的变化[9]。虽然转录可能在基因调控中起着开关的作用,但近期研究已经开始揭示转录后调控机制在维持hESCs状态的重要性,如非编码RNA、选择性剪接、聚腺苷酸化和RNA稳定性[10-12]。因此可能除了转录外,还存在转录后模块与转录协同作用,控制hESCs中的基因表达网络。
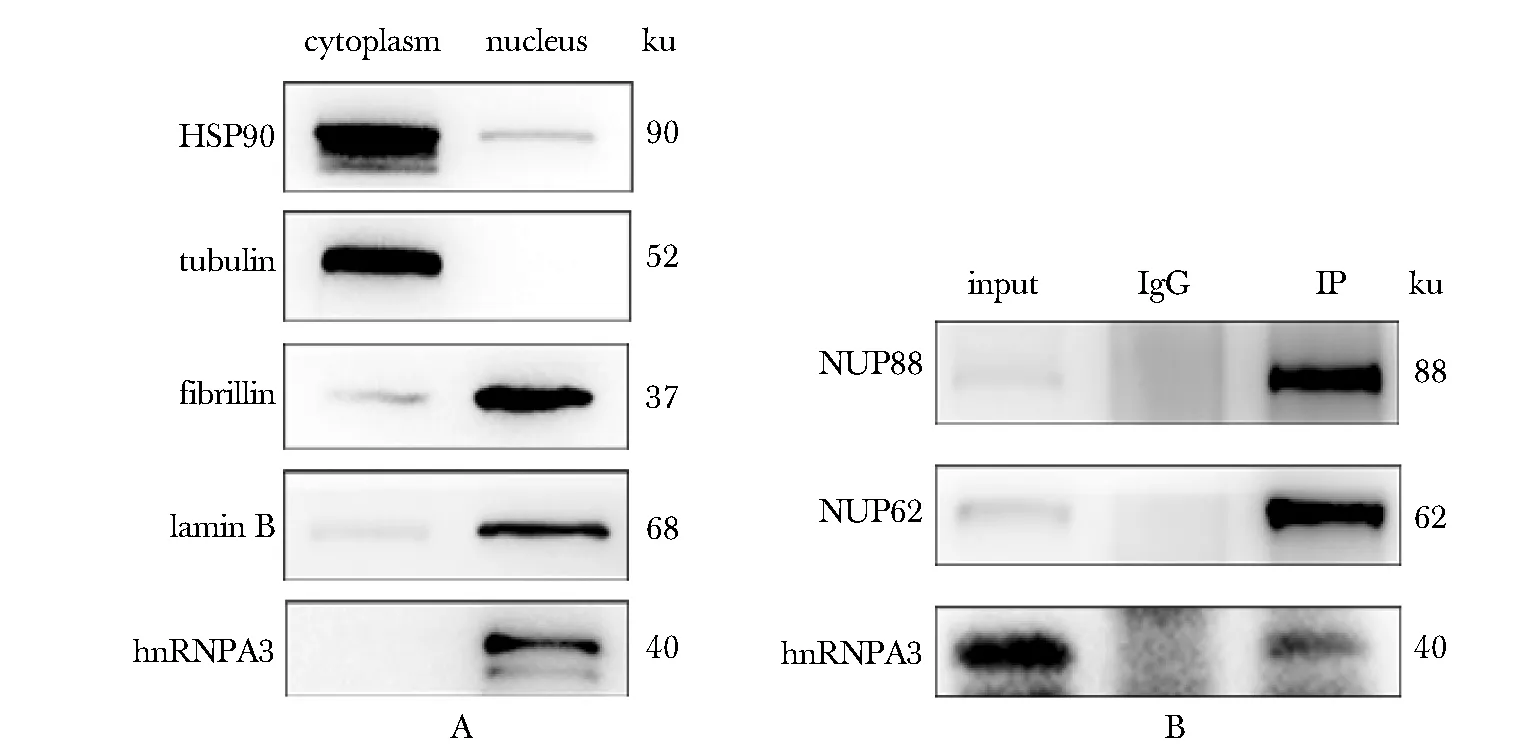
A.cell localization of marker proteins(Hsp90, tubulin, fibrillin and tubulin) and hnRNPA3 were detected by Western blot;B.enrichment of nucleopore NUP88/NUP62 and the interaction between hnRNPA3 and nucleopore complex were detected by Western blot

A.fluorescence signals of 107 cells in the negative control group and 100 cells in the hnRNPA3 knockdown group(×40), *P<0.001 compared with negative control group; B.fluorescence signals of 170 cells in the negative control group and 221 cells in the hnRNPA3 knockdown group(×40); *P<0.001 compared with negative control group
本研究表明,hnRNPA3对hESCs自我更新能力的维持有重要的作用,主要表现在两个方面:一方面hnRNPA3不影响多能性基因mRNA表达水平,而是定位在细胞核中且与核孔复合物相互作用,调节多能性基因OCT4 mRNA出核来维持hESCs多能性;另一方面hnRNPA3通过抑制分化标志基因mRNA水平的表达来进一步维持hESCs多能性。然而不能排除hnRNPA3通过其他方式调节多能性的可能性,比如从其广谱性调节polyA+RNA出核的表现来看,除了调节多能基因外,可能还通过调节其他mRNA的出核来调节多能性。
本研究也探讨了hnRNPA3调控RNA运输的新机制。在经典的出核途径中,mRNA在细胞核中被RNA结合蛋白加工成熟后赋予出核能力,历经核质运输的重要通道核孔进入到细胞质中被翻译。RNA结合蛋白hnRNPA3与20个已知报道的出核相关蛋白互作,这些出核相关蛋白偶联了RNA加工和出核过程。hnRNPA3可能在mRNA的加工时或者加工完成后募集到mRNA上,帮助募集一部分出核相关蛋白来帮助加工进而赋予mRNA出核能力,当mRNA在出核相关蛋白的辅助下通过核孔时,hnRNPA3又可以和核孔互作调节核孔的开关或松弛状态使得mRNA顺利运输到细胞质。之前的研究表明,hnRNPA3还调节细胞质中mRNA的运输[13],可见hnRNPA3在mRNA代谢过程中发挥了重要的作用。
