YAP 干扰腺病毒载体对宫颈癌增殖、迁移及侵袭的影响
2021-06-17王红王恳焦庆昉杨万全张镇李婕婷吴扶生王瑾
王红 ,王恳 ,焦庆昉 ,杨万全 ,张镇 ,李婕婷 ,吴扶生 ,王瑾
作者单位:1 四川省中西医结合医院肿瘤科,四川 成都 610041;2 中国人民解放军联勤保障部队第九八九医院血液科,河南 洛阳 471003
宫颈癌是妇科最常见的恶性肿瘤之一,全世界范围内宫颈癌的新确诊病例超过 52.98 万∕年,是妇女癌症死亡的主要原因之一,其中大部分病人集中在发展中国家。目前手术、化疗及放疗是治疗宫颈癌的主要手段,但大部分病人仍发生复发转移,导致大部分病人的生存率无明显提高。Yes-associated protein(YAP)是 Hippo 信号通路下游的转录激活因子,YAP 蛋白参与了肿瘤细胞的增殖、迁移及侵袭过程,在肿瘤发展过程中发挥重要作用。本团队于 2017年 7月至 2018年 10月利用腺病毒靶向 YAP 干扰载体(pAd-si-YAP),了解 YAP 蛋白对宫颈癌细胞的恶性增殖及侵袭性的作用,为全方面了解宫颈癌的分子生物学机制提供依据。
1 材料与方法
1.1 材料
pAd-si-YAP、重组空载体腺病毒(pAdmock)均由中国人民解放军联勤保障部队第九八九医院构建。人宫颈癌 CaSki 细胞株由中国人民解放军联勤保障部队第九八九医院保存。DMEM 培养基及胎牛血清购自美国 HyClone 公司;Transwell 培养板购自美国 Gibco 公司;鼠抗人 β 肌动蛋白(β-actin)及 YAP 抗体购自美国 Santa Cruz 公司;RNase、碘化丙啶购自上海碧云天生物技术有限公司。荧光定量聚合酶链反应(qPCR)引物由TaKaRa 公司合成,测序也由该公司完成。1.2 细胞培养及细胞感染
配置好含 10% 胎牛血清、100 U∕mL 青霉素及 100 U∕mL 链霉素细胞培养液,将 CaSki 细胞置于 37 ℃、5% 二氧化碳细胞孵箱中培养,取对数生长期细胞进行实验。将 CaSki 细胞接种于 6 孔板中,待密度约为 80% 时,取二孔细胞计数后 ,加入200感染复数(MOI)的重组腺病毒pAd-si-YAP 及无血清的 DMEM,感染 2 h 后,1 000 r∕min×5 min 离心后弃上清,加入含有血清的 DMEM完全培养液;取二孔细胞计数后,加入 200 MOI 的pAd-mock 及无血 清 的 DMEM,感染 2 h 后,1 000 r∕min×5 min 离心后弃上清,加入含有血清的 DMEM完全培养液。另取二孔细胞计数后,加入磷酸缓冲盐溶液(PBS)作为空白对照。由于腺病毒载体中含有编码的绿色荧光蛋白(GFP)基因,因此可在荧光显微镜下观察感染效率情况。待 CaSki 细胞感染 48 h 后,随机选择 6 个视野计数,在荧光显微镜下观察病毒感染情况,计算绿色荧光细胞 占全部细胞的比例。1.3 qPCR 检测 YAP mRNA 的表达
收集培养48 h的感染细胞及正常CaSki细胞,利用 Trizol 法提取CaSki 细胞的总 RNA,进行 qPCR 并进行定量。根据GeneBank 中YAP及 β-actin 设计引物并由 TaKaRa公司合成。YAP 正向引物 5’-CCG CAA CTG CAG ATG GAG AC-3’,反向引物 5’-CCA TCC CGG GAG AAG ACA CA-3’,β -actin 正向引物 5’-CCT CGT CCC CTA CAT CGT-3’,反向引物 5’-GAC GGT GTA GCC CCA CGA AA-3’。qPCR 反应条件:95 ℃变性1 min,60 ℃ 30 s,58 ℃ 35 s,72 ℃ 50 s,33 个循环,最后 72 ℃延伸 10 min。1.4 蛋白质印迹法(Western blotting)检测 YAP 蛋白表达
CaSki 细胞感染重组腺病毒 Ad-si-YAP 及pAd-mock 48 h 后,收集细胞,提取总蛋白,BCA 法测定蛋白浓度,蛋白样品加样 60 微克∕孔,电泳、转膜、封闭,然后加入一抗 4 ℃过夜,后 TBST 缓冲液洗膜3 次,每次洗膜 10 min 后,再与 HRP 标记的二抗(1∶3 000 稀释,即 3 mL 牛奶中加 1 μL 二抗),室温下孵育 1 h。后再予 TBST 缓冲液洗涤 3 次后,应用 ECL化学发光剂检测目的蛋白表达并进行半定量分析。1.5 四甲基偶氮唑盐微量酶反应比色法(MTT 法)检测细胞增殖活力
根据“1.2”方法制备 Ad-si-YAP及 pAd-mock 感染细胞,计数约 10 000 个细胞∕孔接种于 96 孔板,后放回细胞孵箱中继续培养,分别于接种后 24、36、48、60 h 取出一块 96 孔板,加入 20 μL 6 g∕L 的 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),后继续孵育 4 h 后,弃上液,加入 150 μL 的二甲基亚砜(DMSO),震荡约 15 min 后于酶标仪 560 nm 处测吸光度。1.6 流式细胞仪测检测细胞周期及凋亡
分别用Ad-si-YAP 及 pAd-mock 感染细胞 48 h 后,收集细胞,加入 70% 乙醇固定,后放入 4 ℃冰箱过夜,后用 PBS清洗,后加入核糖核酸酶 A(RNase A),在 37 ℃水浴30 min,后碘化丙啶(PI)避光染色 30 min,后应用流式细胞仪分析细胞周期及凋亡。1.7 划痕试验检测细胞迁移能力
CaSki 细胞以 3×10密度接种于 6 孔板,当细胞生长密度达到 80%,用 10 μL 小枪头行“一”字划痕,后丢弃培养基,PBS轻轻清洗 3 次,后加入 5% 胎牛血清的 DMEM 培养基,显微镜下观察并拍照,于此时记为 0 h,后继续培养 24 h,后在同一观察点观察划痕愈合情况,通过计算观察点划痕宽度平均值,计算划痕愈合率。划痕愈合率(%)=(0 h 划痕宽度―24 h 划痕宽度)∕0 h 划痕宽度×100%。1.8 细胞侵袭试验
取 24 孔板并加入 600 μL 不含血清的 DMEM 培养基,将 Transwell 小室及侵袭小室放入 24 孔板中,放入 37 ℃细胞孵箱中平衡备用。接种 CaSki 细胞于 6 孔板中,经过 12 h 培养后,分别予 Ad-si-YAP 及 pAd-mock 感染细胞 12 h,对照组予PBS 处理,后用胰酶消化细胞呈悬液后,以每孔 5×10∕200 μL 接种予经过平衡的处理的 Transwell 小室及侵袭小室,于 37 ℃细胞孵箱中继续培养。24 h 后去除 Transwell 小室及侵袭小室中残液,于冰甲醛中固定 15 min,后予 0.1% 的结晶紫染色液中染色 20 min,PBS 清洗后晾干,每孔随机取 5 视野于 100 倍镜下计数。
2 结果
2.1 pAd-si-YAP 及 pAd-mock 感染 CaSki 细胞
pAd-si-YAP 感染效率为(93.1±2.4)% ,pAd-mock 感染效率为(92.8±3.1)%,见图1。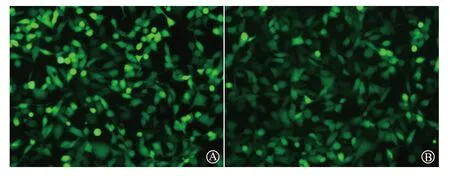
图1 荧光显微镜下观察宫颈癌CaSki细胞感染48 h后病毒感染情况(×10):A为腺病毒靶向YAP干扰载体(pAd-si-YAP)感染CaSki细胞;B为重组空载体腺病毒(pAd-mock)感染CaSki细胞
2.2 qPCR 检测YAP mRNA 的表达
Ad-si-YAP感染 CaSki 细胞的 YAP mRNA 表达明显低于 pAdmock 感染的 CaSki 细胞及 PBS 处理的CaSki 细胞[(22.01±0.24)比(80.12±0.31)、(84.18±0.22),P
<0.05],表明 Ad-si-YAP 可以抑制 YAP 基因转录。本实验重复 3 次。2.3 蛋白质印迹法检测 YAP 蛋白表达
Ad-si-YAP感染 CaSki 细胞的 YAP 蛋白表达低于 pAd-mock 感染 的 CaSki 细胞及PBS处理的 CaSki 细胞[(0.6±0.018)比(1.5±0.031)、(1.8±0.27),P
<0.05],表明 Adsi-YAP 可以干扰 YAP 基因表达。见图2。
图2 蛋白质印迹法检测宫颈癌 CaSki 细胞 YAP 蛋白表达
2.4 MTT 法检测细胞增殖活力
24 h 后 pAd-mock感染的 CaSki 细胞及 PBS 处理的 CaSki 细胞增殖明显快于 Ad-si-YAP 感染 CaSki 细胞(P
<0.05),而 pAdmock 感染的 CaSki 细胞相比 PBS 处理的 CaSki 细胞增殖趋势大致相同(P
>0.05),说明沉默 YAP 基因可以抑制 CaSki 细胞增殖。见表1。2.5 流式细胞仪检测细胞周期及凋亡分析
本研究发现通过沉默 YAP 后,CaSki 细胞周期停滞于 G0∕G1 期明显增加(P
<0.05),同时 CaSki 细胞增多(P
<0.01),而 pAd-mock 感染的 CaSki 细胞相比 PBS 处理的 CaSki 细胞周期分布及凋亡差异无统计学意义(P
>0.05),见表2。
表1 MTT 法检测宫颈癌 CaSki 细胞增殖活力(吸光度)结果∕
表2 流式细胞仪测检测 CaSki 细胞周期分布及凋亡结果∕(%,)
2.6 划痕试验检测细胞迁移能力
沉 默 YAP 后CaSki 细胞的划痕愈合占比下降[(40.01±0.16)%比(81.02±0.22)%、(86.04±0.31)%,P
<0.05],从而说明YAP 可以促进CaSki 细胞迁移。2.7 细胞侵袭试验
沉默 YAP 后 CaSki 细胞的侵袭细胞数下降[(120±4)个 比(640±3)个 、(680±4)个,P
<0.05],而 pAd-mock 感染的 CaSki 细胞及 PBS处理的 CaSki 细胞 ,其侵袭力差异无统计学意义[(640±3)个比(680±4)个,P
>0.05],说明 YAP 可以提高 CaSki 细胞侵袭能力。3 讨论
宫颈癌是妇女最常见的恶性肿瘤之一,仅次于乳腺癌,占女性肿瘤第二位,严重威胁女性病人的生命,对社会及病人造成严重的负担。大部分病人确诊宫颈癌时,已经发生淋巴结及远处转移,而发生转移的病人预后很差。深入研究宫颈癌分子生物学特性,寻找更多潜在治疗靶点,是摆在肿瘤科研人员面前的重要课题。YAP 基因位于染色体 11q22 区,被认为是一种原癌基因,其编码产生YAP 蛋白,作为一种转录共激活因子,促进 Hippo 通路中的下游目的基因表达,从而促进细胞生长,抑制细胞凋亡,因此认为 YAP 基因为原癌基因。如果YAP 异常活化,则 YAP 蛋白与转录 因 子 TEAD 相 结合促进基因转录,诱导上皮间质细胞转化,并增强细胞增殖,可抑制细胞凋亡,增强肿瘤细胞转移和侵袭能力。宫颈癌的发病机制极其复杂,目前认为是多因素、多基因、多阶段共同参与导致的结果,其中细胞信号传导通路对宫颈癌的发生、发展起着至关重要的作用。现发现,Hippo-YAP 信号是众多信号通路中,调节宫颈癌形成的一条重要传导通路。YAP 是 Hippo 通路中的核心效应因子,在机体内发挥胞内信号传导和转录调节等作用,而 Hippo-YAP 信号通路可调控机体器官的大小,调节肿瘤细胞增殖、凋亡、侵袭和转移等恶性行为,因而成为肿瘤研究中的热点。Liu 等采用免疫组织化学方法分析检测 120例宫颈鳞状细胞癌、42例宫颈腺癌、22例正常宫颈组织的 YAP 表达水平,同时对细胞质与细胞核中的 YAP 表达进行单独分析,发现YAP 蛋白在肿瘤中表达水平明显高于正常组织,而李娜等则证明 YAP 蛋白表达越高,宫颈癌的恶性侵袭性越强,同时病情进展越快。
本团队在之前工作基础上将 pAd-si-YAP 转染CaSki 细 胞,发现 Ad-si-YAP 可以抑制 CaSki 细胞的YAP 蛋白表达,同时发现沉默 YAP 基因后 CaSki 细胞的细胞周期发生改变,S 期细胞比例减少,凋亡细胞增加,本团队拟下一步深入研究 YAP 蛋白与细胞周期蛋白之间的关系。肿瘤细胞的侵袭及转移机制,涉及多种信号转导通路以及肿瘤微环境的相互作用,本研究发现沉默 YAP 基因后 CaSki 细胞的迁移能力及侵袭能力相对于对照组均有不同程度下降,本团队下一步将进一步研究 Hippo-YAP 通路的具体作用机制及其如何与其他信号通路相互作用,为全方面了解宫颈癌的分子生物学机制提供依据,以期为宫颈癌综合治疗及 Hippo 信号传导通路的调节提供一个潜在靶点。
