基于COI序列的DNA微条形码技术鉴别熟肉制品中11种肉掺假的研究
2021-06-16扈明洁赵琪奇金朦娜邱红钰
励 炯,江 海,吴 琼,扈明洁,赵琪奇,金朦娜,邱红钰
(杭州市食品药品检验研究院,浙江杭州 310017)
畜禽类肉制品是人们蛋白质摄入的主要来源,中国居民平均每日肉类摄入量为50~75 g[1]。畜禽类肉制品一般以整只或者切割方式进行销售,消费者可以通过感官进行鉴别,但经过粉碎、烟熏、腌制或者制成罐头等处理的肉制品,会改变其原有的性状特征[2],再加上不同肉类的价格差异,一些不法商家就用低经济价值肉类部分或者全部掺混到高经济价值的肉制品中,通过添加香精香料或者其他佐料,使得消费者只能通过外包装的标签信息购买其所需的肉制品[3]。2016年,Kane和Hellberg[4]的一项研究发现,抽查的肉制品中有将近20%的畜禽类肉制品所标示的成分与实际检验结果不符。其他一些研究也表明有20%~70%的肉制品,包括碎肉、熟肉制品、宠物食品以及肉干,检验结果与其所标示的肉类品种不符合[5-6]。自从出现大规模的掺假肉制品事件后,欧洲各国已经采取各种积极措施,避免肉类掺假事件的发生,以保障消费者的权益[7]。在美国,虽然各政府部门严令禁止销售掺假肉制品,但仍有研究发现将近有17%的碎肉制品种类与标签的标示不一致[8-9]。
经过深加工处理的熟肉制品的掺假鉴别,一般采用DNA或者基于蛋白质的分子生物学方法进行检测[10-12],包括ELISA[13-14]、PCR[15-17]、RFLP[18-19]和DNA测序[20]等方法。近年来有研究用质谱手段来分析蛋白质和多肽,但是由于质谱设备的昂贵以及操作的复杂性,并未被广泛应用于肉类掺假鉴别中[21-22]。
2003年加拿大生物学家Paul Hebert首次提出了DNA条形码的概念,其原理就是利用标准的、有足够变异的、易扩增且相对较短的DNA片段,这个片段在物种内具有足够的特异性和种间足够的多样性,能够实现对物种进行快速、准确识别和鉴定,类似于超市里识别商品的条形码[23]。很多研究表明线粒体细胞色素C氧化酶亚基I(cytochrome C oxidase subunit I,COI)基因是肉类制品DNA条形码技术较为理想的目的基因,一般采用全片段DNA条形码技术(full-length DNA barcoding)来对保存完好的新鲜样本进行鉴别,全片段DNA条形码技术是以大约650 bp大小的COI基因片段为基础来进行鉴定[24]。但是熟肉制品经过高温、高压等加工处理,大量的DNA在深加工过程中会被降解,导致一些肉罐头之类的肉制品在鉴别过程中,很难获得全片段DNA条形码[25]。2008年Meusnier等[26]报道了对DNA小片段的扩增的DNA微条形码技术(mini-DNA barcoding),设计了专门针对全片段DNA条形码中部分小片段DNA的通用型引物。虽然肉类的深加工会导致DNA片段的分解,但是可以利用DNA微条形码技术实现对各种熟肉制品的COI基因片段的小片段(100~300 bp)的扩增,然后进行熟肉制品的肉的种类的鉴别。
本文采用基于COI序列的DNA微条形码技术(mini-barcoding),通过优化样品前处理方法,利用通用引物COI-A对11种熟肉的DNA进行扩增,将扩增后的片段经克隆测序并将结果与GenBank数据库Blast比对,成功的对熟肉制品中11种肉类进行掺假鉴别研究。
1 材料与方法
1.1 材料与仪器
研究所用的11种肉类(包括猪、牛、羊、鸡、鸭、鸽子、马、驴、鹅、兔、鼠等)为了保证其没有掺假,购买没有加工过的完整的生鲜肉,作为本研究用的纯肉;研究所用的熟肉制品 部分来自2019年杭州市市场监管局监督抽样,部分采购于超市,包括牛肉、羊肉、鸽子肉、鹅肉、兔肉等共5种熟肉制品,共计30批次,其产品包括肉干、肉罐头、肉串、肉丸、肉酱、肉馅、肉粒等;血液与组织DNA提取试剂盒 德国QIAGEN公司;PCR产物及DNA片段回收试剂盒、T4连接试剂盒、pGEM-T载体、DH5α感受态细胞 天根生化科技有限公司;即用PCR扩增试剂 上海生工公司。
高速离心机 德国sigma公司;干式恒温器 杭州奥盛仪器有限公司;Veriti 96孔梯度PCR仪 美国ABI公司;EYELA FDU-1100真空冷冻干燥器 日本东京理化公司;PowerPac Basic电泳仪 美国Bio-Rad公司;Gel Doc XR+凝胶成像系统 美国Bio-Rad公司;NanoDrop 1000微量核酸蛋白测定仪 美国Thermo公司。
1.2 实验方法
1.2.1 样品预处理 生鲜肉:经过高温煮沸20 min,将煮熟的纯肉晾干后放入料理机粉碎处理后备用。
熟肉制品:取30批次的熟肉制品的肉部分,用料理机处理后,将打碎的样品置于250 mL烧杯中,加入150 mL去离子水,超声处理30 min,去掉水溶液,肉沫残渣备用。将经料理机粉碎处理后的11种纯熟肉以及30批次经处理的残渣肉沫放于-40 ℃冰箱进行预冷4 h,将预冷后的样品放在真空冷冻干燥箱中,在真空度低于1×10-4Pa,温度-50 ℃条件下真空冷冻干燥24 h,真空冷冻干燥后的样品经中药粉碎机粉碎后,置于-20 ℃保存备用。
1.2.2 DNA提取 本文采用DNeasy血液与组织提取试剂盒对经1.2.1预处理的熟肉制品进行DNA提取和纯化。取真空冷冻干燥后的样品粉末0.5 g置于10 mL离心管中,加入2 mL ATL缓冲溶液和200 μL蛋白酶K,漩涡振荡30 s,经56 ℃裂解3 h,每隔30 min进行漩涡振荡一次。取裂解液250 μL上柱,DNA经AW1和AW2缓冲液洗柱膜后,用37 ℃预热的AE缓冲液洗脱DNA,并将其储存在-20 ℃。同时做试剂空白。
冻融作用对土工程性质的影响是由于分凝冰的出现改变了土骨架的结构所造成的, 因此影响分凝冰或者分凝势的因素也必然影响冻融后土的工程性质,如孔隙率和干密度。Chamberlain等[6]认为,冻融通过改变土的结构性,如土中产生大孔隙、纵向微裂隙等, 从而使其垂直方向的渗透性增大。反复冻融不仅破坏了土颗粒间的联结力, 同时使土颗粒得以重新排列。目前,广泛认为冻融循环可以从多方面改变土的工程性状,而这些都是通过改变土的结构性实现的。一些研究还发现土的渗透性和密度经3~5次冻融循环后趋于稳定[1,6-7]。
1.2.3 COI基因的扩增 本文选用王爽等[27]公开发表的一对引物(COI-A,详细序列见表4),引物上连接M13,引物合成由杭州擎科生物技术有限公司完成。
从每批样品中提取的DNA模板进行微型片段的PCR扩增。每个PCR扩增反应管包含以下试剂(25 μL体系):12.5 μL即用PCR扩增试剂,9.5 μL ddH2O,0.5 μL 10 μmol/L正向引物,0.5 μL 10 μmol/L反向引物,2 μL DNA模板。DNA微条形码片段扩增程序:95 ℃ 2 min;95 ℃ 1 min,46 ℃ 1 min,72 ℃ 30 s,循环5次;95 ℃ 1 min,53 ℃ 1 min,72 ℃ 30 s,循环35次;最后72 ℃保持10 min。将扩增片段储存于-20 ℃。
1.2.4 PCR扩增片段的确认及DNA测序 采用2.0%琼脂糖凝胶电泳分离进行电泳PCR扩增产物,将所需的目标片段经切胶回收纯化后,送公司(杭州擎科生物技术有限公司)进行测序。
1.2.5 PCR产物克隆测序 PCR产物中挑选不同阳性克隆进行测序分析。纯化后的PCR产物与pGEM-T载体连接后,导入DH5α感受态细胞。36 ℃培养箱培养12 h,经过蓝-白筛选后,挑取10个不同的白色菌落接种到LB液体培养基培养过夜(36 ℃,150 r/min摇床),取菌液1 mL提取质粒DNA,送杭州擎科生物技术有限公司进行测序。
1.2.6 测序结果分析 将1.2.3和1.2.4所得的测序结果经删除两端引物和质粒序列后,提交GenBank数据库进行Blast比对,同时利用NCBI数据库对样品的COI序列进行鉴定和相似度分析。
2 结果与分析
2.1 样品预处理方式的选择
肉掺假样品的前处理方式非常关键,特别是混合预处理,如果处理方式选择不当,会引起漏检或者误检,所以选择一种能使所得样品具有可靠性和代表性的预处理方式非常重要。一般的预处理方式是用料理机或者粉碎机,将样品打碎混合均一,或者采用液氮研磨法进行处理,本文采用真空冷冻干燥法,即取200 g的样品组织,进行冷冻干燥,将干燥后的样品经粉碎机粉碎均匀。本文采用牛肉掺假猪肉模式(其中猪肉的掺假比例为10%,经煮沸20 min处理),对料理机粉碎处理、液氮研磨法以及真空冷冻干燥法三种预处理方式进行可靠性考察,各选用20份掺假样品,每份样品取0.5 g,分别经上述三种预处理方式进行处理后,进行掺假检测,结果见表1。

表1 3种预处理方式对牛肉掺假 猪肉模式(10%)的检出情况Table 1 Detection of beef adulterated pork model(10%)by three pretreatment methods
从表1可以看出,三种预处理方式中,真空冷冻干燥法的可靠性最高,在20份掺假模式中均检出猪肉成分;而料理机粉碎处理的可靠性最低,检出率仅为25%,说明该预处理方式没有把样品充分混匀;而液氮研磨法,其检出率只有60%,经液氮研磨后的样品,虽然已经粉碎,但是还是含有一定量的水分,造成样品的不均一性。所以本文采用真空冷冻干燥法作为熟肉制品中掺假鉴定的预处理方式。
2.2 DNA提取方式的选择
样品取样的可靠性和代表性在熟肉制品掺假检测中也非常关键,其中如果样品取样量太少,代表性不足,也会引起漏检,并且在肉制品加工过程中,设备中残留的上一批次的其他肉类会带入下面一批次的肉制品中,没有代表性的取样也会引起实验结果误判。DNeasy血液与组织提取试剂盒建议取样量为10~25 mg,但这个取样量是针对纯的样品,如果要提取掺混样品,显然这个取样量太小。本文采用牛肉掺假猪肉模式(其中猪肉的掺假比例为10%,经开水煮沸20 min),对掺假样品的取样量的可靠性进行研究。样品经真空冷冻干燥处理后,取样品粉末分别为25 mg、0.1 g和0.5 g,分别取20份,经过前处理和检测结果见表2,当取样量为25 mg时,阳性检出率只有45%,但取样量为0.1 g时,检出率提高至85%,但还是会有漏检的比例,所以当取样量增至0.5 g时,检出率达到100%。所以本文最终选取样量0.5 g对肉制品样品DNA进行提取。

表2 3种取样量对牛肉掺假猪肉模式(10%)的检出情况Table 2 Detection of beef adulterated pork model(10%)by three sample weights
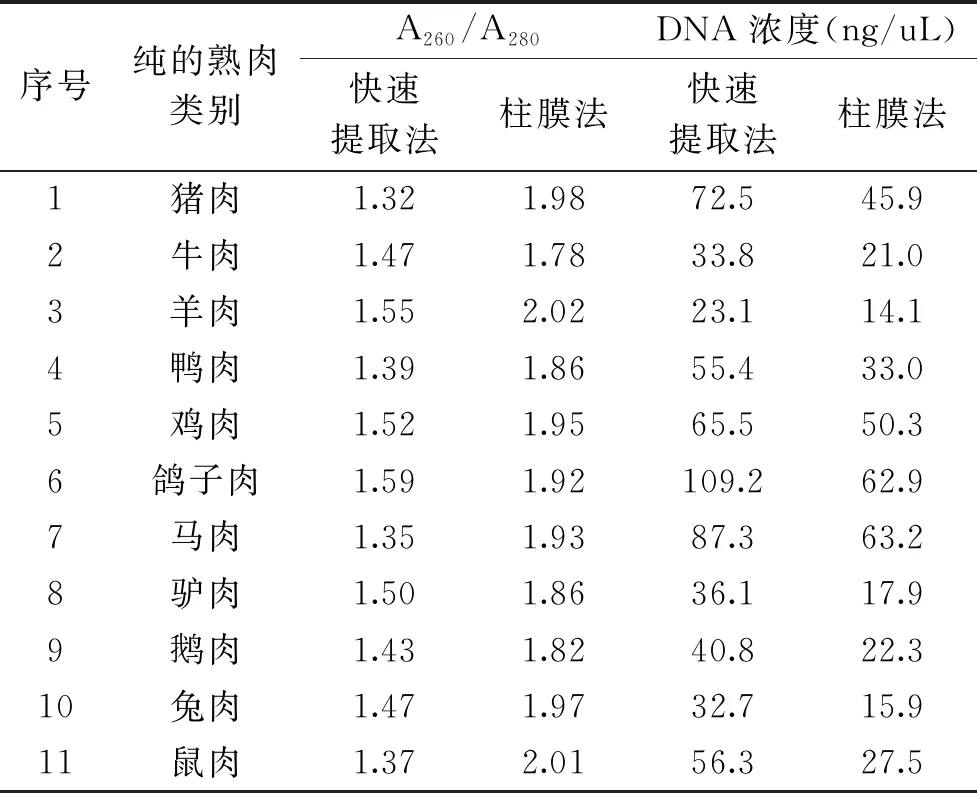
表3 11种纯的熟肉DNA提取纯度Table 3 Purification of 11 cooked samples found to contain one species
2.3 DNA微条形码序列片段的扩增条件优化
通过查阅文献,参考了三对通用引物COI-A,COI-B和COI-C(具体引物序列详见表4),并分别考察了三对通用引物对11种熟肉的扩增效率。11种经煮沸处理的肉DNA经柱膜法提取后,分别加入三对通用引物进行PCR扩增,扩增产物以2%琼脂糖凝胶电泳检测。结果发现,通用引物COI-B虽然能扩增出大部分的熟肉类的DNA,但是鸡肉和鼠肉的条带非常浅,扩增效率非常低;而通用引物COI-C在熟羊肉、马肉和驴肉三种肉DNA扩增失败,没有条带;而引物COI-A扩增目标片段为130 bp左右,能成功扩增出11种熟肉的微条形码DNA片段,三种引物的扩增结果图详见图1。所以本文最终采用COI-A作为熟肉制品中11种肉掺混研究的通用引物。
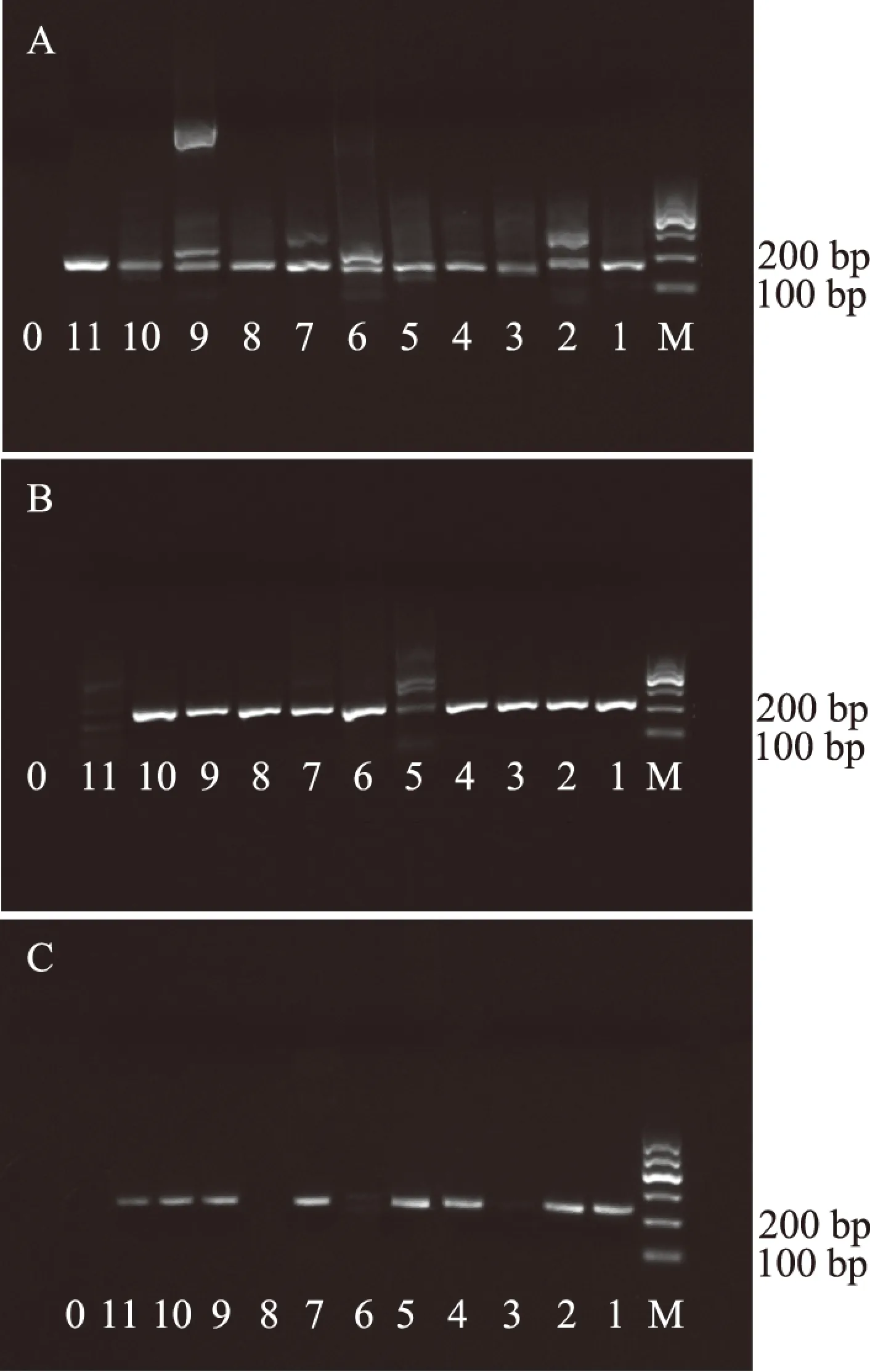
图1 11种纯的熟肉DNA微条形码的PCR扩增电泳图Fig.1 Electrophoresis images of DNA mini-barcoding fragments amplified by PCR from 11 species of cooked meat 注:A:COI-A;B:COI-B;C:COI-C;M:Marker:100~600 bp;0:阴性对照;1:PCR产物(猪);2:PCR产物(牛);3:PCR产物(羊);4:PCR产物(鸭);5:PCR产物(鸡);6:PCR产物(马);7:PCR产物(鸽子);8:PCR产物(驴);9:PCR产物(鹅);10:PCR产物(兔);11:PCR产物(鼠)。
确定11种熟肉DNA微条形码序列扩增用的通用引物之后,本文对PCR的扩增体系和扩增程序进行优化。本文的目的是在高经济价值的肉类(牛、羊、鸽子、鹅、兔等)中检出掺假的低经济价值的肉类(猪、鸡、鸭、马、驴、鼠等),所以扩增条件优化的目的是:在该扩增条件下,使低经济价值肉类的扩增效率相对较高,而高经济价值肉类的扩增效率相对低,这样有利于提高检测灵敏度。
在PCR扩增体系中,DNA模板的浓度会影响扩增效率,浓度过高过低均会降低其效率,在25 μL扩增体系中,本文考察DNA模板的不同使用量(1、2、3 μL),当DNA模板的加入量为2 μL时,11种熟肉的DNA条带均比较明显,而且低经济价值的肉类(猪、鸡、鸭、马、驴、鼠等)的条带比高经济价值的肉类(牛、羊、鸽子、鹅、兔等)的条带明显,扩增效率高。
PCR扩增程序中的退火温度对DNA微条形码序列的扩增效率影响非常大,本文考察了三个退火温度(50、53以及57 ℃)对11种熟肉的DNA微条形码序列的扩增效率,结果发现,当退火温度为53 ℃时,11种熟肉的扩增效率较好,电泳跑胶条带较明显,低经济价值的肉类(猪、鸡、鸭、马、驴、鼠等)的条带比高经济价值的肉类(牛、羊、鸽子、鹅、兔等)的条带明显,扩增效率高,能满足本研究掺假模式的建立以及目标掺假肉类的检测,扩增产物电泳跑胶结果见图1。从图1A中可以看出,11种肉在100~200 bp之间均有一条较明显的扩增条带。然后将11种肉的PCR扩增产物送至生物公司进行克隆测序,测序结果见表5。
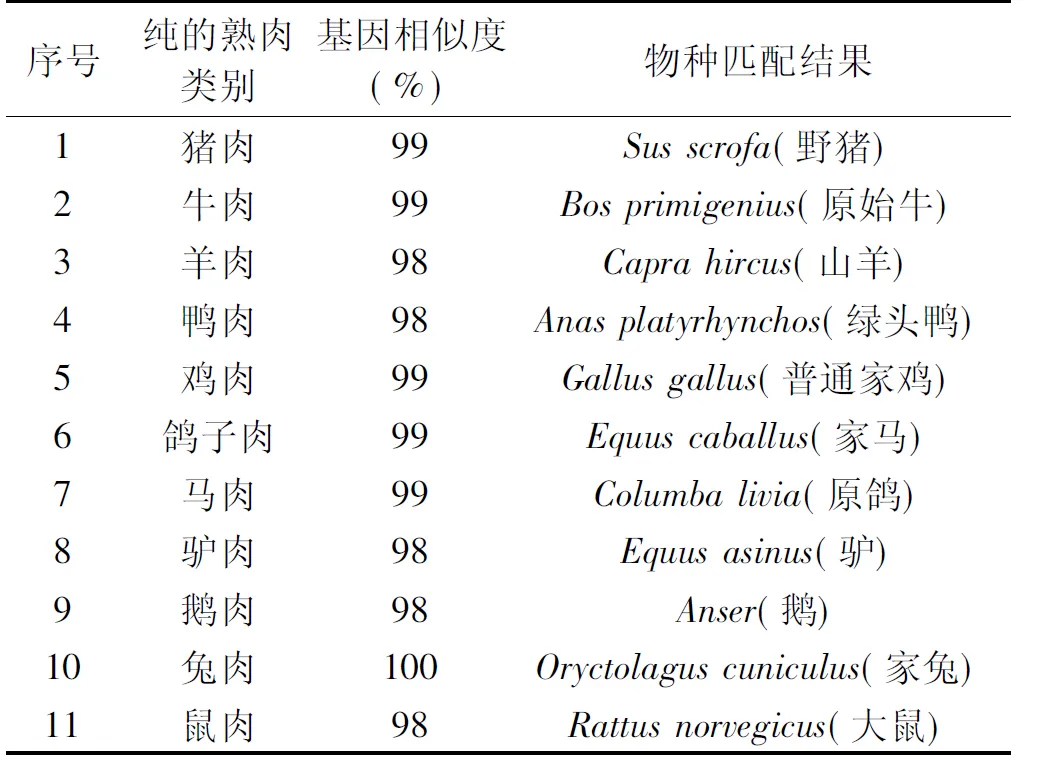
表5 11种纯的熟肉DNA微条形码检测结果Table 5 DNA mini-barcoding results for 11 cooked samples found to contain one species
2.4 熟肉掺假模式建立
本研究主要设定两种肉的掺假模式,采用高经济价值的肉类(牛、羊、鸽子、鹅、兔)与低经济价值肉类(猪、鸡、鸭、马、驴、鼠)的掺混模式,具体见表6。
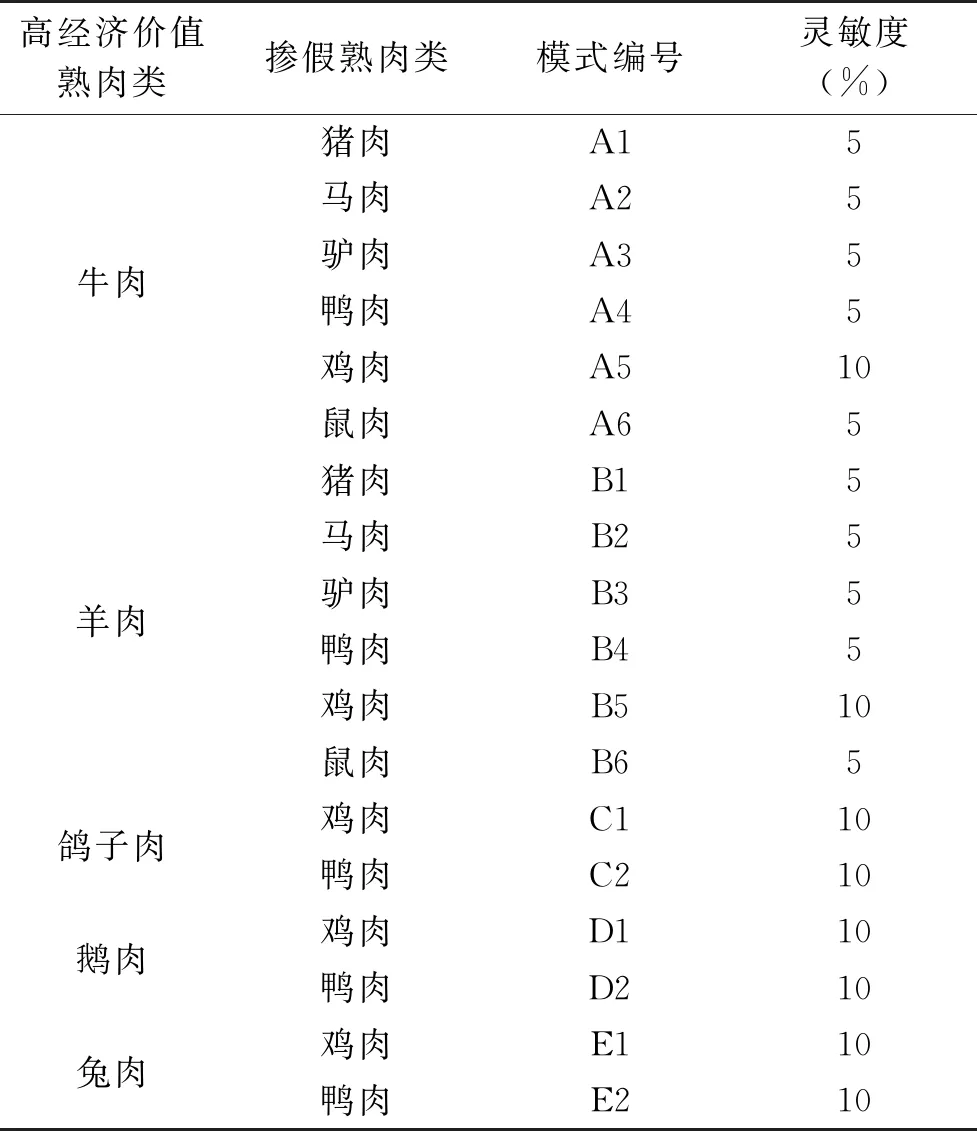
表6 熟肉类掺假模式Table 6 Cooked meat adulteration model
本文考察了5种高经济价值熟肉类的掺假的可能性,一共建立18个掺假模式,然后分别加入5%、10%、15%和20%的掺假比例来考察本方法的最低检出比例(检测灵敏度),结果发现,本方法在牛肉和羊肉的熟肉制品中的掺假的检出灵敏度较高,除了鸡肉,其他5种掺假肉类的检出灵敏度为5%,牛肉和羊肉中的鸡肉掺假的最低检出比例为10%;而鸽子肉、鹅肉、兔肉的掺假模式中,各种肉类的最低检出比例均为10%,本方法能满足日常的检测要求。
2.5 实际样品检测
熟肉制品加工过程中,经过粉碎、烟熏、腌制或者制成罐头食品等处理,可能会加入高含量的食用油和盐,会改变原有的性状以及感官特征,除此之外,可能会加入一些香精香料色素等添加剂,以来掩饰其掺入的其他低经济价值的肉类。按照本文建立的方法,对30批次熟肉制品进行掺假鉴别,具体结果详见表7。

表7 实际样品检测结果Table 7 Results of samples
本文利用建立的DNA微条形码技术,对30批次的高经济价值的熟肉制品进行掺假鉴定,其中包括18批次的牛肉制品、8批次的羊肉制品、2批次的兔肉制品、1批次的鸽子肉制品和1批次的鹅肉制品。样品经DNA提取和扩增,除了2批次的牛肉丸和2批次的羊肉丸,经凝胶电泳分离后均能得到清晰的条带,4个批次的肉丸没有条带,未检出肉或者羊肉成分。将PCR扩增产物送至生物公司进行克隆测序,结果发现1批次的牛肉干、1批次的牛肉串、1批次的牛肉酱以及1批次的羊肉串均检出鸭肉成分,而1批次的牛肉罐头、2批次的牛肉饼的馅料均检出猪肉成分。18批次牛肉制品中,有6批次为掺假猪肉或者鸭肉成分,2批次为未检出牛肉成分,不合格率为44%;8批次的羊肉制品中,有一批次检出鸭肉成分,2批次未检出羊肉成分,不合格率为38%;2批次的兔肉制品、1批次的鸽子肉制品以及1批次的鹅肉制品均未检测出掺假肉类;30批次的熟肉制品中,一共有7批次有掺假情况,4批次没有添加其所宣称的肉类,不合格率为37%。同时,为了验证本检测方法的可靠性,对上述7批次的掺假样品和4批次的肉丸产品采用农业部标准NY/T 3309-2018《肉类源性成分鉴定 实时荧光定性PCR法》进行验证,结果与本方法一致。从上述结果可以看到,两类高经济价值熟肉制品(牛肉和羊肉)的掺假率比较高,会掺入猪肉成分或鸭肉成分,由于在深加工过程中改变了其原有的肉的感官性状和添加食用油和盐等调料,不法商家还会加入一些添加剂(色素、香精香料等)等手段来掩饰掺入的其他低经济价值肉类,消费者很难用凭感官来辨别,也导致市售熟肉制品的掺假率居高不下。
3 结论
本文建立了基于COI的DNA微条形码技术对熟肉制品中的11种肉掺假鉴定方法,采用真空冷冻干燥技术对肉制品进行前处理,并优化了DNA提取和PCR扩增条件。样品经超声、-40 ℃冰箱进行预冷4 h处理后,于真空度低于1×10-4Pa,温度-50 ℃条件下真空冷冻干燥24 h。预处理后的样品经DNeasy血液与组织提取试剂盒提取和纯化后的DNA模板,采用引物COI-A 进行PCR扩增,目标扩增物经切胶纯化后进行克隆测序,并将测序结果提交GenBank数据库Blast比对。与其他检测技术相比,本方法更加简便、经济、高效,能够满足日常熟肉质量监督检测的需求。
