诺邓火腿加工过程中细菌群落的动态变化
2021-06-16王馨蕊刘毕琴雷永德汤回花张绍智张军军
王馨蕊,史 巧,*,刘毕琴,雷永德,汤回花,张绍智,张军军,李 宏,*
(1.云南省农业科学院农产品加工研究所,云南昆明 650000; 2.云南瑞通牧业科技开发有限公司,云南大理 671000)
诺邓火腿出产于云南滇西的千年白族古村诺邓村。火腿以当地散养猪为原料,用独特的井盐腌制[1],经过复杂的加工后,在当地温和的气候下经过至少10个月的发酵,形成了富有特色的诺邓火腿,其与宣威火腿、鹤庆圆腿并称为云南三大著名火腿。
在火腿成熟过程中微生物对风味的形成起着一定的关键作用[2],自然发酵火腿中微生物的群落组成和消长受气候及地域的影响,这也决定了火腿的特色。国内开展了金华火腿、云南火腿等微生物区系的研究[3-5],大部分是基于纯培养的方法,再利用微生物的形态学、生理生化特性或者测序进行鉴定,工作量相对较大,也容易遗漏一些不可培养的微生物,不能完整的反映火腿中微生物组成情况。下一代测序技术(next generation sequencing)作为一种高效的方法,在传统发酵食品微生物研究中已经有广泛运用[6]。运用高通量测序技术,能够更全面、真实的掌握发酵过程中微生物的种群结构和变化。
火腿中细菌多样性的研究,现多集中于不同年限成品火腿及其表面的微生物。党喜军[7]研究了不同年份的成品诺邓火腿,发现发酵3年的火腿较1、2和4年的样品表面细菌多样性更高,葡萄球菌属、嗜冷杆菌属、Solitalea和志贺氏菌属为优势细菌。郭明亮[8]对发酵4个月、2年的金华火腿和成品宣威火腿的细菌菌群进行分析,发现柠檬酸菌属、嗜冷杆菌属、库尔特氏杆菌属、葡萄球菌属、耶尔森氏菌属、魏斯氏菌属、乳杆菌属和芽孢杆菌属为主要菌群。母雨等[9]对来自3个不同地区的盘县火腿开展研究,发现成品盘县火腿中的优势细菌来自葡萄球菌属和盐单胞菌属。对于诺邓火腿各加工阶段内部细菌群落动态变化还未有报道。本研究通过MiSeq平台对诺邓火腿内部细菌测序,并测定火腿部分理化指标,分析比较诺邓火腿加工过程中不同阶段的细菌组成和变化,结合与各理化指标的关联性分析,以期为开发针对诺邓火腿特点的发酵剂提供依据和参考。
1 材料与方法
1.1 材料与仪器
诺邓火腿 原料来自当地传统工艺加工厂家;酚酞(C2OH14O4)、氢氧化钠(NaOH)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、谷氨酸(C5H9NO4)、茚三酮(C9H6O4)、铬酸钾(K2CrO4)、硝酸(HNO3)、硝酸银(AgNO3)、盐酸(HCl)、基准氯化钠(NaCl)、无水乙醇(CH3CH2OH) 均为国产分析纯试剂。
DHG-9140A鼓风干燥箱 上海一恒科学仪器有限公司;GYW-1W水分活度测定仪 深圳冠亚水分仪科技有限公司;AUY220电子天平 岛津制作所;XW-80A涡旋振荡器 上海精科实业有限公司;KQ5200E超声波清洗器 昆山市超声仪器有限公司;XMTD-7000电热恒温水浴锅 北京市永光明医疗仪器有限公司;3H16RI高速冷冻离心机 湖南赫西仪器装备有限公司;FiveEasy Plus pH计 梅特勒-托利多仪器(上海)有限公司;MULTISKAN GO酶标仪 Thermo Fisher Scientific。
1.2 实验方法
1.2.1 样品采集 选择十二支重量接近的洋三元猪后腿随机编号,并作统一处理和后续管理,在4个不同的加工时期以相同的方式在半膜肌部位取样,每个时间点取3支,取样阶段分别为腌制期(上3次盐后)、风干期(上挂48 d)、发酵期(上挂104 d)、成熟期(上挂278 d),相应的编号为S1、S2、S3、S4。用于理化性质测定的样品为半膜肌内部中心瘦肉;用于高通量测序的样品需灼烧半膜肌表面,在无菌操作下切取内部约1 g瘦肉,置于无菌冻存管中,-80 ℃保存备用。
1.2.2 理化性质测定 水分含量的测定参照GB 5009.3-2016《食品中水分的测定》中的直接干燥法。氯化物含量的测定参照GB 5009.44-2016《食品中氯化物的测定》中的直接滴定法。酸碱度的测定参照GB 5009.237-2016《食品pH的测定》。游离氨基酸含量的测定,以刘慧燕等[10]方法作为参考,略作调整后方法如下:反应体系为1 mL样品溶液+0.5 mL pH8.0的磷酸盐缓冲液+0.5 mL 2%茚三酮的溶液,反应液水浴加热15 min,冷却10 min后蒸馏水定容至25 mL,静置10 min,在570 nm处测定吸光度,以谷氨酸标准溶液绘制标准曲线,标准曲线方程为y=1.4933x-0.0801,R2=0.9968。以上理化指标均设三个重复,利用Excel 2010软件对测定结果进行统计分析,数据结果采用平均值±标准误差表示。
1.2.3 DNA抽提和PCR扩增 根据FastDNA® SPIN Kit for Soil(MP Biomedicals,Solon,OH,U.S.)说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA 浓度和纯度;使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因V3-V4可变区进行PCR扩增,扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存(PCR仪:ABI GeneAmp® 9700型)。PCR反应体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,补足ddH2O至20 μL。每个样本3个重复。

表1 诺邓火腿理化性质Table 1 Physicochemical properties of Nuodeng dry-cured ham
1.2.4 Illumina MiSeq测序 将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer(Promega,USA)对回收产物进行检测定量。使用NEXTFLEX® Rapid DNA-Seq Kit进行建库:a.接头链接;b.使用磁珠筛选去除接头自连片段;c.利用PCR扩增进行文库模板的富集;d.磁珠回收PCR产物得到最终的文库。利用Illumina公司的MiSeq PE300平台进行测序 上海美吉生物医药科技有限公司。
1.3 数据处理
使用fastp[11](https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使用FLASH[12](http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件进行拼接:
a.过滤reads尾部质量值20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的reads,去除含N碱基的reads。
b.根据PE reads之间的重叠区域(overlap)关系,将成对reads拼接(merge)成一条序列,最小overlap长度为10 bp。
c.拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列。
d.根据序列首尾两端的核苷酸标签(barcode)和引物区分样品,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2。
使用UPARSE[13]软件(http://drive5.com/uparse/,version 7.1),根据97%[13-14]的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier[15](http://rdp.cme.msu.edu/,version 2.2)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(v138),设置比对阈值为70%。
2 结果与分析
2.1 诺邓火腿加工过程中理化性质的变化
诺邓火腿在四个时期主要理化指标结果见表1。含水量随着发酵的进行,总体呈下降趋势。风干期(S2)空气比较干燥,含水量下降较快。5月雨水较多,空气湿度大,发酵期(S3)的火腿含水量有小幅增加[16]。经过9个多月的发酵后,火腿中的含水量最终降到33.40%左右。已有的研究发现诺邓火腿成品腿的含水量在30.66%~35.22%左右[7,17]。缪婷等[18]研究发现经过9个月发酵的云腿,含水量为43.45%。李泽众等[19]对三川火腿的研究显示,第320 d时火腿中的水分含量为44.27%。总体上看,诺邓火腿半膜肌部位相较于云南其他地域的火腿,含水量偏低。
腌制期盐含量较低,盐含量约为4.95%。随着火腿不断失水,盐含量相应地升高,在风干期达到7.21%。雨季来临后,含水量的增加稍微降低了火腿中盐含量,成熟期的火腿盐含量在6.7%。食盐含量在1%~3%时可以抑制一些微生物的生长,当达到10%~15%的含盐量时,只有少部分耐盐微生物能够生长。高盐含量的火腿虽然不易变质,但是由于内源酶和微生物受到抑制也不会产生火腿特有的香味[20]。并且摄入过多的氯化钠会对人的心血管健康造成影响[21]。缪婷等研究的云腿盐分含量为9.62%[18],发酵12个月的宣威火腿盐含量为10.97%[22],15个月的大河乌猪火腿食盐含量为10.05%[23],诺邓火腿较其他品类的火腿含盐量比较适中。
火腿的酸碱度在各个时期各有不同。腌制期pH较低,风干期由于蛋白质水解产生的碱性物质[4,24],pH增加至6.10。发酵期可能由于温度较高,产酸细菌大量繁殖和代谢,酸碱度有一定幅度的降低,适当的酸化可以产生一些风味上的变化[25]。随着火腿的不断发酵成熟,pH呈现上升的趋势,成熟期达到6.05左右,与党喜军测定的1年诺邓火腿pH基本一致[7]。其他品类的火腿pH基本在5.58~6.75之间[18,22,26-27]。
诺邓火腿中的游离氨基酸含量,随着时间的推移不断增加,成熟期增加速度较快,9个多月后达到了1862.33 mg/100 g。蛋白质水解可产生大量小肽和游离氨基酸,火腿中的非蛋白氮70%~80%为多肽氮和氨基酸态氮[28]。游离氨基酸本身是火腿中重要的滋味物质和营养成分,一些特定的氨基酸形成挥发性香气的前体物质,氨基酸与其他化合物参与美拉德反应可以产生小分子香气成分[29]。根据现有报道,一年左右的火腿游离氨基酸含量在1.97%~3.67%[7,19],与本实验当年腌制的不足一年火腿蛋白质降解趋势吻合。
2.2 测序结果及Alpha多样性
分别对4个不同加工阶段,共12个诺邓火腿样本内部的细菌16S rRNA V3-V4区域进行扩增,获得有效序列数目为587967 reads,有效碱基251376192 bp,序列平均长度约为428 bp。由于不同样本具有个体差异性,为使各样本在相同OTU序列数水平上进行对比,保留至少在3个样本中的序列数都大于等于5的OTU,按最小样本序列数将所有样本的序列随机抽取至统一数据量,
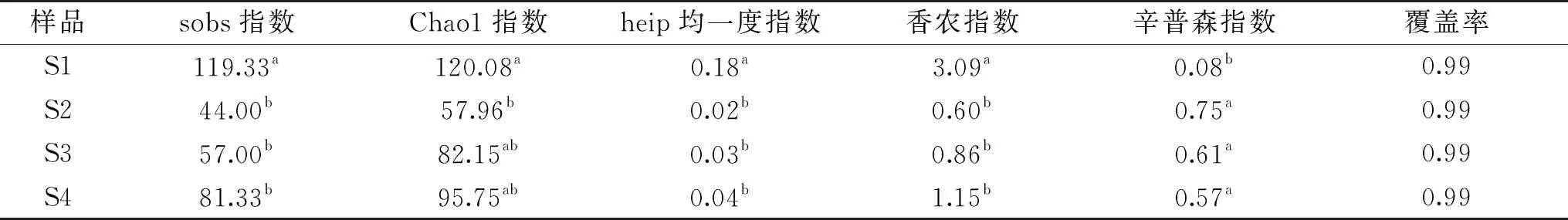
表2 Alpha多样性指数表Table 2 Alpha diversity index
抽平后各样本有效序列数为31426,有效序列总数为377112。4个时期的12个样本细菌分类统计数目为7门,11纲,25目,47科,83属,130个OTU。
通过统计随机抽取的序列对应样本的Alpha多样性指数,绘制出稀释曲线,若曲线较为平缓,则本次测序数据量是足够的[30]。图1为基于丰富度实际观测值sobs指数的稀释曲线,曲线已达到平台期说明测序量充足,大部分多样性已经产生,继续增加测序量也很少有新物种出现。
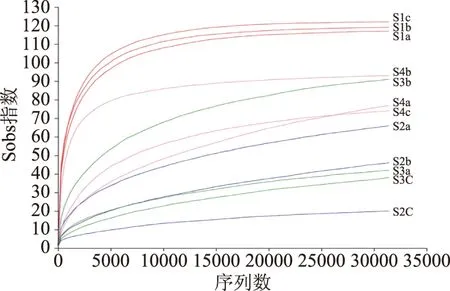
图1 稀释曲线Fig.1 Rarefaction curves
各个阶段内火腿中微生物群落的多样性可以通过Alpha多样性来反映,常用sobs指数、Chao1指数、heip均一度指数、香农指数、辛普森指数等来计算和比较[31]。不同时期诺邓火腿中细菌群落的Alpha多样性在表2中表示,其中sobs指数、Chao1指数用来反映群落的丰富度,heip均一度指数用来反映群落的均一性,群落多样性则通过香农指数、辛普森指数、覆盖率等来表示。S1的细菌丰富度最高,S4次之,S2和S3较低。S1的细菌群落分布最均匀。通过香农指数、辛普森指数发现S1的多样性最高,S4多样性较高,S2、S3多样性明显低于S1、S4。
2.3 物种组成
对于火腿加工过程中内部的细菌,已有研究者通过传统培养的方式发现其总体变化趋势。大体上从腌制期至风干期菌落总数持续上升,从约102CFU/g增加至106CFU/g,在发酵期初期达到峰值,之后不断减少,到成熟期只有约10CFU/g的细菌被培养出来[4,5,32-33],但对于考察火腿成品食用安全性有重要意义。在前人对细菌数量变化研究的基础上,通过高通量测序方法更为全面的检测,有助于进一步了解加工过程中诺邓火腿内部细菌多样性及其演变规律。
2.3.1 物种组成Venn图分析 由OTU水平上的Venn图(图2)可以看出,4个不同时期的火腿微生物有61个共有OTU,其中相对丰度最高的5个属为葡萄球菌属(Staphylococcus)、嗜冷杆菌属(Psychrobacter)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)和希瓦氏菌属(Shewanella),这些微生物属于厚壁菌门及变形菌门,其他还包括气单胞菌属(Aeromonas)、罗尔斯通菌属(Ralstonia)和弧菌属(Vibrio)等38个属的细菌,为诺邓火腿整个发酵过程中均有出现的微生物。每个时期的特异性OTU数目较少,S1有1个,为Weeksellaceae科细菌;S4有4个,分别为沙雷氏菌属(Serratia)、棒状杆菌属(Corynebacterium)、四联球菌属(Tetragenococcus)和Enteractinococcus属细菌。由于发酵进行至S2、S3时期时细菌群落多样性较低,S1与S2、S2与S3、S3与S4时期之间共有,且其余时期不具有的OTU数目均较少,分别为1、2、1;而S1、S4由于多样性较高,两者之间的共有OTU有24个。

图2 OTU水平物种组成Venn图Fig.2 Venn diagram on OTU level 注:S1、S2、S3、S4分别为腌制期、风干期、 发酵期、成熟期;数字代表OTU数目。
2.3.2 门水平的群落组成 S1、S2、S3、S4四个时期在门水平上的群落组成如图(图3)。4个时期的主要优势菌有厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)。占比最高的2个门在4个时期的相对丰度依次为厚壁菌门:S2>S3>S4>S1,变形菌门:S1>S4>S3>S2。腌制期(S1)主要由变形菌门微生物组成,相对丰度约92%;风干期(S2)和发酵期(S3)主要由厚壁菌门及变形菌门组成,两个时期的厚壁菌门相对丰度分别为94%、92%,变形菌门相对丰度分别为6%、8%,随着发酵的进行,厚壁菌门微生物占比逐渐减少,而变形菌门微生物相对增多;成熟期(S4)微生物组成相对复杂,有厚壁菌门(37%)、变形菌门(61%)及放线菌门(3%),相对于发酵期,成熟期的变形菌门微生物增加,厚壁菌门微生物明显减少。

图3 门水平的群落组成条形图Fig.3 Community bar plot analysis on phylum level

图4 属水平的群落组成热图Fig.4 Community heatmap on genus level
2.3.3 属水平的群落组成 选取4个时期丰度在前50的属,绘制群落组成heatmap(图4)。各时期火腿中细菌在属水平上的组成形式存在明显差异,根据各属在4个时期丰度的相似性进行聚类,可以聚为5个大类。第Ⅰ类由葡萄球菌属(Staphylococcus)、沙雷氏菌属(Serratia)和罗尔斯通菌属(Ralstonia)3个属组成,这3个属在S4阶段相对丰度很高,其中葡萄球菌属在火腿加工的各个阶段较其他2个属细菌有较高丰度,与已有研究结果一致,葡萄球菌属细菌为火腿中最常被检测到高丰度的细菌[2,8-9]。葡萄球菌属是火腿发酵中重要的细菌,这类细菌含有硝酸盐还原酶和亚硝酸盐还原酶,能够促进肉质形成理想的红色,并且在蛋白水解酶和脂肪酶作用下能够增加产品风味,防止脂质氧化和酸败[34-35]。成熟的盘县火腿中也检测到少量丰度的Ralstonia[9],这类细菌可能参与构成火腿成熟期独特细菌群落。第Ⅱ类在各个时期均有较高丰度,在S1时期分布最集中,由嗜冷杆菌属(Psychrobacter)、气单胞菌属(Aeromonas)、希瓦氏菌属(Shewanella)、假单胞菌属(Pseudomonas)和不动杆菌属(Acinetobacter)组成。传统分离培养的方法一般认为在腌制期的火腿优势细菌为葡萄球菌、乳酸菌和假单胞菌,高通量测序的方法发现了在腌制期火腿内部其他高丰度细菌种类。这类细菌在发酵肉制品中较为常见,董蕴等[36]发现恩施腊肉中嗜冷杆菌属、不动杆菌属等细菌也很丰富。第Ⅲ类为相对丰度中等,且分布较均匀的属。第Ⅳ类为相对丰度稍低的一类,在S1、S4分布较S2、S3稍高,种类比较丰富。第Ⅴ类为S4时期丰度稍高,但在其他阶段丰度较低的细菌,包括Cutibacterium、考克氏菌属(Kocuria)、四联球菌属(Tetragenococcus)等属的细菌。
2.4 不同阶段样本比较
在OTU水平上,根据Bray-Curtis距离算法得到Beta多样性距离矩阵,利用非加权组平均法(Unweighted Pair-group Method with Arithmetic Mean,UPGMA)对4个时期的不同样本进行层级聚类(Hierarchical clustering),可以清楚地看出样本间群落结构的相似或差异程度(图5)。S4时期的两个样本聚为一类,成熟期的火腿微生物群落不同于其他3个时期,但组内平行样本仍存在个体差异性,近期另一诺邓火腿研究也发现成熟腿平行样本之间存在一定细菌组成差异性[7]。S1时期样本单独聚成一类,可见腌制期火腿组内样本的细菌群落组成相似性很高,并且与其他3个时期相比较为独特。S2与S3两个时期的细菌群落相似性较高。外部环境及火腿内部理化条件的不同可能是差异发生的原因,腌制期火腿内部含水量高,适合多种微生物的生长,细菌群落较其他3个时期丰富;风干期含水量逐步降低,盐浓度增加,只适合一部分细菌生存;发酵期火腿内部环境与风干期类似,但由于空气湿度的变化,火腿内部细菌群落会产生部分差异;成熟期内部细菌数量已经较少[32],但环境温度较高,内部细菌组成较前面的加工阶段有所不同,而且由于内部复杂的理化环境影响,各个样本之间也会产生不同的变化。

图5 基于OTU水平的样本层级聚类树Fig.5 Hierarchical clustering tree based on OTU level

图6 诺邓火腿理化性质与细菌群落相关性分析Fig.6 Correlation analysis between physicochemical properties and bacterial community of Nuodeng dry-cured ham注:A:属水平上的冗余分析;B:丰度前10的属与理化性质关联热图;W代表含水量、S代表盐含量、 AA代表游离氨基酸含量、pH代表酸碱度;* 0.01 冗余分析(Redundancy Analysis,RDA)是环境因子约束化的PCA分析,可以将样本和环境因子反映在同一个二维排序图上,从图6A中可以直观地看出样本分布和环境因子间的关系。图6A中代表含水量(W)、盐含量(S)的环境因子箭头长度最长,表示水分和盐含量对于不同时期样本细菌群落组成的影响程度最大;游离氨基酸含量(AA)次之;样品酸碱度(pH)影响较小。将各环境因子变量射线延长,4个加工时期各样本垂直投影于射线上,投影点越靠近箭头所指方向的样本,受环境因子的影响越大。分析发现含水量对腌制期(S1)样本影响最大;含盐量对风干期(S2)和发酵期(S3)影响最明显;样品酸碱度和游离氨基酸含量与成熟期(S4)细菌群落结构关联性最大。 通过计算4个环境因子与丰度最高的10个属之间的spearman等级相关系数,获得数值矩阵,绘制出heatmap。从图6B中可以看出有4个属与环境因子之间有显著相关关系。葡萄球菌属(Staphylococcus)与含盐量显著正相关,其在4个阶段的相对丰度占比依次为S2(94%)>S3(86%)>S4(47%)>S1(1.7%),伴随着火腿失水,盐含量的增加一定程度上增加了葡萄球菌在火腿微生物群落中的数量。以葡萄球菌为代表的凝固酶阴性球菌(CNC,Coagulase-negative cocci)是火腿中经常被报道的优势菌,在帕尔马、伊比利亚火腿中也较为常见。在腌制前期,帕尔马火腿内部以革兰氏阴性菌(55%)占据主导,25 d后CNC成为优势菌,并且一直保持至211 d,一年后丰度有所下降但仍为主要的细菌组成部分[27]。诺邓火腿内部细菌群落的演替与其规律相符,提示在干腌火腿加工过程中CNC作为普遍存在的原生菌发挥了特定作用,现已被广泛用于肉制品发酵[37]。气单胞菌属(Aeromonas)与含水量显著正相关,这个属的相对丰度占比在4个时期中S1最高,腌制期较多的水分可能有利于该属的分布。嗜冷杆菌属(Psychrobacter)、希瓦氏菌属(Shewanella)2个属与游离氨基酸含量极显著负相关,游离氨基酸含量在S4阶段达到较高水平,该阶段这2个属的细菌占比相较于其他阶段低。 本研究通过高通量测序方法对诺邓火腿4个不同加工阶段的细菌群落进行了分析,更为高效、全面的反映了其动态变化,发现腌制期的细菌多样性最高,成熟期多样性较高,风干期和发酵期多样性相对较低,同时腌制期细菌的丰富度和均一性也是最高的。火腿发酵过程中厚壁菌门、变形菌门、放线菌门、拟杆菌门等细菌为优势菌群。4个加工阶段共有的61个OTU主要由葡萄球菌属、嗜冷杆菌属、假单胞菌属、不动杆菌属及希瓦氏菌属等43个属的细菌组成,为诺邓火腿发酵发酵过程中均有出现的菌群。腌制期细菌物种比较丰富,与其他3个时期差异较大,风干和发酵期物种组成最相似。整个加工过程中丰度占比最高的为葡萄球菌属,其在腌制初期不占优势,从风干期开始成为优势菌群,随着发酵的进行又逐渐缓慢减少。对诺邓火腿理化指标的分析发现火腿中的含水量总体为下降趋势,最终达到约33.4%,较其他种类火腿偏低;通过关联性分析发现含水量对腌制期细菌群落影响最大。随着火腿不断失水,含盐量呈上升趋势,成熟期的诺邓火腿含盐量约为6.7%,与云南其他火腿相比含盐量较为适中;含盐量对风干期和发酵期菌群组成影响最明显,在这两个时期丰度占比最高的葡萄球菌属与含盐量显著正相关。成熟期的菌群结构与火腿酸碱度及游离氨基酸含量关联度最大,这个时期的酸碱度为6.05左右,与其他火腿基本一致,游离氨基酸含量在这一阶段增长较快,发酵9个多月后达到1.86%。传统火腿加工过程中主要通过观察外部霉菌的生长情况来判断产品质量,而细菌不能直接被观察到。干腌火腿是我国重要的发酵肉制品,利用二代测序技术研究其内部细菌的报道相对较少,研究尚不充分,研究对象也大多为成品火腿,加工过程中细菌的组成和变化有必要加以探索。诺邓火腿是云南重要的特色食品,其加工过程中内部的细菌动态变化是首次报道。为满足现代多样化饮食的需求,成品火腿被用于生食,成熟期细菌的组成为保证其食品安全提供了参考。 在诺邓火腿的自然发酵过程中,腌渍和失水作用初期细菌种类丰富,主要有嗜冷杆菌属、假单胞菌属、希瓦氏菌属等细菌,但大部分属于食品加工中不希望出现的微生物。随着发酵进行,发酵肉制品中的常见有益菌[38]葡萄球菌占比持续增加,而杂菌不断减少。在腌制期加入适合的发酵剂,可以有效抑制杂菌的生长,降低卫生风险,保证产品品质标准化[39]。干腌肉制品的味道是火腿组织中的大分子在各种酶和非酶作用下分解后产生的,风味的形成一般分为两个阶段,第一阶段是在腌制期、风干期和发酵前期发生的自然氧化,而第二阶段是在发酵后期及成熟期发生的微生物次生代谢,特别是氨基酸的分解代谢[27]。CNC是肉制品发酵中主要的原生微生物群体[38],也是发酵肉制品工业上常用的发酵菌种。其能够适应一定浓度氯化钠、硝酸盐存在的环境,在发酵过程中可迅速占据主导地位,通过参与蛋白水解和脂肪降解,影响产品最终的风味品质。诺邓火腿自然发酵过程中出现的CNC为研究者今后在发酵剂的选择上提供了重要依据,特别是筛选那些很好地适应了火腿发酵条件的菌株。在加工过程中,研究者们可以通过掌握的诺邓火腿内部细菌总体变化信息,设计原生菌种发酵剂,形成优势菌落,促进产品风味的标准化。已有研究者筛选出了如木糖葡萄球菌、马胃葡萄球菌等有利于火腿品质形成菌种为发酵剂[39],产生的产品具有良好的色泽和风味。为了提高诺邓火腿生产效率、保证产品质量,利用火腿中具有良好功能特性的原生菌种,研究其对产品安全性、风味品质的影响,开发特色菌种发酵剂是下一步研究的方向。2.5 理化性质与样本关联性
3 结论与讨论
