酯化型红曲菌复合诱变选育及其固态发酵条件优化
2021-06-16赵志军刘延波葛少华潘春梅孙西玉
赵志军,赵 婷,3,刘延波,刘 宁,葛少华,潘春梅,孙西玉,5,*
(1.河南牧业经济学院食品与生物工程学院(酒业学院),河南郑州 450046; 2.河南牧业经济学院河南省白酒风格工程技术研究中心,河南郑州 450046; 3.湖北工业大学生物工程与食品学院,湖北武汉 430068; 4.宝丰酒业有限公司,河南平顶山 467500; 5.河南张弓老酒酒业有限公司,河南商丘 476733)
中国白酒作为我国传统的发酵食品,是最古老的蒸馏酒之一[1-2],在世界享有盛誉[3]。白酒中的微量成分众多[4],这些微量成分在各种白酒中的含量和比例不同,导致了白酒香型和风格的多样性。在白酒微量成分中,酯类含量最多且对白酒影响最大,是组成白酒香味的主要物质[1,5]。
红曲菌(Monascussp.)又叫红曲霉[6],是我国传统的药食两用微生物资源[7]。红曲菌的用途十分广泛,在酿酒[8-9]、食品加工[10]、色素合成[11]及药物制备[12]等领域均有重要应用价值。红曲菌在生长代谢过程中能产生酯化酶、淀粉酶、蛋白酶等多种酶类,其酯化酶可以催化己酸乙酯、乙酸乙酯等白酒中香味物质的形成[13-15]。从中国白酒酿造大曲中分离出酯化型红曲霉,并进一步提升其产酯化酶能力,对白酒品质提高非常有意义。
目前,菌种改良的遗传策略有随机诱变、杂交育种和基因工程技术等手段[16-17],其中随机诱变育种具有简单、快速、有效等优点,被广泛应用于发酵工业菌种的选育[18]。物理诱变因操作简单、易于环保及对人体伤害小等优点得到广泛应用[19]。常压室温等离子体(Atmospheric and Room Temperature Plasma,ARTP)诱变育种技术是利用等离子体射流中富含的化学活性粒子直接作用于细胞遗传物质,从而引发多类形式的DNA损伤,产生突变菌株[20]。同时该方法具有无污染和操作安全简单的优点,在微生物育种和生物医学等领域应用广泛[21]。紫外(Ultraviolet,UV)诱变利用紫外线辐射微生物DNA分子,形成嘧啶二聚体影响碱基的正常配对,从而引起突变[22]。该方法因其设备简单、易于操作,是最为常用的菌种诱变手段。一般认为复合诱变具有协同作用,其效果会比单一诱变效果更好[23]。
本研究以前期从酿酒大曲中分离获得的红曲菌为出发菌株进行UV-ARTP复合诱变,筛选高产酯化酶的突变菌株,采用单因素实验确定各因素对菌株产酯化酶能力的影响,选取显著性较强的因素进行响应面优化,以期得到高酯化力的红曲菌并探索其最佳培养条件,为白酒品质的提高提供优良菌株来源及应用基础。
1 材料与方法
1.1 材料与仪器
三株红曲菌(N1,N2,N3) 河南牧业经济学院河南省白酒风格工程技术中心从大曲中分离并保藏;马铃薯,麸皮、稻壳 市售;氯化钠、乙醇、己酸 分析纯,国药集团化学试剂有限公司;三丁酸甘油酯(分析纯)、己酸乙酯(色谱纯)、乙酸正戊酯(色谱纯) 上海麦克林生化科技有限公司;斜面固体培养基:将200 g马铃薯(去皮)切成小块,加入1000 mL蒸馏水,煮沸30 min,纱布过滤,然后加入20 g葡萄糖及20 g琼脂,加热搅拌溶解,补足水分至1000 mL,自然pH,121 ℃灭菌20 min;筛选培养基[24]:马铃薯(去皮)20%,蔗糖2%,三丁酸甘油酯0.4%,琼脂2%,自然pH,121 ℃灭菌20 min;固态基础发酵培养基:25 g的麸皮调整含水率为65%装入250 mL三角瓶,121 ℃灭菌30 min。
磁力搅拌器 江苏环宇科学仪器厂;LDZX-50KBS立式高压灭菌锅 上海申安医疗器械厂;GH-500隔水式培养箱 北京科伟永兴仪器有限公司;SW-CJ-2F型双人双面净化工作台 苏州净化设备有限公司;DHG-9076A电热恒温鼓风干燥箱 上海龙跃仪器设备有限公司;ARTP-IIS常压室温等离子体诱变育种仪 洛阳华清天木生物科技有限公司;Agilent 7890A气相色谱仪 安捷伦科技有限公司。
1.2 实验方法
1.2.1 初始菌株酯化酶活力测定 将三株初始菌株分别接种至斜面固体培养基中,28 ℃活化制成孢子悬浮液。按4%的比例将孢子悬浮液分别接种于固态基础发酵培养基,放置于28 ℃恒温培养箱中,每24 h摇瓶一次,培养6 d。成熟后,将固态基础培养基倒于已灭菌的牛皮纸上于鼓风干燥箱中35 ℃快速烘干,密封袋保存。
采用气相色谱法测定红曲菌麸曲酯化力[25]的方法。酯化力(以己酸乙酯计)定义为:1 g干曲粉在30 ℃反应100 h所产生的己酸乙酯毫克数,单位为mg/(g·100 h),以U/g表示。
1.2.2 诱变方法
1.2.2.1 孢子悬液的制备 选取酯化酶活力较高的菌株作为初始菌株,接种于试管斜面上,28 ℃活化培养7 d。向菌种斜面中加入适量无菌生理盐水,用无菌接种环轻轻刮洗孢子,倒入已灭菌并装有玻璃珠的三角瓶中,用玻璃珠将孢子充分打散。用血球计数板测定,用无菌生理盐水稀释孢子浓度至106个/mL,制得诱变用孢子悬液。
1.2.2.2 UV-ARTP复合诱变 将30 W紫外灯预热20 min,将装有孢子悬液的培养皿放到磁力搅拌器上,调节其与灯管垂直距离为30 cm,打开皿盖紫外照射,分别选择照射处理时间为0、30、60、90、120、150 s。结束后,避光稳定10 min,用移液枪取出被照射的孢子悬液0.1 mL,梯度稀释后,涂布至筛选培养基上,将平板倒置于28 ℃恒温箱中培养6 d,计数并测定单个菌落的透明圈直径(D)与菌落直径(d)[26]。
将紫外诱变后D/d值大的菌株制成孢子悬液,取10 μL均匀涂抹在金属菌物载片表面,用镊子将菌物载片转移到载物台,设定参数在工作气流量为10 L/min,等离子体发射源与样品距离为2 mm,操作温度由26 ℃逐步上升并稳定至35 ℃的条件下,分别处理20、35、50、65、80、95 s,处理后将载片转移到装有1 mL生理盐水的EP管中,振荡洗脱形成新的菌悬液。将诱变后和未诱变的菌悬液分别取0.1 mL稀释适当梯度涂布于筛选培养基上,培养6 d后观察菌落形态特征。采用平板活菌计数法来计算诱变致死率[27]。
1.2.3 筛选方法
1.2.3.1 突变菌株的初筛 将诱变后菌株接种至筛选培养基,平板倒置于28 ℃恒温培养箱中培养6 d。观察菌落周围出现的透明圈大小和菌落颜色的变化,并测量D/d值,选择其比值大且菌落直径也比较大及颜色深的菌落进行菌株纯化,划线至斜面培养基,备用。
1.2.3.2 突变菌株的复筛 突变菌株酯化酶活力的测定,见1.2.1。
1.2.4 遗传稳定性实验 将UV-ARTP复合诱变处理后筛选得到的高产酯化酶红曲菌突变菌株转接至斜面固体培养基中,在28 ℃恒温条件下培养6 d,连续传代5次,分别在固态基础培养基中培养并测定其酯化酶活力,验证此突变菌株产酶活力的稳定性。
1.2.5 单因素实验
1.2.5.1 接种量对菌株酯化力的影响 固态基础发酵培养基中分别接入2%、3%、4%、5%、6%的孢子悬液于250 mL三角瓶,在28 ℃条件下培养6 d,每批做3个平行,测定酯化力。
1.2.5.2 含水量对菌株酯化力的影响 分别为60%、65%、70%、75%、80%含水量的固态基础发酵培养基,接入4%的孢子悬液于250 mL三角瓶,在28 ℃条件下培养6 d,每批做3个平行,测定酯化力。
1.2.5.3 温度对菌株酯化力的影响 固态基础发酵培养基中接入4%的孢子悬液于250 mL三角瓶,分别在24、26、28、30、32 ℃条件下培养6 d,每批做3个平行,测定酯化力。
1.2.5.4 培养时间对菌株酯化力的影响 固态基础发酵培养基中接入4%的孢子悬液于250 mL三角瓶,在28 ℃条件下分别培养4、5、6、7、8 d,每批做3个平行,测定酯化力。
1.2.5.5 稻壳添加量对菌株酯化力的影响 分别添加0、4%、8%、12%、16%的稻壳至固态基础发酵培养基,接入4%的孢子悬液于250 mL三角瓶,在28 ℃条件下培养6 d,每批做3个平行,测定酯化力。
1.2.6 响应面优化固态发酵条件 在单因素实验的基础上选取接种量(A)、含水量(B)、培养时间(C)3对红曲菌发酵产酯化酶影响显著的为自变量,以酯化酶活力为响应值(Y)利用Design-Expert 8.0.6软件,根据Box-Behnken中心组合试验设计原理,设计三因素三水平响应面试验,试验因素与水平见表1,确定最优的固态发酵条件并进行试验验证[28]。
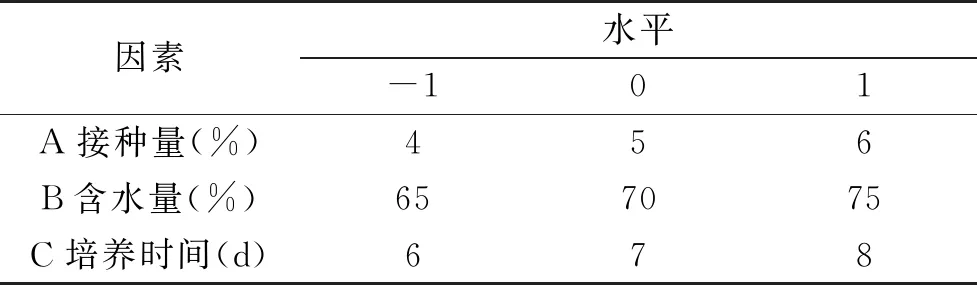
表1 Box-Behnken试验因素与水平Table 1 Box-Behnken test factors and levels
1.3 数据处理
利用Design-Expert 8.0.6和Excel 2016软件对数据进行处理分析。
2 结果与分析
2.1 初始菌株酯化酶活力测定
对三株初始红曲菌酯化酶活力的测定,结果见表2。

表2 三株初始红曲菌酯化酶活力Table 2 3 strains of initial Monascus esterification
由表2可知,N3红曲菌的酶活力相对较高,为19.76 U/g。以该菌株作为出发菌株,进行复合诱变选育高产酯化酶的红曲菌菌株。
2.2 UV-ARTP复合诱变
2.2.1 UV-ARTP分别诱变红曲菌 UV-ARTP分别诱变红曲菌致死率与时间的关系见图1。

图1 UV-ARTP分别诱变菌株致死率与时间的关系Fig.1 Relationship between lethality and time of UV-ARTP mutagenic strains注:a为UV诱变,b为ARTP诱变。
由图1可以看出,随着诱变时间的延长,菌株致死率在上升。当UV诱变时间为90 s时致死率为87.35%;当ARTP诱变时间为50 s时致死率为81.42%。一般认为致死率在80%~90%效果好且有利于正突变型菌株的产生,因此选择UV处理90 s及ARTP处理50 s为最佳诱变时间。
2.2.2 UV-ARTP复合诱变红曲菌 采用最佳诱变时间对红曲菌进行复合诱变,以菌株N3作为出发菌株,经过UV处理90 s后涂布于筛选培养基上,暗条件下28 ℃培养6 d,从中挑选出一株D/d值最大的突变菌株Y4再经ARTP处理50 s,稀释涂布于筛选培养基上,28 ℃培养6 d。对45株突变株测定其D/d值以及酯化酶活力,部分菌株测定结果见表3。

表3 UV-ARTP复合诱变结果Table 3 UV-ARTP complex mutagenesis results
由表3可知,UV-ARTP复合诱变对提高红曲菌产酯化酶活力效果较显著。其中突变菌株Z14酯化酶活力最高,为44.90 U/g。
2.3 突变菌株的遗传稳定性实验
对Z14进行连续传代,测定其酯化酶活力,见图2。
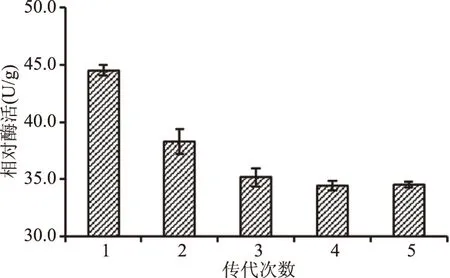
图2 突变菌株Z14的遗传稳定性Fig.2 Genetic stability of mutant strain Z14
由图2可知,Z14经过连续传代5次中,产酯化酶活力呈现先降低后趋于稳定的趋势,稳定后Z14酯化酶活力为34.44 U/g,较出发菌株提高了74%。此时,Z14遗传性能比较稳定,可选择该菌株作为继续研究的菌株。
2.4 单因素实验结果
2.4.1 接种量对菌株酯化力的影响 接种量对红曲菌发酵产酯化酶活力的影响见图3。随着接种量的增加,菌株产酯化酶活力呈现出先升高后降低的趋势。当接种量为5%时酯化酶活力最高,为33.98 U/g。接种量过大,营养、溶解氧等不能满足菌体的生长需要,产酯化酶活力下降。因此接种量5%为菌株培养基最适的接种量。响应面试验接种量选取的水平为:4%、5%、6%。

图3 不同接种量对菌株酯化力的影响Fig.3 Effect of different inoculation rates on the esterification power of the strain
2.4.2 含水量对菌株酯化力的影响 培养基含水量对红曲菌发酵产酯化酶活力的影响见图4。随着固态基础培养基中水分的增加,菌株产酯化酶活力呈现出先升高后降低的趋势。当含水量为70%时产酯化酶活力最高,为34.66 U/g。培养基水分含量过低,不利于菌株生长和发酵产酶;过高则导致培养基结块,不能充分散热和通氧,也不利于酶活力的积累。因此含水量70%为菌株培养基最适的含水量。响应面试验含水量选取的水平为:65%、70%、75%。

图4 不同含水量对菌株酯化力的影响Fig.4 Effect of different water contents on the esterification power of the strains
2.4.3 温度对菌株酯化力的影响 培养温度对红曲菌发酵产酯化酶活力的影响见图5。随着培养温度的升高,菌株产酯化酶活力呈现先升高增加后降低的趋势。当培养温度为28 ℃时产酯化酶活力最高,为36.01 U/g。培养温度过高,菌株生长受到抑制,同时也会使酶较快失活,不利于产酶及酶活力的积累。因此28 ℃为菌株最适的培养温度。

图5 不同温度对菌株酯化力的影响Fig.5 Effect of different temperatures on the esterification power of the strain
2.4.4 培养时间对菌株酯化力的影响 培养时间对红曲菌发酵产酯化酶活性的影响见图6。随着培养时间的增加,菌株产酯化酶活力呈现出先升高后降低的趋势。培养时间为7 d时产酯化酶活力最高,达到33.44 U/g。随着培养时间延长,后期会产生一些有害代谢产物,不利于菌种的生长和代谢。因此7 d为菌株最适的培养时间。响应面试验培养时间选取的水平为:6、7、8 d。

表5 响应面回归方程的方差分析Table 5 Analysis of variance of response surface regression equation
2.4.5 稻壳添加量对菌株酯化力的影响 稻壳添加量对红曲菌发酵产酯化酶活性的影响见图7。随着稻壳添加量的增加,菌株产酯化酶活力呈现先升高后降低的趋势。当稻壳添加量为4%时产酯化酶活力最高,为31.76 U/g。稻壳添加量过多,培养基疏松度越大,碳源、氮源含量降低,不利于菌体的生长及发酵产酶。因此稻壳添加量4%为菌株最适的稻壳添加量。
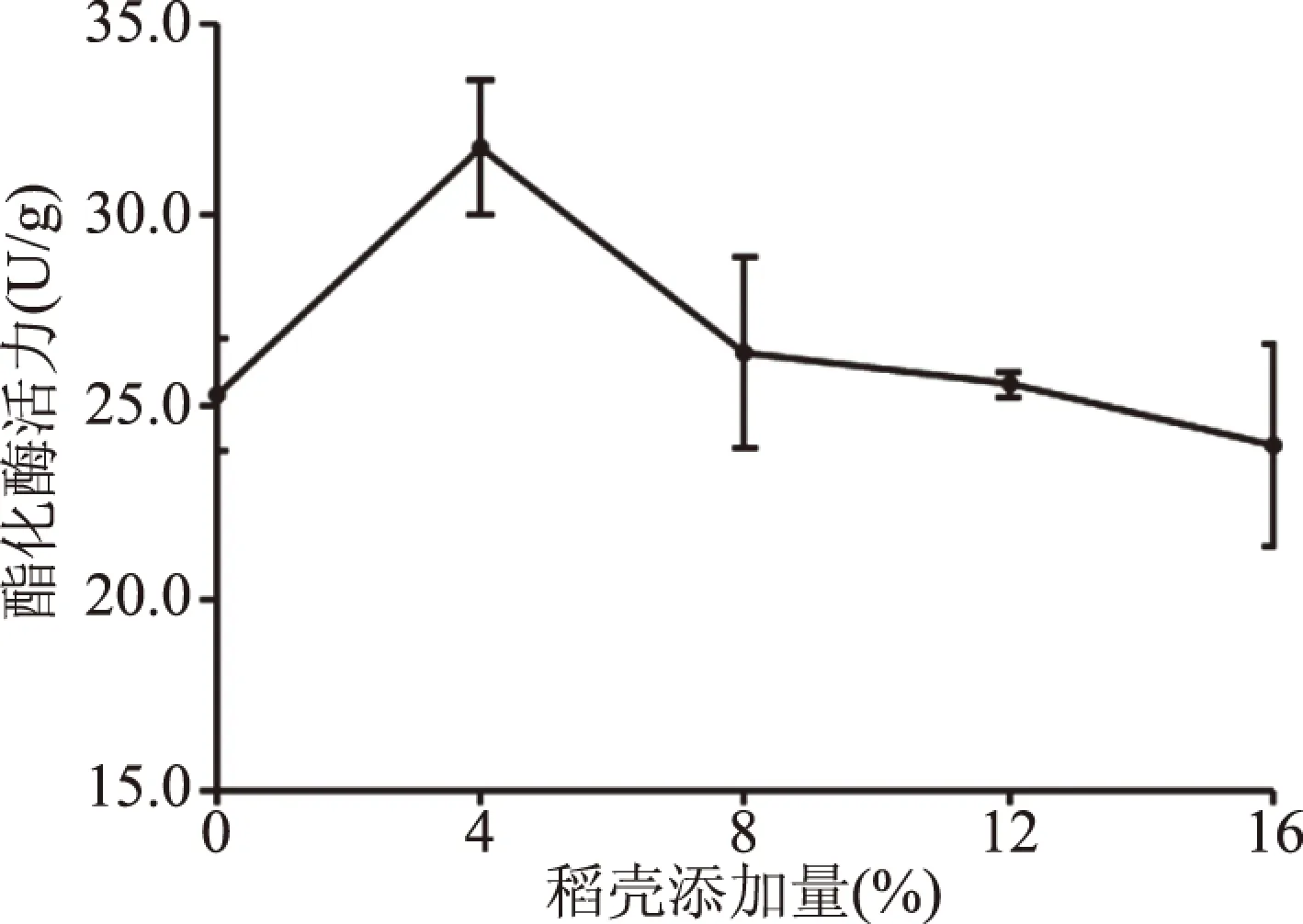
图7 不同稻壳添加量对菌株酯化力的影响Fig.7 Effect of different rice husk additions on the esterification power of the strains
2.5 响应面试验结果
2.5.1 Box-Behnken试验结果 响应面试验结果见表4。

表4 Box-Behnken试验设计与结果Table 4 Box-Behnken test design and results

图8 各因素交互作用的响应面和等高线图Fig.8 Response surface and contour plots of the interaction of various factors
2.5.2 回归模型的建立及其显著性检验 利用Design-Expert 8.0.6软件对表4的实验结果进行多元二次回归拟合,回归方程的方差分析结果见表5。
由表5可知,回归模型F值为34.64,且显著性检验为极显著(P<0.0001),失拟项不显著(P=0.3611>0.05),可知该模型可靠。
2.5.3 各因素交互作用的响应面图 利用Design-Expert 8.0.6软件对二次响应面回归模型做出相应的响应曲面。由回归模型绘制的响应面图,见图8所示。
响应曲面图可以直观的反映出两因素交互作用对响应值的影响。由图8可知,接种量和含水量、接种量和培养时间、含水量和培养时间三种交互组合的响应面等高线排列稀疏,说明此三种交互作用对响应值的影响不显著。
2.5.4 最佳发酵条件的确定及验证 从上述回归模型中求得最佳固态发酵条件为:接种量为5.09%、含水量为70.31%、培养时间为7.31 d。此条件下,模型预测值酯化酶活力为37.70 U/g。考虑到实际情况,调整条件为:接种量为5%、含水量为70%、培养时间为7 d进行验证试验。结果表明,在最佳发酵条件下酶活力达38.53 U/g,与预测值基本接近,说明所建模型拟合良好且可靠。经单因素和响应面法优化发酵条件后,菌株产酯化酶水平明显提高,较出发菌株提高了95%。
3 讨论与结论
本试验采用UV-ARTP复合诱变手段对红曲菌进行诱变育种,通过酯化酶透明圈法初筛和气相色谱法测酯化酶活力复筛,选育出1株产酯化酶活力提高较大的红曲菌Z14,经连续传代其酯化酶活力稳定至34.44 U/g,较出发菌株提高了74%。通过单因素试验及响应面优化得到其最佳固态发酵条件为:接种量为5%、含水量为70%、培养时间为7 d。在此条件下其产酯化酶活力达到38.53 U/g,较出发菌株提高了95%。
研究表明,ARTP诱变技术能够高效快速使微生物发生突变。蒋汶等[29]采用UV-ARTP复合诱变方法对红曲霉ZL307进行诱变,多糖产量与原始菌株相比提高了61.18%。方春玉等[30]对红曲霉菌株的原生质体进行紫外线和超声波的复合诱变,经固态发酵后酯化力与出发菌株相比提高了83.2%。本实验以红曲菌N3为出发菌株进行UV-ARTP复合诱变,并优化了其固态发酵条件与出发菌株相比酯化酶活力有较大提高。
关于红曲菌诱变育种的研究较多,但对高酯化力红曲菌进行复合诱变并优化其固态发酵产酯化酶条件的研究尚未见报道。本研究采用复合诱变手段获得高酯化力红曲菌突变株并利用响应面法对其产酯化酶条件进行了优化。为酯化型红曲菌用于浓香型白酒的生产,提升白酒质量和提高优级酒产率,奠定理论研究基础和优质菌种来源。
