南山牧场生鲜牛乳理化指标与微生物多样性对比分析
2021-06-16周杏荣刘成国雷文平周佳豪
周杏荣,周 辉,罗 洁,刘成国,*,雷文平,周佳豪
(1.湖南农业大学食品科技学院,湖南长沙 410128; 2.湖南省发酵食品工程技术研究中心,湖南长沙 410128)
原料乳营养成分的组成是评价乳品品质的重要指标,它不仅决定着牛乳的营养价值,而且在一定程度上影响着乳制品的加工特性。荷斯坦牛、娟珊牛是我国优良的奶牛品种,其乳成分有不同的特性。荷斯坦奶牛因其产奶量高、生产性能稳定好成为世界上饲养数量最多、使用数量最大的奶牛品种[1]。
南山牧场是中国南方最大的高山苔地草原,平均海拔1760 m,享有“南方的呼伦贝尔”、“中国的新西兰”之美誉。该地区草场面积大,水质符合国家地表水环境质量一类水质标准,空气质量佳,这些良好的自然资源条件为发展南山生态特色奶业提供了优良的基础条件。目前关于不同地区对牛乳品质影响的研究局限于奶牛泌乳量等方面[2],在牛乳的理化指标与微生物多样性上并未有研究。因此,研究不同地区对牛乳品质的具体影响因素具有重要意义。
本文主要研究湖南山区高海拔牧场的牛乳,并以城郊牧场牛乳作为对照,对牛乳常规营养成分、矿物质元素、氨基酸组成及挥发性成分进行分析测定,并基于Illumina Hiseq高通量技术研究牛乳样品中微生物多样性,从而研究牛乳微生物种群与乳成分之间的关系,旨在比较不同牧场生鲜牛乳之间的差异,为改善南山牧场地区原料乳的品质以及对其的合理开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
南山牧场荷斯坦牛乳样品(NS)、城郊牧场荷斯坦牛乳样品(HST)、城郊牧场娟姗牛乳样品(JS)、城郊牧场荷斯坦及娟姗混合牛乳样品(HSTJS) 南山牧场及城郊牧场采集牛奶样品,用无菌棉签蘸少量灭菌的生理盐水擦拭乳头后,将牛奶挤入无菌管中,随机取得牛奶样品60(15×4)份,将所有样品低温保存并尽快运至实验室保存于-80 ℃冰箱;硫酸铁铵(NH4Fe(SO4)2·12H2O) 纯度>99.99%,上海联迈生物工程有限公司;碳酸钙(CaCO3) 纯度>99.99%,上海泽叶生物科技有限公司;氧化锌(ZnO) 纯度>99.99%,海顺新材料有限公司;硒标准溶液(1000 mg/L) 上海恪敏生物科技有限公司;五水硫酸铜(CuSO4·5H2O) 纯度>99.99%,东莞市谱标实验器材科技有限公司;磷酸二氢钾(KH2PO4) 纯度>99.99%,浙江新化化工股份有限公司。
FT 120乳品分析仪 上海瑞玢国际贸易有限公司;PUCHUN型电子天平 上海精密科学仪器有限公司;601型超级恒温水浴锅 金坛市医疗器厂;SC-320D型冷藏柜 青岛海尔股份有限公司;AAS6800型原子吸收光谱仪 日本岛津公司;ARL Perform’X 2500 X射线荧光光谱仪 赛默飞世尔科技公司;Alpha1900型紫外可见分光光度计 上海谱元仪器有限公司;GCMS-QP2010型气质联用仪 岛津企业管理(中国)有限公司。
1.2 实验方法
1.2.1 样品的选择 理化指标及微生物多样性测定中,选用南山牧场荷斯坦牛乳样品(NS)、城郊牧场荷斯坦牛乳样品(HST)、城郊牧场娟姗牛乳样品(JS)进行比较,是为了分析在相同环境或不同环境下,不同品种的牛乳乳成分、微生物多样性是否存在差异,从侧面看出环境对牛乳的影响;微生物多样性测定中,又加入了荷斯坦和娟姗牛乳的混合奶样(HSTJS),目的是为了观察两种牛乳样品混合是否会改变其细菌的多样性。
1.2.2 理化指标的测定 牛乳常规营养成分分析:取得样品后,在冷藏的条件下送至湖南农业科学院进行测定,利用FT 120乳品分析仪测定牛乳的各项基本营养成分含量,包括脂肪、蛋白质、乳糖、全乳固体、非脂乳固体、密度、酸度、游离脂肪酸;矿物质元素的测定,参照GB 5009.90-2016《食品中铁的测定》、GB 5009.92-2016《食品中钙的测定》、GB 5009.14-2017《食品中锌的测定》、GB 5009.93-2017《食品中硒的测定》、GB 5009.13-2017《食品中铜的测定》、GB 5009.87-2016《食品中磷的测定》;氨基酸的测定,参考GB/T 5009. 124-2010 《食品中氨基酸的测定》。挥发性风味物质测定,参照文献方法[3]进行牛乳样品的顶空萃取及风味物质的测定:
a.GC条件:DB-WAX毛细管色谱柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;柱箱升温程序:初温35 ℃保持3 min,然后以3 ℃/min升温至200 ℃,再以20 ℃/min升温至250 ℃,保持5 min;载气为氦气He,流速为1 mL/min;进样采用自动分流方式进行,分流比10∶1。
b.MS条件:EM电离源,离子源温度250 ℃;接口温度200 ℃;检测电压为1 kV;质量扫描范围m/z为30~400。
1.2.3 高通量测序牛乳中微生物细菌多样性的测定 将所有样品低温保存并尽快运至北京诺禾致源科技股份有限公司进行高通量测序;首先,将测序结果中的reads数据使用Cutadapt[4]进行低质量部分剪切,再根据Barcode从得到的reads中拆分出各样品数据,截去Barcode和引物序列初步质控得到原始数据,经过以上处理后得到的Reads需要进行去除嵌合体序列的处理,Reads序列通过与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列[5],得到最终的有效数据。
1.3 数据处理
采用Excel 2010软件进行数据统计分析,显著性水平为P<0.05,每个样品检测均为3次重复;挥发性成分获得数据采用美国国家标准与技术研究院(national institute of standards and technology,NIST)2015版本对照,相似度在80%以上为有效数据。
2 结果与分析
2.1 南山牛乳与其他乳常规营养成分的比较
由表1可知,与HST牛乳相比,NS牛乳脂肪含量较低,为3.37%;有研究报道,荷斯坦牛乳脂肪相对含量较低,均值为4.10%[6],而娟姗奶牛以较高的乳脂率和乳蛋白率而闻名。对比表1中结果,JS牛乳的脂肪及蛋白质含量最高,HST牛乳脂肪为4.04%,NS牛乳脂肪显著低于HST牛乳(P<0.05),且NS牛乳蛋白质含量3.28%与HST牛乳蛋白质含量3.22%呈显著差异(P<0.05)。引起脂肪和蛋白质含量差异的因素有很多,可能的原因是饲粮结构,饲粮结构的组成比例不同会对奶牛生产性能以及乳品质产生很大的影响[7]。表1中,NS牛乳乳糖含量为4.61%,相较于城郊牧场JS和HST牛乳明显较低,较适合乳糖不耐受人群的食用。此外,全乳固体、密度和酸度是衡量鲜乳质量的重要指标,虽然南山牧场牛乳全乳固体及非脂乳固体含量虽然明显低于城郊牧场HST和JS牛乳,但符合国家标准,并且其游离脂肪酸含量明显高于城郊牧场2种牛乳。正常鲜乳的相对密度在1.028~1.032之间,酸度小于18 °T。表1中,南山牧场牛乳密度为1.03,酸度为13.60 °T,牧场之间有显著差异(P<0.05),但均达到正常鲜乳的标准。本研究表明南山牧场地区生鲜乳与城郊牧场生鲜乳的营养成分具有明显的差异,对引起该地区乳品质差异的因素还有待进一步研究。

表1 常规营养成分测定结果Table 1 Determination results of conventional nutrition components
2.2 矿物质元素含量的比较
牛乳中的矿物质是人体获取矿物元素来源的一个重要途径[8]。3种牛乳中含有铁、钙、锌、硒、磷5种元素。铁是人体所需的重要微量元素,参与体内氧的转运、交换和组织呼吸过程,维持机体正常造血功能,对人体健康有重要意义[9]。由表2可知,南山牧场牛乳铁含量(5.200 mg/L)约为城郊牧场JS牛乳和HST牛乳的2倍,但JS牛乳与HST铁含量差异并不显著(P>0.05)。并且城郊牧场JS牛乳及HST牛乳锌含量均低于南山牧场NS牛乳。此外,3种牛乳钙、硒、总磷含量均呈显著性差异(P<0.05),其中,城郊牧场HST牛乳3种矿物质含量最高;对于钙、硒含量,JS牛乳最低;对于总磷含量,NS牛乳最低。造成差异的可能原因,一方面是地质环境不同导致的土壤、牧草中元素含量不同引起的,另一方面也不排除不同地区家畜品种、饲养方式、季节等因素的交叉影响。
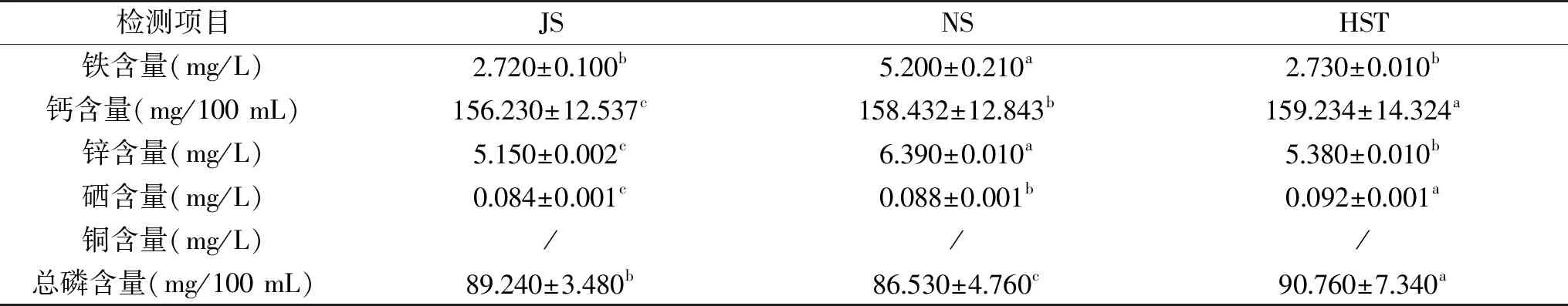
表2 矿物质元素测定结果Table 2 Determination results of mineral elements
2.3 氨基酸含量的比较
表3中,JS牛乳、NS牛乳、HST牛乳中氨基酸总量分别为3.646、3.102、3.217 g/100 g;8种必需氨基酸含量分别为1.532、1.303、1.376 g/100 g;必需氨基酸分别占总氨基酸含量的 42.0%、42.0%、42. 8%,必需氨基酸与非必需氨基酸的比值分别为0.725、0.724、0.747,接近 FAO/WHO标准规定的必需氨基酸含量(40%)和E/N值(0.6)[10],说明两个牧场的生鲜乳都属于优质蛋白质资源,从单个氨基酸含量来看,甘氨酸(Gly)、胱氨酸(Cys)、缬氨酸(Val)、蛋氨酸(Met)、苯丙氨酸(Phe)、赖氨酸(Lys),NS牛乳与HST牛乳有显著差异性(P<0.05),但谷氨酸、丙氨酸、异亮氨酸、脯氨酸的含量NS牛乳与HST牛乳基本无差异,且除胱氨酸、丙氨酸及丝氨酸外,两个牧场荷斯坦牛乳其他氨基酸含量与JS牛乳都存在显著差异性(P<0.05)。同一品种生鲜乳,影响乳品质的主要因素之一是地区差异[11],因此可能取决于明显的地区差异、气温的变化、饲粮结构组成和饲养管理方式等因素。
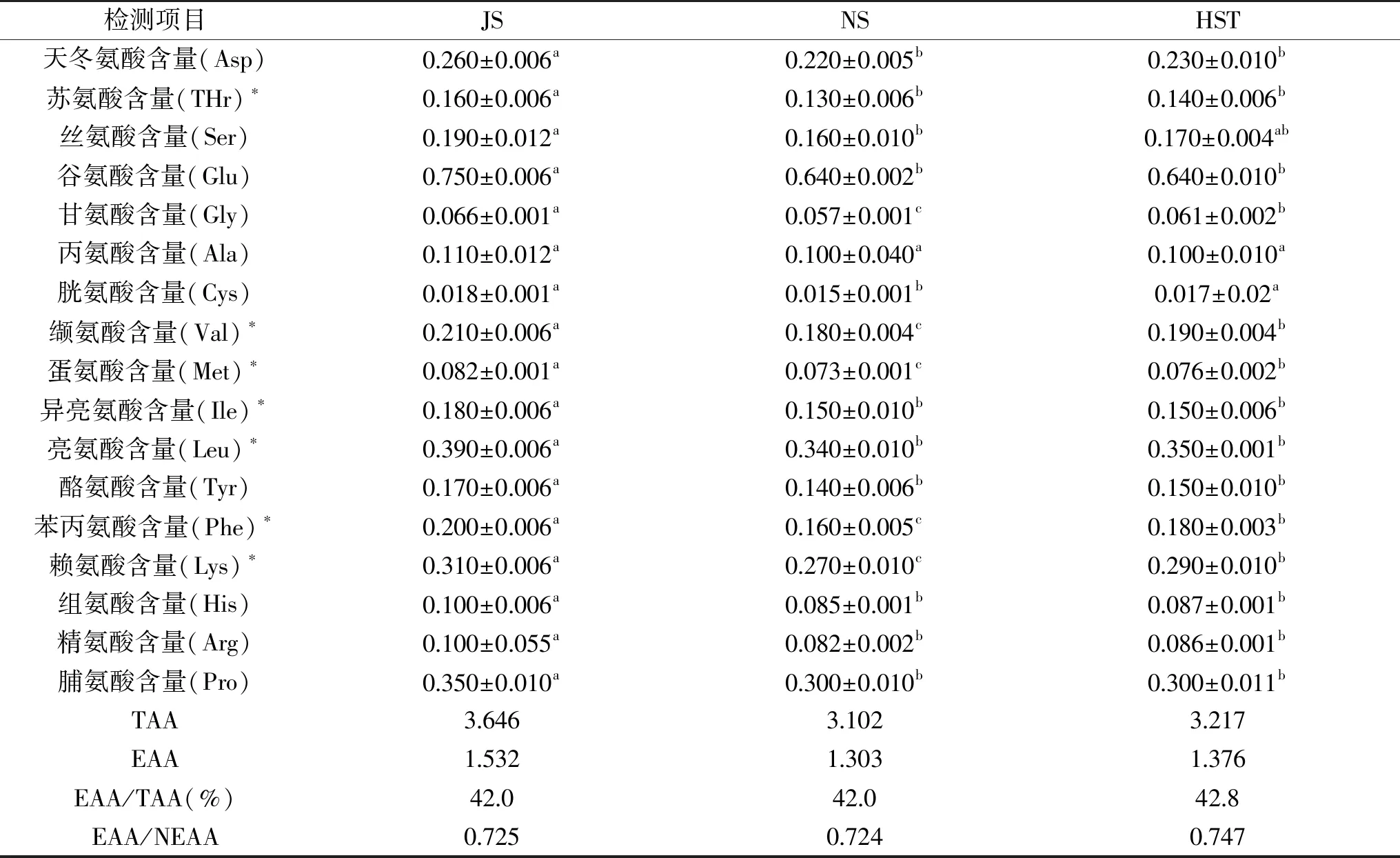
表3 氨基酸测定结果(g/100 g)Table 3 Amino acid determination results(g/100 g)
2.4 挥发性成分结果分析
由表4可知,对两个牧场的牛乳进行GC-MS分析,均有效萃取检出了挥发性风味物质。其中,在JS牛乳中共检出13种挥发性物质,其中酮类7种、醛类2种、烷烃类1种、其他3种。在NS牛乳中共检出11种挥发性物质,其中酮类5种、醛类2种、烷烃类2种、其他2种。在HST牛乳中共检出13种挥发性物质,其中酮类7种、醛类2种、烷烃类3种、其他1种。南山牧场牛乳中挥发性物质种类相对较少;城郊牧场两种牛乳挥发性物质的种类和含量比较接近。
将3种牛乳样品的挥发性物质进行比较分析,结果显示,3种牛乳样品中主要的挥发性物质为酮类、烷烃类、醛类;共有的挥发性物质为6种,分别为丙酮、2-庚酮、2-壬酮、2-甲基-4-庚酮、壬醛、癸醛。其中,2-庚酮和2-壬酮呈奶香、甜香风味,是牛乳风味的代表性挥发性风味物质[12]。NS牛乳中这两种物质含量分别达到了8.54%和21.98%,明显高于JS、HST牛乳。醛类物质由于风味阈值较低,且具有奶香、油脂风味,也是牛乳风味的常见特征组分[13]。表4中可知,壬醛所占含量在醛类中较高,NS牛乳高达16.51%,而JS和HST牛乳含量极低。烷烃类物质在3种牛乳样品中相对含量少,且该类物质由于风味阈值较高[14],对于牛乳风味的贡献不大。结果表明,不同品种牛乳挥发性风味物质差异不大,两个牧场的同一品种牛乳挥发性风味物质具有明显差异,南山牧场牛乳奶香味更加浓郁。

表4 鲜牛奶风味物质的测定结果Table 4 Measurement results of fresh milk flavor substances
2.5 高通量测序中微生物多样性比较
2.5.1 样品测序结果及多样性指数 通过16S rRNA基因序列测序,分析样品中的微生物群落多样性。对样品原始序列条带中低质量条带进行嵌合体过滤,得到可用于后续分析的有效数据,如表5所示。Alpha多样性用于分析单个样品内的微生物群落多样性和丰富度,它有多种衡量指标:Chao1和ACE指数衡量物种丰度,Shannon用于衡量物种多样性,受群落中各物物种丰度和均匀度的影响[15]。由表5可知,HSTJS样品中的OTUs和微生物多样性最高,这个结果可能是混合了两种牛乳样品导致增加了其微生物种类。NS样品中的OTUs和微生物多样性明显低于HST样品,且低于JS样品,说明两个牧场微生物多样性存在明显差异。可能是环境因素的影响,南山处于高海拔地区,气温较低,不适宜部分微生物生长导致牛乳中微生物多样性较少。OTUs覆盖率数值越高,则样品中物种被测出的概率越高。表中所有样品的覆盖率均在99%以上,说明测序结果可以反应样本中微生物真实情况。

表5 牛乳样品测序数据集汇总及统计分析Table 5 Summary and statistical analysis of milk sample sequencing data set
从样本中随机抽取一定测序量的数据,统计它们所代表物种数目,以抽到的序列数与其对应的OUTs构建曲线,可直接反映测序数据量的合理性,并间接反映样本中物种的丰富程度[16]。样品中细菌的稀释曲线,如图1所示,所有样品的稀释曲线已趋于平缓,说明样本的OUTs覆盖度已基本饱和,测序数据量合理。

图1 不同牛乳样本的稀释曲线Fig.1 Dilution curves of different milk samples
2.5.2 微生物群落的多样性分析
2.5.2.1 细菌门、科分类水平的比较 门分类水平菌群的组成和结果,如图2所示,共得到10种细菌类群。样品NS与其他牛乳样品中,优势细菌类群及其所占比例不同。NS样品中的优势菌群为变形菌门(Proteobacteria,61.76%)最高、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)次之,所有样品均含有这 4 种细菌类群,但在样品中占比差异较大。HST、JS样品中丰度最高的细菌类群是Firmicutes;其次是Proteobacteria和Bacteroidetes。张敏等[17]研究表明,原奶中主要的菌群是变形菌门,厚壁菌门和变形菌门是最占优势的菌群门,这与本实验结果一致。科分类水平如图3所示。研究发现,不同样品来源细菌类群差异较大。NS样品丰度较高的是莫拉氏菌科(Moraxellaceae,39.23%)、假单胞菌科(Pseudomonadaceae,14.40%),且高于城郊牧场样品。样品HST的优势菌类群有肠球菌科(Enterococcaceae,12.64%)。不同样品之间细菌类群的组成比例明显不同,城郊牧场样品细菌类群多样性更为丰富。结果表明,不同牧场间同一品种的牛乳优势细菌门类有所不同。
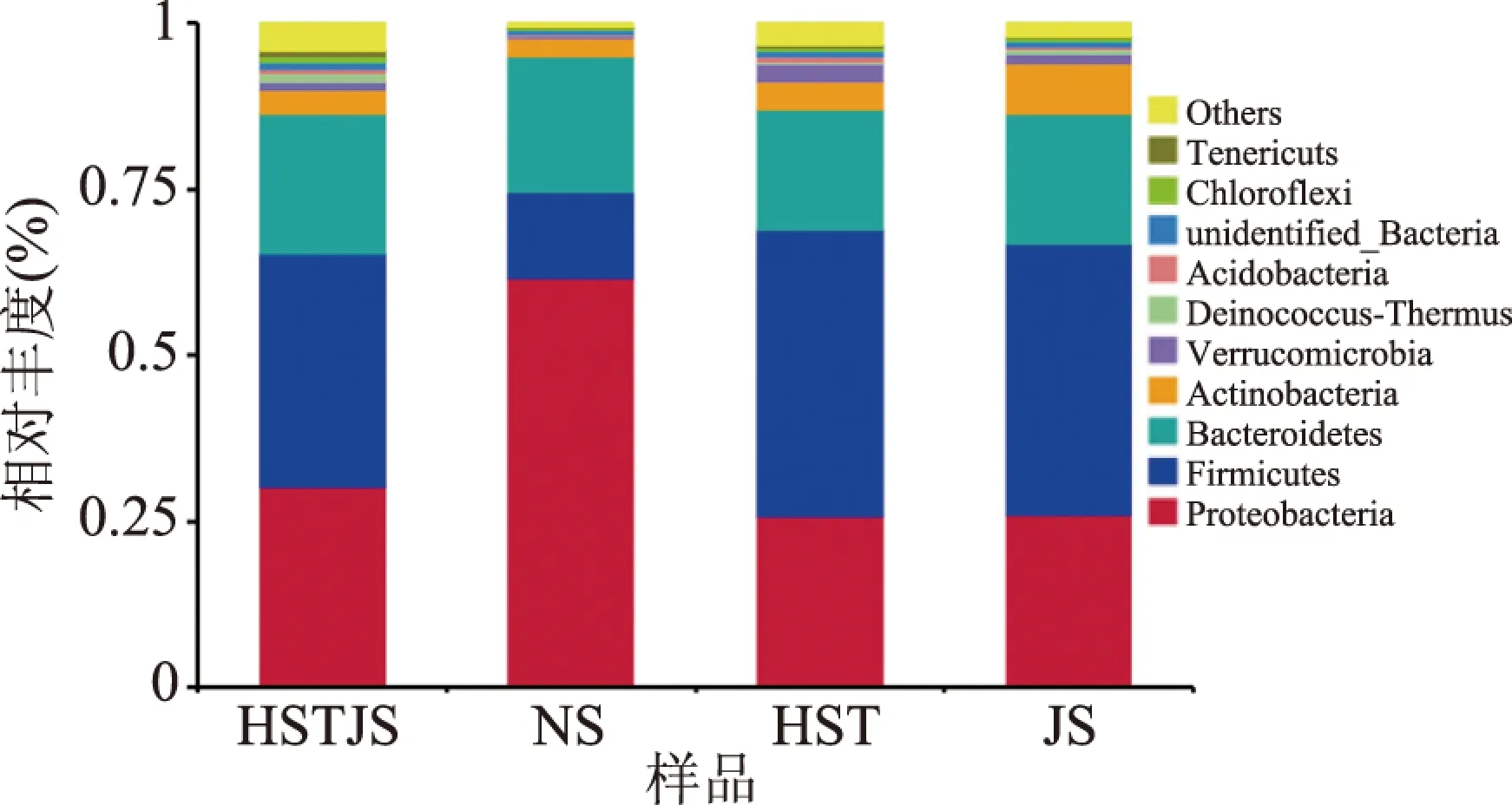
图2 细菌门分类水平的比较Fig.2 Comparison of bacteria groups at phylum level

图3 细菌科分类水平的比较Fig.3 Comparison of bacteria groups at family level
2.5.2.2 细菌属分类水平的比较 在属分类水平上菌群的组成和结果,如图4所示。NS样品具有相对较高的菌群丰度,主要涉及4个属,不动杆菌(Acinetobacter,33.91%)、假单胞菌(Pseudomonas,17.40%)、金细菌(Chryseobacterium,15.92%)、水杆菌(Enhydrobacter,5.16%)。Von Neubeck等[18]研究发现,原料乳中的优势菌属为假单胞菌属(Pseudomonas)、乳球菌属(Lactococcus)和不动杆菌属(Acinetobacter),这与本研究结果相近。不同牧场的牛乳之间差异较大,在城郊牧场三个样品中,占优势丰度的是肠球菌(Enterococcus),不动杆菌、假单胞菌所占比例低,尤其是样品HST中,不动杆菌属只占2.17%,但HST样品乳杆菌属(Lactobacillus)丰度在另外三种样品中最高,达4.14%。不动杆菌属是原料乳中常见的嗜冷菌,若大量繁殖会影响破坏乳成分,导致腐败变质[19]。南山处于高海拔地区,气温相对较低,可能是导致原料乳出现嗜冷菌的主要原因。嗜冷菌的污染源是水和土壤,而水和土壤则有可能污染奶牛乳头和乳房表面;嗜冷菌也可能来源于有关器具和设备,但这些污染都是可以避免的,可以通过加强卫生管理,对污染源进行处理。
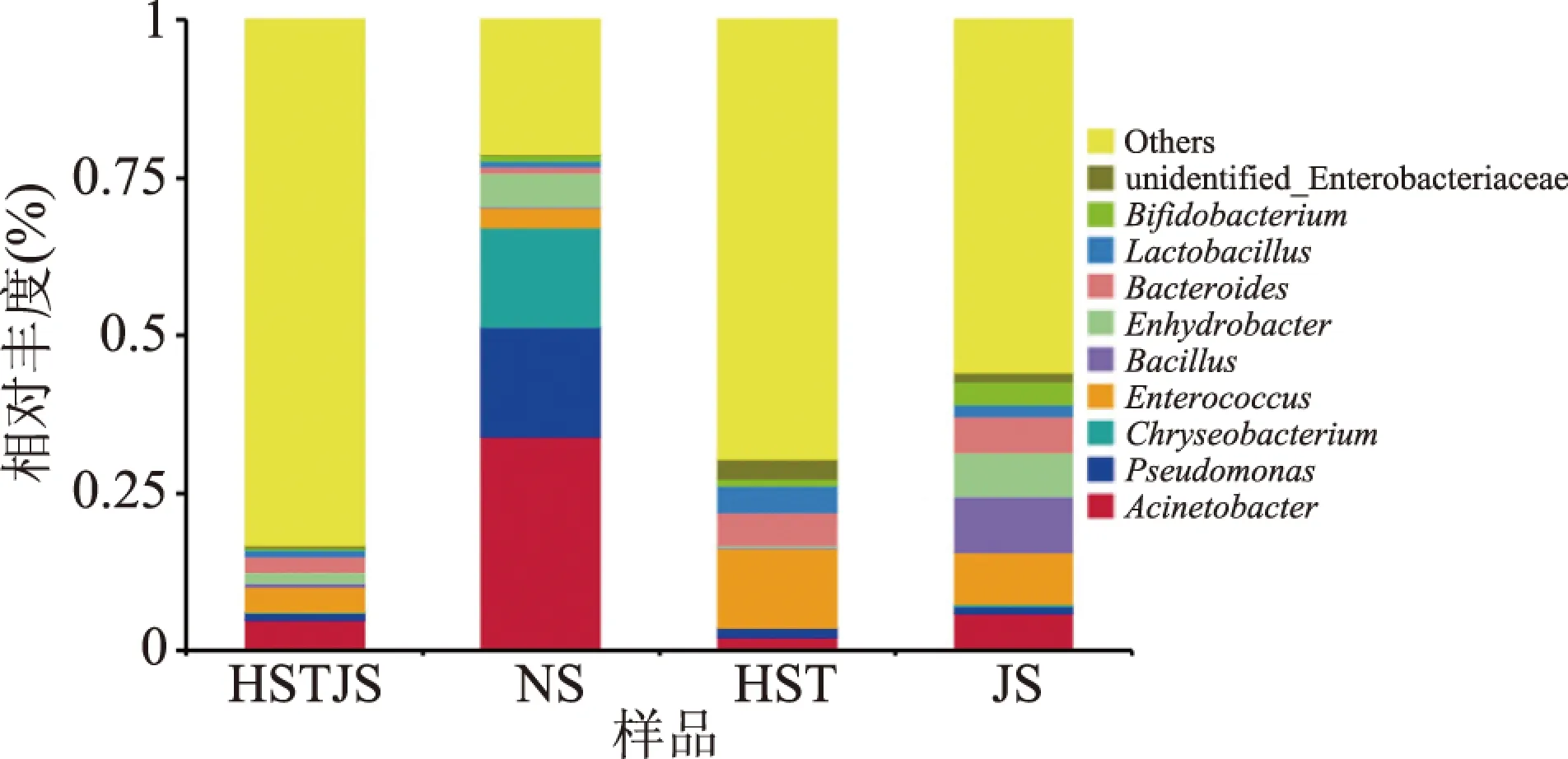
图4 细菌属分类水平的比较Fig.4 Comparison of bacteria groups at genus level
2.5.3 牛乳样品中微生物区系的比较 利用样品中细菌群落的主成分分析(PCA,Principal Component Analysis),可以确定4个牛乳样品中细菌菌群组成之间的关系(图5)。

图5 不同牛乳样品的PCA分析Fig.5 PCA analysis of different milk samples
PC1的贡献率为42.97%,PC2的贡献率为36.26%,累积贡献率为79.23%。样本的群落组成越相似,则它们在PCA图中的距离越接近。如图5所示,NS样品和HST样品明显分离,说明这两个牧场的荷斯坦牛乳样品菌群的组成差异大。
3 结论
营养成分分析表明南山牧场牛乳的脂肪、乳糖含量分别为3.37%、4.61%,显著低于城郊牧场牛乳(P>0.05);南山牧场牛乳蛋白质含量为3.28%,高于城郊牧场的荷斯坦牛乳。矿物质含量分析:南山牧场牛乳含较高的铁和锌,分别为5.200、6.390 mg/L,城郊牧场两种牛乳都低于南山牧场牛乳;氨基酸测定结果存在明显的地区差异,气温的变化、饲粮结构组成和饲养管理方式是造成该差异的主要因素,挥发性风味物质数据显示,同一牧场中风味物质种类相近,不同牧场的荷斯坦牛乳,有明显差异。微生物多样性分析:南山牛乳微生物组成中,莫拉氏菌科为优势菌类群,丰度达39.23%,其中,不动杆菌属也为优势菌群,嗜冷菌多,不利于牛乳的低温储藏,容易使牛乳变质,应加强卫生管理。
同一品种的牛乳受地理环境因素影响大,不同牧场之间牛乳的常规成分以及矿物质含量有明显差异,但氨基酸含量较为稳定;微生物多样性受环境因素影响更为显著,且会影响乳成分品质。南山牧场是中国南方独特的天然草场和种畜牧草良种繁殖场,气候冷凉,多年平均温度为 11.2 ℃,荷斯坦奶牛耐寒但不耐热,因此南山的气候环境适宜于荷斯坦奶牛生长和泌乳[20]。然而,本文仅对两个牧场的牛乳做了基础对比分析,不同地区牛乳之间差异性更深入的原因还需更进一步的研究。
