获取地小耳畸形优先可疑基因途径的综述
2021-06-16许梦吴军成
许梦 吴军成
山东第一医科大学附属医院(济南 250000)
泰安市中心医院(泰安 271000)
先天性小耳畸形是由于胚胎时期第一、二腮弓及第一腮沟的发育异常引起的外、中耳畸形[1],由遗传、环境、社会等多种因素共同影响,病理发育机制复杂[2]。先天性小耳畸形分为单纯性和综合征型小耳畸形,可以同时伴发多个器官的发育异常[1,3]。患者的耳部畸形涉及外耳大小、形态异常或结构畸形甚至缺失,严重者表现为无耳畸形伴外耳道闭锁[4]。由于不同患者耳部畸形异质性较高,使得超声等常规产前检查容易出现漏诊等。调查显示,不同种族、不同地域先天性小耳畸形的发病率不同,为0.83-17.4/10000不等[5]。尽管目前有大量研究探索其致畸病因,但该病的具体致病机制尚未明确,因此探求先天性小耳畸形的病因十分重要,可以为遗传咨询、分子水平的基因诊断提供更加可靠依据。国际上众多专家学者致力于寻找小耳畸形的易感基因,但由于基因作用机制复杂,仅在综合征型小耳畸形致病基因诊断中取得了一定成绩,散发性单纯小耳畸形的遗传学研究进展甚微[6]。基因诊断技术的飞速发展使人类可以应用多种方法探索先天性小耳畸形的致病基因。在本文中将针对现今四种主要的基因鉴定方法,在阐述其优势及局限性的同时,首次将基因检测进展以“优先可疑基因库”的形式进行总结探讨,“优先可疑基因库”是指在进行分子水平的基因诊断时需要优先考虑和进行筛查的基因组,它应该包括:已明确的综合征型小耳畸形的致病基因;在人、猪、羊和鼠等小耳畸形模型中,通过全基因组关联分析已获取的与颅面部发育有关的基因;与之相关的拷贝数变异;小鼠基因组信息数据库中与之相关的致病基因等。以期研究者们在进行小耳畸形遗传学研究时,可以利用该小耳畸形致病基因鉴定的系统性方法,并优先从“优先可疑基因库”中筛查致病基因,形成小耳畸形基因诊断的系统性方法和基因库。
1 综合征型小耳畸形调研
先天性小耳畸形可以单独出现[7],但约40%的患者伴发其他器官、结构的先天畸形或发育异常[8],如颌面部、心血管、泌尿系统等,其中部分以综合征的形式存在,且已明确了致病基因。比如TCOF1的突变可以引起Treacher Collins综合征[9],SIX1和EYA1的突变导致鳃耳综合征的发生[10]。
综合征型小耳畸形致病基因的探索及其伴发畸形的相关研究极大的促进了小耳畸形遗传学的发展[11]。HMX1的突变可以导致眼耳综合征的发生。而Cox等人通过进一步实验发现HMX1基因下游的保守非编码元件(conserved noncoding ele‐ment,CNE)突变可以组织特异性地增强HMX1的表达。该发现证明保守区域的突变可能通过对特定基因的调节作用引起单纯性小耳畸形[5]。Gold‐enhar综合征又称为oculo-auricular-vertebral spectrum(OAVS)或hemifacial microsomia(HFM),Kelberman等对两个患病家系进行了全基因组扫描、连锁分析,认为最为可能的候选基因为GSC(goosecoid,OMIM:138890)。然而在另外两个家系和120个散发病例中均没有发现GSC基因突变[12]。虞佩等人对43例先天性小耳畸形患者的GSC基因进行了测序,其中2例患者在该基因的外显子3的125bp处发生了错义突变。Luquetti等学者发现了10种有意义的小耳畸形优先伴发畸形,如唇腭裂、后鼻孔闭锁和轴前多指等。其中后鼻孔闭锁和轴前多指在OAVS中并不常见,表明两者与小耳畸形之间可能存在较为隐匿的遗传发育联系,并推测这些特定的优先伴发组合可能是SALL1、FGF10/FGF2-3参与的基因路径下游的缺陷或与该路径相交叉的缺陷造成的。在最近研究中,Shankar等学者通过对OAVS患者血样分析发现,先证者AMI‐GO2(c.901C>T)基因产生无义替换,而在ZCCHC14(c.1198C>T)和 SZT2(c.2951C>T)上产生错义替换,AMIGO2基因的无义替换引入了一个过早终止密码子,可能通过无义介导的通路衰变使该基因失去功能,因此相较于ZCCHC14和SZT2的错义替换而言,AMIGO2基因被认为是一个更强的候选基因[12]。
由于小耳畸形的伴发畸形多样,综合征表型异质性高、数量庞大、最低诊断标准尚存争议。当患者首次就诊时,医师应考虑到综合征型小耳畸形的可能性,对其进行详尽的全身检查评估,发现隐匿的合并畸形,确定器官异常的特征性组合模式,从而做出准确诊断。小耳畸形及其伴发畸形的诊断准确性十分关键,一旦对表型发生漏判、误判,将会影响接下来对基因突变检测结果的解读。已经发现的综合征型小耳畸形的致病基因是目前已知的在耳部甚至是颅面部发育中起着重要作用的基因,因此可以最先从这些致病基因入手对单纯性患者进行筛查。另外鉴于小耳畸形伴发畸形可能存在共同起源或致病机制,因此临床上需要详细记录伴发畸形及其发生模式,或许可以为小耳畸形病因研究提供线索。
通过 Pubmed,Science Direct和 Web of Science等途径,检索收集已报道的与小耳畸形相关的主要综合征及其致病基因,见表1。
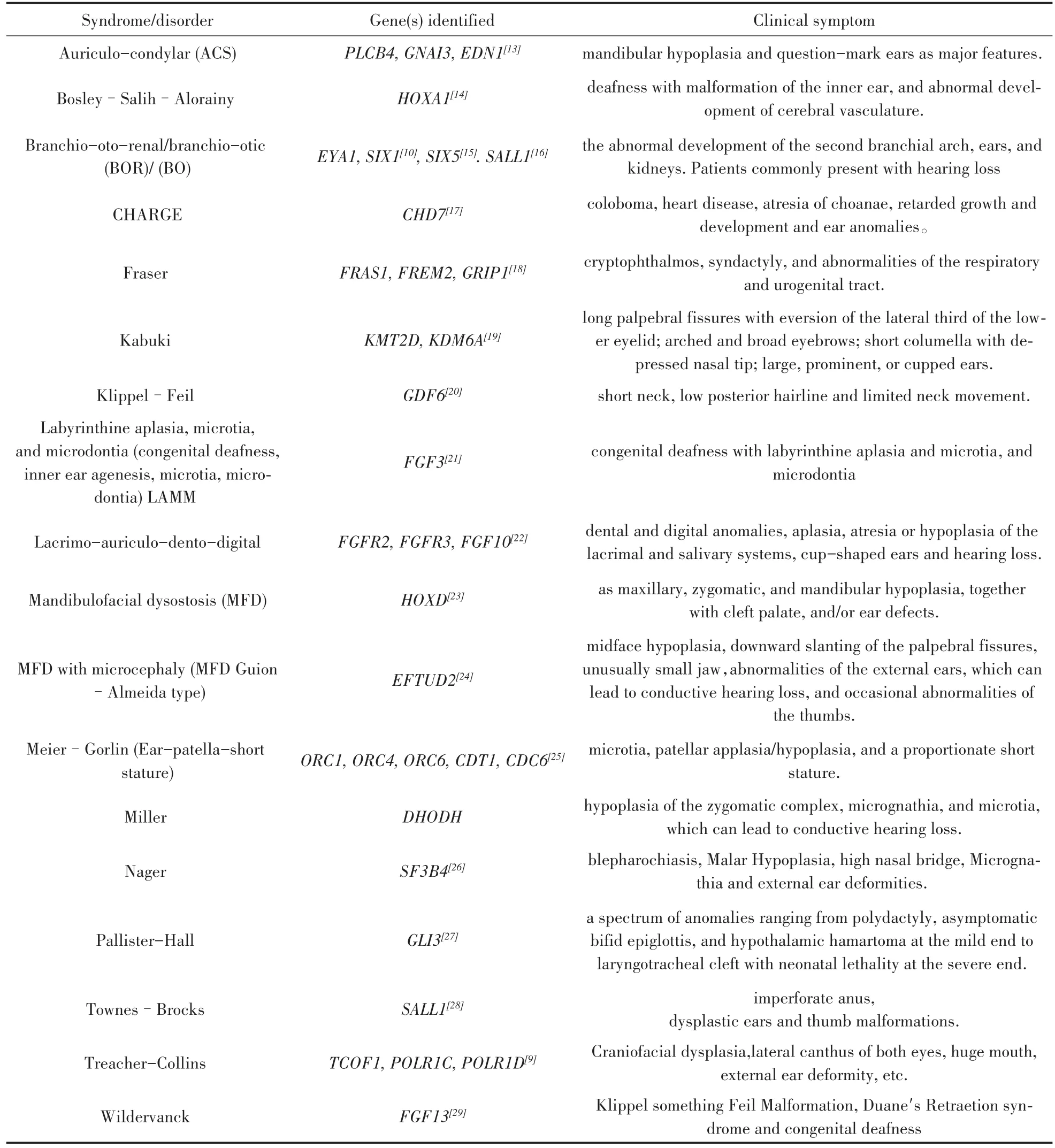
表1 主要的综合征型小耳畸形及其已知致病基因。Table 1 Major human disorders and syndromes with microtia
2 全基因组关联分析
早期针对小耳畸形的候选基因研究存在样本量少、可重复性差等缺点,且小耳畸形致病机制复杂,单基因病连锁分析等方法难以奏效。全基因组关联分析(genome-wide association study,GWAS)指在全基因组层面上,开展多中心、大样本、反复验证的基因与疾病的关联研究,是通过对大规模群体DNA样本进行全基因组高密度遗传标记分型,全面寻找揭示与疾病相关的遗传因素的方法[30]。
除了人外,表现为小耳畸形的羊等动物的GWAS检测也为小耳畸形病因检测提供了线索[31]。He S等通过对患有小耳畸形的羊类以及正常羊类的食道基因分型,在Oar6上发现了SNP接近HMX1基因的进化保守区域,这与其他物种如牛和大鼠的外耳先天性畸形有关。对围绕着HMX1的进化保守区域进行测序,发现该区域的重复长度为76bp,与小耳畸形一致,提示为显性遗传模式[32]。另外,过去对小耳畸形羊进行的2例GWAS在同一个染色体上不同的基因上发现了显著相关信号[33,34]。从文献报道获取在人、猪、羊和鼠等动物模型中与颅面部发育有关的基因汇总见表2。

表2 不同种动物中与颅面发育相关的基因Table 2 Genes associated with craniofacial development in different animals
作为一个复杂疾病,小耳畸形的病因研究困难重重。GWAS可以在小耳畸形基因组学研究中充分发挥优势:1)无需提前选定候选基因;2)可通过家系样本等,识别其致病基因;3)可作为诊断金标准;4)对其进行基因分型,利于产前诊断及预防。但是由于在研究设计上GWAS强调对全基因组常见遗传变异的覆盖率,需要足够多患者的多代遗传大家系或大样本表型一致的散发患者,主要检测人群中频率相对较高(>5%)的单核苷酸多态性(single nucleotide polymorphism,SNPs),因此低频、罕见变异可能被遗漏,并且其只对统计上与疾病最显著相关的基因位点进行研究,从而低估基因网络和环境因素的影响。这就需要国内外建立多中心、数据共享合作的出生缺陷监管机构,详细地鉴别患者间的表型差异、并归类为不同的亚型。在目前得到的GWAS基因检测结果基础上,依靠样本量的增加,寻找不同样本之间存在同一突变基因的可能性,从而获得致病基因的鉴定。
3 拷贝数变异检测
Balikova等在一个常染色体显性遗传的综合征型小耳畸形家系中,通过连锁分析、荧光原位杂交技术、qPCR等方法在4号染色体p16区域发现一个750kb的5次串联重复拷贝数变异(copy number variants,CNV)[38],这是首次在基因组结构水平观测到小耳畸形患者存在CNV,就此CNV走进了小耳畸形研究者们的视线。拷贝数变异是指与参考序列相比,基因组中≥1kb的DNA片段插入、缺失或扩增,及其互相组合衍生出的复杂染色体结构变异[39]。其形成的直接原因是DNA复制过程中发生错误导致复制叉中止及模板的转换[40],进而造成基因片段的缺失、重复、移位和倒位等,直接或间接改变基因表达的量,进而影响基因的表达[41]。例如Ana Beleza-Meireles等人对22名OAVS患者的DNA样本进行了比较基因组杂交(comparative genomic hybridization array screening,aCGH),在22号染色体的q11区域发现了频发剂量异常。他们猜测这些不交叉或部分交叉的CNV可能增加了OAVS的患病风险[42]。
在表3中汇总了在人所有染色体中筛选出的与先天性耳畸形相关的CNVs类型和位置,从另一个层面上丰富了小耳畸形的“优先可疑基因库”。

表3 人类全部染色体中与小耳畸形相关的CNV[34,41]Table 3 CNV associated with microtia in all human chromosomes
目前全基因组范围的分析主要集中在散发病例与新的拷贝数变异,策略是用大量无关病例-对照样本的CNVs进行统计学分析,筛选可能的CNVs后再应用生物信息学分析等手段对该区域进行候选基因筛选,并用更多的具有相似表型的患者对这些基因进行突变检测及表观遗传学研究来验证。现今的高通量芯片可以实现在全基因组范围内检测这样的微缺失,使研究者能鉴定与疾病相关的染色体位点,通量高且易于实现自动化,因此针对目标区域的高效和可靠的CNV检测是研究小耳畸形的重要手段[43]。全基因组范围检测的策略成本较高,由于当前CNVs分析算法还有很大局限性,易出现大量假阳性结果,需要大样本验证。因此检测到的CNV位点还需要经过筛选、去除假阳性结果,然后再通过实验证实(如荧光原位杂交、实时定量PCR、质谱等)才能确定。需要注意的是,检测到的CNV可能只是人群中的多态现象,与患者表型并无关系,因此功能验证是必需的。
4 小鼠基因组信息学数据库挖掘
小耳畸形的病因学研究不仅需要发现具有统计学意义的疾病相关基因,更要揭示基因突变如何参加疾病发生的生物学机制。小鼠基因组信息学数据库(Mouse Genome Informatics,MGI)是由Jackson实验室主办的免费在线数据库和生物信息学资源库,由美国国家人类基因组研究所(the Na‐tionaal Human Genome Research Institute,NHGRI)、国家癌症研究所(National Cancer Insitute,NCI)等机构以促进人类健康和疾病研究为目的共同组织建立。MGI集成了来自小鼠基因组数据库和基因表达数据库的众多项目[44],收集了实验小鼠的遗传学、基因组学、疾病表型等海量的生物学数据,是为实验室小鼠创建和定制的数据、工具和分析的组合数据库。利用这一数据库,研究人员可以相互参考数据,及时共享、更新,这些优势可以更加便捷的推进整体实验研究。
本文将在小鼠基因组信息数据库(Mouse Ge‐nome Informatics,MGI,http://www.informatics.jax.org/)中检索出的与小耳畸形相关的致病基因进行汇总,见表4。

表4 MGI数据库中与小耳畸形相关的致病基因。Table 4 Pathogenic genes associated with microtia in MGI database
由于人鼠在分子或基因组水平上高度同源,目前多以小鼠构建疾病模型指导人类疾病机制研究。MGI数据库包含了小鼠基因、蛋白、疾病表型等大量信息,且更新及时[43]。通过对MGI数据的分析,可以快速地获取与小鼠耳部、颅面部发育相关的基因,还可以间接地进行功能性研究,因此作者认为表4中这些功能明确的基因对指导人类小耳畸形基因的筛选有着重要意义,可以被认为是小耳畸形的“优先可疑基因”。然而,并非全部致病基因都能被搜索并纳入到研究中,MGI数据库主要是通过疾病表型分类将一类基因进行汇总,而先天性小耳畸形的表型存在较高异质性,分类容易混淆。另外,部分研究较少的基因存在信息不准确的可能。
此外,先天性小耳畸形不仅对患病儿童造成了巨大的心理负担,也带给家庭和社会造成了很大的压力,因此学者们越来越重视该病的研究,关于其新的致病基因鉴定结果将不断涌现。这就要求研究者们紧密追踪最新的文献资料,及时汇总病因学研究新进展,不断动态更新小耳畸形的“优先可疑基因库”。在对小耳畸形的不断研究探索中,研究者们在发现可疑位点的同时,也更加认识到了该病致病机制的复杂性。随着遗传学的飞速发展以及新技术的开发和应用,目前有多种寻找小耳畸形病因的方法途径。但要想最科学合理的实现研究目的,一方面,研究者们需将多种方法整合成一个科学诊断路径;另一方面,利用目前的鉴定结果建立一个“优先可疑基因库”,并将检测结果不断纳入、完善该基因库,对就诊的小耳畸形患者优先考虑这些基因的改变,使小耳畸形的遗传学研究更加高效快捷。
本综述将小耳畸形遗传学检测的4种途径(综合征型小耳畸形调研、GWAS、CNV检测、MGI数据库挖掘)组合成为一个分析路径,并汇总出先天性小耳畸形的“优先可疑基因库”,以方便筛选获取更加可信、科学、合理的检测结果。研究者们不仅可以根据本文中各个检测方法优缺点的系统性介绍,在进行小耳畸形病因学探索时选择最适合的检测方法,还可以利用本文汇总出的“优先可疑基因库”便捷的筛选可疑致病基因。但本分析路径只是为广大专家学者提供一种研究思路,并非唯一。值得注意的是,由于检测原理、样本选择、数据集合等的多样性,并不存在所谓的“金标准”可以对各种检测方法获取的结果进行比较筛选,因此需要对不同检测方法得到的结果进行全面地汇总分析。检测到的任何有意义的基因改变均需要通过进一步实验验证分析,如细胞实验、动物模型、生物信息学分析等[45]。随着分析技术的不断完善,研究者们终会明确该病的遗传学机制,并为其的防治提供理论依据和指导方向。
