肝细胞癌组织中GRP78和p-PERK蛋白的表达及其与临床病理特征的关系*
2021-06-16曾经章杨勤谢汝佳陆爽赵雪珂李璨
曾经章, 杨勤, 谢汝佳, 陆爽, 赵雪珂, 李璨
(1.贵州医科大学 基础医学院 病理生理学教研室, 贵州 贵阳 550004; 2.贵州医科大学附属医院 感染科, 贵州 贵阳 550004)
肝细胞癌(hepatocellular carcinoma,HCC)作为对人类健康有着致命性危害的恶性肿瘤之一,其在全世界范围内占据着高居第2位及第5位的恶性肿瘤死亡率与发病率[1-2]。HCC起病隐匿,大部分患者在确诊时已是晚期,5年生存率低于5%[3]。内质网(endoplasmic reticulum,ER)是蛋白质合成、分泌及折叠等活动的重要场所,也是细胞内Ca2+存储和脂质合成的重要场所[4]。作为ER上跨膜蛋白的双链RNA依赖蛋白激酶样ER激酶(protein kinase R-like endoplasmic reticulokinase,PERK)在正常状态下和葡萄糖调节蛋白-78(glucose regulated protein 78,GRP78)进行结合,当氧化应激和过多蛋白质合成时,ER的平衡状态被破坏,引起内质网应激(endoplasmic reticulum stress,ERS)的发生,细胞ER中大量的未折叠蛋白聚集且与GRP78发生竞争性的结合,造成PERK与GRP78的解离,发生磷酸化及二聚化活化,进而激活磷酸化PERK(p-PERK)等下游因子进行一系列反应,促进细胞对ERS的适应[5]。ERS是细胞重要的适应代偿机制,与肿瘤关系密切,可以通过促进肿瘤血管生成、促进肿瘤细胞休眠及降低肿瘤细胞对某些化学药物的敏感性等发挥促癌作用[6-10],但ERS在HCC发展过程中促生存机制还有待确定。因此,本研究通过免疫组织化学定性和Western blot半定量检测,从蛋白水平分析ERS中的重要蛋白GRP78和p-PERK在癌旁及不同分化程度HCC组织中的表达,探索GRP78和p-PERK在HCC发生发展过程中的作用及其与HCC临床病理特征间的关系。
1 材料与方法
1.1 材料
1.1.1标本来源 收集2017年1月—2018年12月手术切除的HCC患者组织标本40例作为HCC组,取同一患者的癌旁组织标本40例作为癌旁组。所有患者均为已确诊的原发性HCC,且手术前均未进行放化疗,临床资料齐全;男27例、女13例,年龄<50岁18例、≥50岁22例,肿瘤直径<3 cm 15例、≥3 cm 25例,高、中及低分化型癌(与edmondson-steiner分级标准的Ⅰ级、Ⅱ~Ⅲ级及Ⅳ级对应)分别为12、15及13例(即高、中、低分化组);所有组织标本都在手术切除之后马上采集,采集时需要避开出血区及坏死的组织,并按照1 cm×1 cm×1 cm分割标本,用于免疫组织化学检测的标本固定于中性福尔马林溶液中,用于Western blot检测的标本保存于-80 ℃冰箱。
1.1.2主要试剂与仪器 GRP78和PERK抗体(英国Abcam),p-PERK抗体和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(美国Cell signaling technology),苏木素伊红( hematoxylin-eosin staining,HE)染色试剂盒、封闭用山羊血清(原液)及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDS-polyacrylamide gelelectrophoresis,SDS-PAGE )凝胶制备试剂盒(北京Solarbio),兔二步法试剂盒和辣根过氧化物酶(3,3′-diaminobenzidine,DAB)显色试剂盒(北京中杉金桥);5S-3D脱色摇床(海门市其林贝尔公司,ChemiScope5300一体式化学发光成像系统和凝胶成像仪(上海勤翔),-80 ℃冰箱(海尔电器),水浴箱(金坛科析),Synergy H4型酶标仪(美国伯腾)。
1.2 方法
1.2.1HE染色 磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤组织标本2次,10%中性福尔马林溶液固定24 h,梯度脱水后石蜡包埋,切成2~5 μm薄片;二甲苯脱蜡,梯度酒精水化,行HE染液染色5 min,蒸馏水冲洗;透明结束后切片置于通风橱,载玻片上组织边缘加中性树胶1滴,盖玻片与载玻片之间呈45 °斜放封固组织切片,镜下观察,由2名病理医师双盲法判定结果,采集图片。
1.2.2免疫组织化学染色及结果判断 取组织标本采用柠檬酸抗原修复10 min,3%H2O2室温孵育20 min,山羊血清封闭20 min,一抗PERK和GRP78滴加处理、50 μL/片,4 ℃孵育过夜;滴加二抗50 μL/片,室温孵育60 min,DAB显色,梯度酒精脱水、中性树胶封片。显微镜下随机选取5个高倍镜视野观察定位,在细胞质中观察到棕黄色颗粒则为GRP78、PERK阳性细胞。染色计分标准[11]:按400×的放大倍数,各视野中观察100个细胞并进行统计以评分,阳性染色细胞数量超过50%、25%~49%、低于25%及没有出现染色分别计为3、2、1及0分,若阳性染色细胞呈棕黄色、黄色及淡黄色分别计3、2及1分,以阳性细胞及染色的评分乘积作为最终得分;最终得分为0~1、2~3 、4~6 及7~9分计为阴性(-)、弱阳性(+)、阳性(++)及强阳性(+++),前2项为阴性,后2项为阳性。
1.2.3Western blot检测 取组织标本50 mg,加RIPA裂解液提取总蛋白,使用Bradford法测定蛋白质浓度;取50 μg进行SDS-PAGE凝胶电泳,电泳后转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉4 ℃封闭过夜;分别加GRP78、PERK及p-PERK抗体(浓度均为1 ∶500),4 ℃孵育过夜;次日经TBST缓冲液洗膜后加辣根过氧化物酶 (horseradish peroxidase,HRP) 标记的二抗(浓度1 ∶2 000),室温孵育1 h洗膜,化学发光(enhanced chemiluminescence,ECL)法显色。选取GAPDH作为内参照,用凝胶分析软件对图像进行分析,测定蛋白灰度值,以GAPDH及其相应总蛋白计算各蛋白的相对表达量。
1.2.4临床病理特征资料 收集所有患者的临床资料和术后病理资料,包括年龄、性别、术前甲胎蛋白(alpha-fetoprotein,AFP)水平、肿瘤大小及病理分化类型(高分化、中分化和低分化)。
1.3 统计学分析
数据采用SPSS 22.0统计软件处理,等级计数资料采用率(%)表示,率的比较采用χ2检验,采用Pearson法对GRP78和p-PERK蛋白的阳性表达进行相关性分析,P<0.05认为差异有统计学意义。
2 结果
2.1 组织形态学
光镜下可见癌旁组细胞形态正常,排列紧密且规律,细胞组织结构完整、清晰;高分化组HCC细胞呈多角形、胞浆丰富、颗粒状、嗜伊红,胞核较大、核膜厚、染色质多集中于核膜周围、核仁大而明显;中分化组HCC细胞介于高、低分化HCC细胞,形态多样,胞浆稍丰富,胞核大。低分化组HCC细胞明显异形、胞浆较少,胞核明显增大、深染、核浆比例增高、可见核膜反褶,胞浆内含、伊红染色的核内包涵体,并可见核分裂相和瘤巨细胞,癌细胞可排列呈梁状、腺样,肿瘤间质一般稀少。见图1。
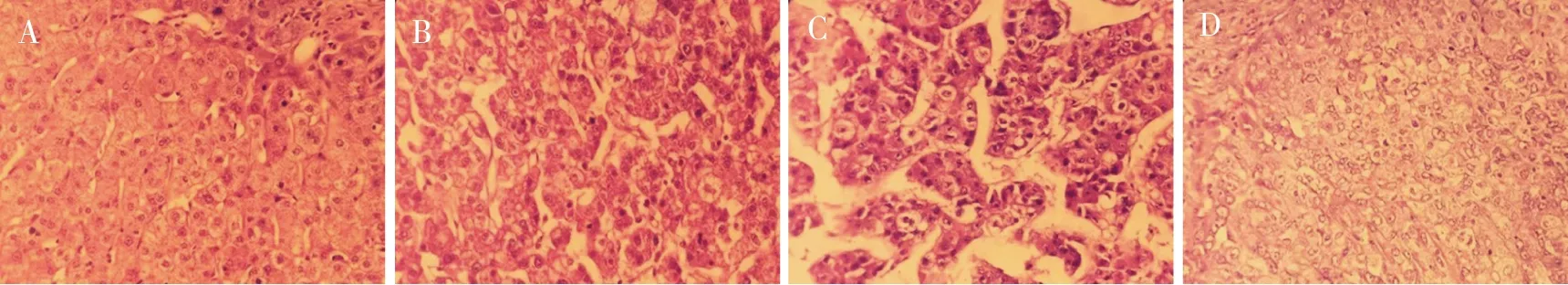
注:A为癌旁组,B为高分化HCC组,C为中分化HCC组,D为低分化HCC组。
2.2 免疫组织化学染色
HCC组标本可见GRP78和p-PERK蛋白的阳性染色主要位于细胞胞质内,低分化组标本胞质可见大量呈弥漫点状棕黄色颗粒染色,高分化组标本胞质中可见呈浅棕黄的颗粒染色,中分化组标本胞质中的阳性染色率和颗粒染色颜色介于高、低分化组之间,癌旁组标本胞质内几乎未见阳性染色颗粒;与癌旁组相比,高、中、低分化组标本GRP78和p-PERK阳性细胞得分均增加,差异有统计学意义(P<0.05);比较不同分化组可见,GPR78及p-PERK阳性细胞得分随分化程度的降低而增加,差异有统计学意义(P<0.05)。见图2。
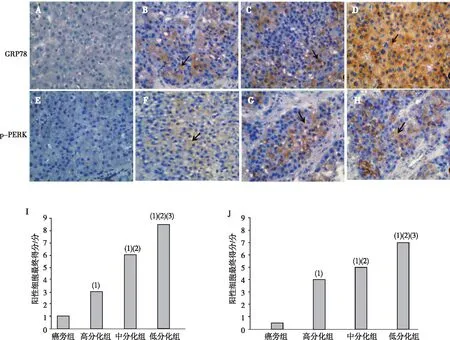
注:A~H为DAB染色结果(免疫组织化学,×400),A、E为癌旁组,B、F为高分化HCC组,C、G为中分化HCC组,D、H为低分化组,I、J分别为GRP78和p-PERK阳性表达得分,箭头表示阳性细胞;(1)与癌旁组比较,P<0.05;(2)与高分化组比较,P<0.05;(3)与中分化组比较,P<0.05。
2.3 Western blot结果
Western blot结果显示,高、中及低分化组标本中GRP78蛋白表达水平高于癌旁组,差异有统计学意义(P<0.05),且GRP78蛋白的表达量随着HCC分化程度的降低而增加,以低分化HCC组为最高(P<0.05);高、中及低分化HCC组标本p-PERK蛋白的表达水平分别高于癌旁组,差异有统计学意义(P<0.05),且p-PERK蛋白表达随着HCC分化程度降低而增高,以低分化HCC组最高(P<0.05)。见图3。
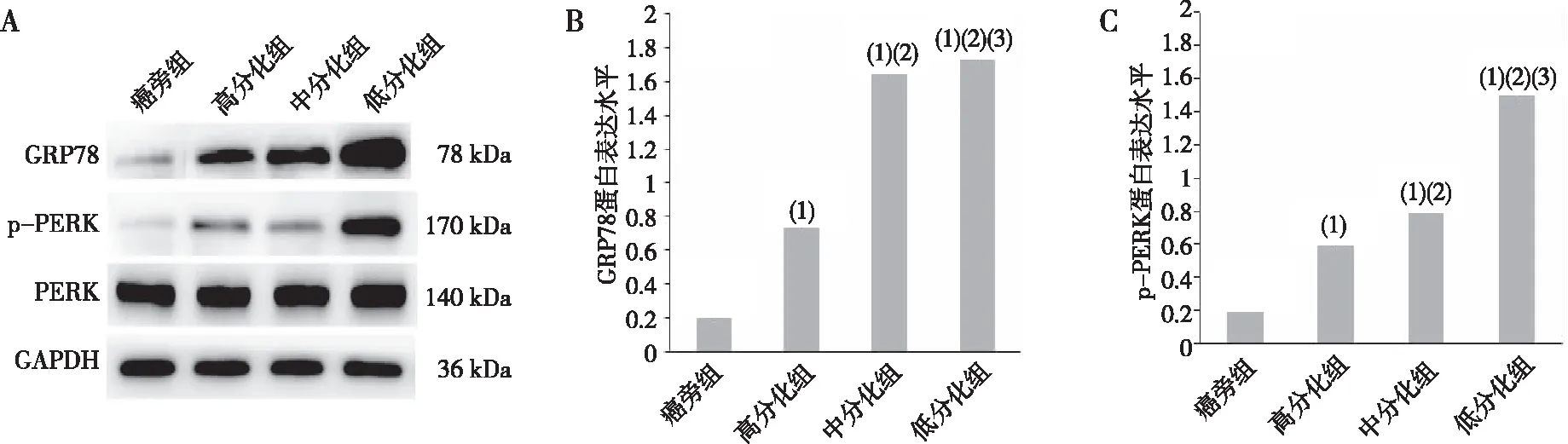
注:A为Western blot电泳条带,B、C分别为GRP78和p-PERK蛋白表达定量结果;(1)与癌旁组比较,P<0.05;(2)与高分化组比较,P<0.05;(3)与中分化组比较,P<0.05。
2.4 GRP78、p-PERK蛋白的阳性表达与患者临床病理特征的关系
HCC组标本GRP78、p-PERK蛋白的阳性表达与患者临床病理特征的关系进行分析,结果显示,GRP78、p-PERK蛋白的阳性表达与患者年龄、性别无关(P>0.05),GRP78蛋白阳性表达与患者术前AFP水平、肿瘤大小、肿瘤分化程度有关(P<0.05),p-PERK蛋白的阳性表达与肿瘤分化程度有关(P<0.05)、与术前AFP水平和肿瘤大小无关(P>0.05)。见表1。
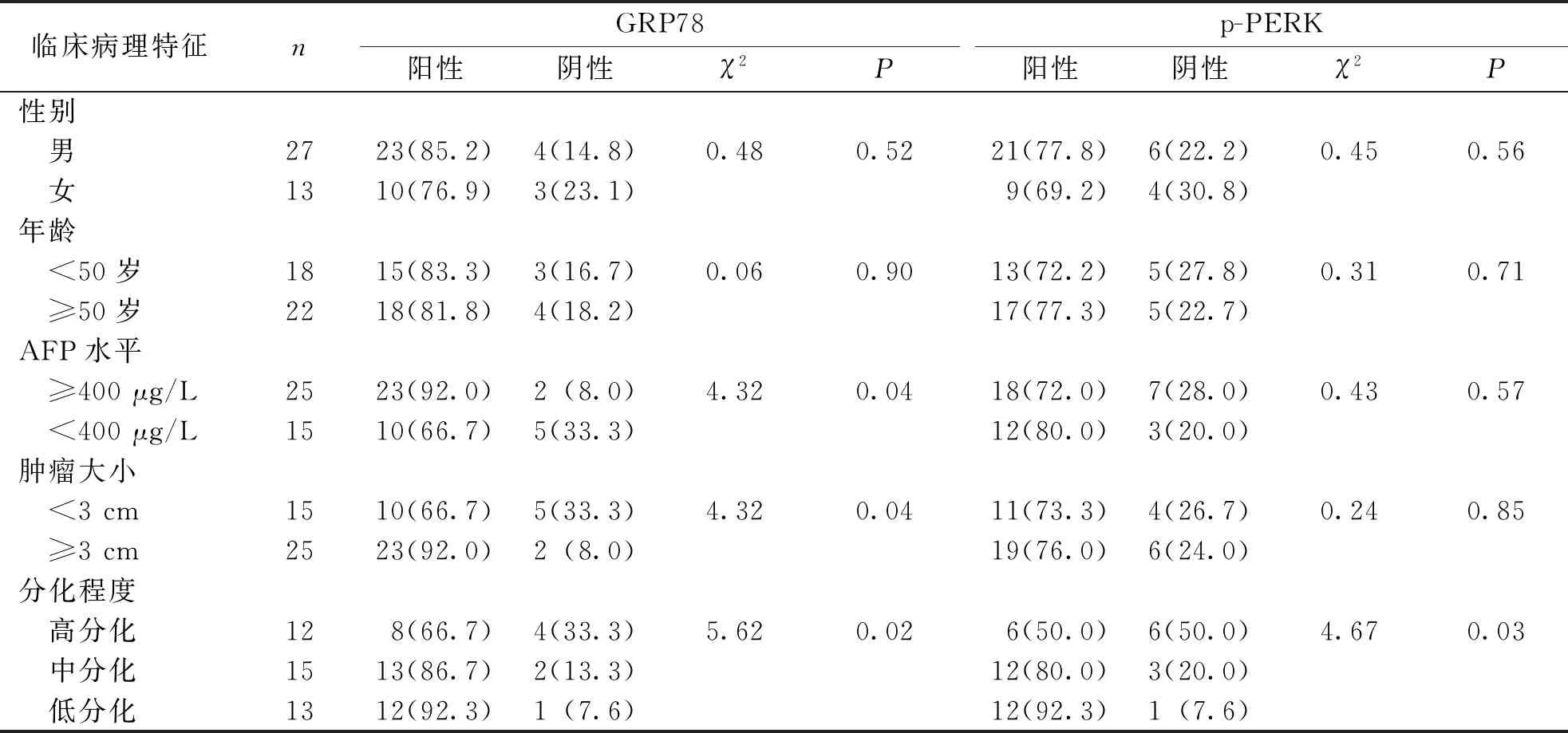
表1 HCC组织GRP78、p-PERK的表达与患者临床病理特征的关系[n(%)]
2.5 HCC组织GRP78、p-PERK蛋白表达的相关性
结果显示,GRP78和p-PERK蛋白表达之间呈正相关,差异有统计学意义(r=0.482,P=0.012)。
3 讨论
研究发现HCC同其他常见恶性肿瘤一样,因其肿瘤细胞过快生长增加糖的分解,其肝癌细胞主要为高糖代谢[12]。由于肿瘤生长速度过快而引起供血不足,使其肿瘤微环境具有严重低氧、酸中毒及环境葡萄糖的耗竭等相关特征[13]。此种微环境是导致ERS和引发未折叠蛋白反应(unfolded protein response,UPR)发生的最可能因素之一,UPR则对于促进应激细胞的功能恢复能够起到积极的影响,而其中GRP78高表达被认为是ERS激活的标志[14]。既往研究发现,GRP78蛋白表达水平升高具有以下影响[15-16]:(1)ERS使错误蛋白及未折叠蛋白的正常构像得以有效的恢复,因而细胞在应激状态下其蛋白质可正确地合成;(2)调节Ca2+平衡,即Ca2+在ER膜以肌醇三磷酸通路的激活而被陆续释放至胞质,使胞质、线粒体、内质网之中Ca2+保持平衡,同时还使内质网内Ca2+对氧化应激有对抗,这将使ERS得以减轻,而且也防止了细胞凋亡的产生;(3)它对ERS诱导的凋亡反应通路有促进作用。国内研究表明,与正常肝组织及肝硬化组织相比,肝癌组织GRP78蛋白表达水平明显更高[17-18]。本研究中,GRP78蛋白在HCC组织中表达,高分化组中GRP78蛋白表达最低,低分化组中表达最高,其表达与HCC的分化程度相关,与上述研究结论一致,因此可以推测GRP78参与了HCC的发生发展过程,即随着HCC恶性程度的增高,肿瘤细胞出现的严重低氧、酸中毒及环境葡萄糖的耗竭等微环境恶化越加明显,肿瘤细胞为了维持自身的生存,激活了UPR的保护性机制,而这种机制可能与促进HCC生存及发展有关。
大量研究发现,肿瘤的生存与发展与肿瘤新生血管生成有关[19-20]。ERS中PERK-eIF2α通路与新生血管形成关系密切,肿瘤细胞在缺氧条件下主要通过诱导缺氧诱导因子-1α(hypoxia-inducible factor lα,HIFlα)上调血管生成相关基因转录,促进新生血管的形成[21]。其中,血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是血管内皮细胞产生的、促进新生血管形成的最主要的调节因子。如Wang等[22]研究实验表明,PERK-eIF2α-ATF4通路可以直接作用于VEGF的启动子,上调VEGF的转录,下调血管生成抑制因子,促进新生血管的产生;胰岛素瘤模型也证明,PERK是肿瘤血管生成的必要条件,敲除PERK基因减少了血管的生成,相关的小鼠胚胎成纤维细胞中也证明了上述观点[23-26]。由此可以认为,肿瘤分化程度越低,细胞缺血缺氧微环境越需要新生血管生成,肿瘤组织血液供应则越丰富,而PERK-eIF2α通路则需要上调表达,而PERK 属于内质网应激 PERK-elF2α 信号转导通路的启动蛋白,并被胞质内结构域的自身二聚化和磷酸化激活[27],由此可以解释磷酸化PERK表达与肿瘤的分化程度相关。本研究发现,高、中、低分化组中p-PERK蛋白的表达均高于癌旁组,且HCC分化程度越低,p-PERK蛋白表达越高,由此推测PERK通路参与HCC的发生发展,p-PERK蛋白表达水平越高,可能造成了新生血管的形成增加,导致了HCC的分化程度也就越低。
此外,本研究还发现,HCC组织中GRP78和p-PERK蛋白的表达率与患者年龄、性别无关,GRP78蛋白表达与术前AFP水平、肿瘤大小、HCC分化程度均相关;p-PERK蛋白的表达率与肝癌的分化程度有关,进一步研究发现,HCC组织中GRP78、p-PERK蛋白的表达之间互相呈正相关关系(P<0.05),GRP78、p-PERK蛋白可能成为临床检测HCC及判断预后的肿瘤标志物。
综上所述,本研究发现内质网应激相关蛋白GRP78、p-PERK可能与HCC的分化程度和侵袭能力的增强有着密不可分的关系,即GRP78过表达表明ERS参与了HCC的发生发展过程,而p-PERK的高表达则考虑UPR中PERK-eIF2α通路发挥了作用,可能机制为上调VEGF,促进肿瘤新生血管生成,使肿瘤细胞适应严重低氧、酸中毒、环境葡萄糖的耗竭等微环境恶化,可能促进HCC发展有关。但本研究实验数据较少,并且缺乏mRNA水平方面研究,后期需加大样本量并开展mRNA水平研究,继续探究GRP78及PERK信号通路在HCC发生发展中可能存在的机理。
