黄连解毒汤通过调控巨噬细胞极化防治动脉粥样硬化的机制
2021-06-15李弼仁李海怡朱泳罗川晋
李弼仁 李海怡 朱泳 罗川晋

中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)08-0939-06
DOI 10.6039/j.issn.1001-0408.2021.08.08
摘 要 目的:研究黄连解毒汤对动脉粥样硬化(AS)模型小鼠M1、M2型巨噬细胞极化的调控作用,初步阐明其防治AS的机制。方法:将60只雄性ApoE-/-小鼠随机分为空白对照组、模型组、辛伐他汀组[阳性对照,5 mg/(kg·d)]和黄连解毒汤低、中、高剂量组[5、10、20 mg/(kg·d),以生药总量计],每组10只。除空白对照组外,其余各组小鼠均饲以高脂饲料复制AS模型。造模结束后,各药物组小鼠灌胃相应药液,空白对照组和模型组小鼠灌胃生理盐水。每天给药1次,连续4周。给药结束后,采用全自动生化仪检测小鼠血清中三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)含量,采用天狼猩红染色法观察小鼠主动脉胶原纤维形成情况,采用酶联免疫吸附测定法检测小鼠血清中诱导型一氧化氮合酶(iNOS)、甘露糖受体(CD206)含量,采用实时荧光定量-聚合酶链式反应法检测小鼠主动脉中白细胞介素1β(IL-1β)、iNOS、肿瘤坏死因子α(TNF-α)、IL-10、类几丁质酶3样分子(YM1)、炎症区域分子1(Fizz1) mRNA的表达水平。结果:与空白对照组比较,模型组小鼠血清中TC、TG、LDL-C、iNOS含量以及主动脉中IL-1β、iNOS、TNF-α mRNA的表达水平均显著升高(P<0.05或P<0.01),血清中HDL-C、CD206含量以及主动脉中IL-10、YM1、Fizz1 mRNA的表达水平均显著降低(P<0.01);主动脉血管内皮下可见厚厚一层胶原纤维。与模型组比较,各药物组小鼠上述血清指标均显著改善(P<0.05或P<0.01);且黄连解毒汤中、高剂量组小鼠主动脉中IL-1β、TNF-α、iNOS mRNA的表达水平均显著降低(P<0.05或P<0.01),IL-10、YM1、Fizz1 mRNA的表达水平均显著升高(P<0.05或P<0.01),且其血管内皮相对光滑。结论:黄连解毒汤可通过抑制M1型巨噬细胞极化、促进M2型巨噬细胞极化,减少炎症反应,维持动脉内粥样斑块的稳定性,从而发挥抗AS的作用。
关键词 黄连解毒汤;动脉粥样硬化;巨噬细胞极化;小鼠
Mechanism of Huanglian Jiedu Decoction in Preventing and Treating Atherosclerosis by Regulating Macrophage Polarization
LI Biren1,LI Haiyi2,ZHU Yong2,LUO Chuanjin3(1. Emergency Department, Hainan Provincial Hospital of TCM, Haikou 570100, China; 2. The First Clinical Medical College, Guangzhou University of TCM, Guangzhou 510405, China; 3. Dept. of Cardiovascular Disease, the First Affiliated Hospital of Guangzhou University of TCM, Guangzhou 510405, China)
ABSTRACT OBJECTIVE: To study the regulation effects of Huanglian jiedu decoction on M1 and M2 macrophage polarization in atherosclerosis (AS) model mice, and to elucidate its mechanism of AS prevention and treatment. METHODS: Sixty ApoE-/- male mice were randomly divided into blank control group, model group, simvastatin group [positive control, 5 mg/(kg·d)], Huanglian jiedu decoction low-dose, medium-dose and high-dose groups [5, 10, 20 mg/(kg·d),by crude drug], with 10 mice in each group. Except for blank control group, other groups were given high-fat diet to induce AS model. After modeling, administration groups were given relevant medicine intragastrically; blank control group and model group were given normal saline intragastrially, once a day, for consecutive 4 weeks. After medication, the contents of triglyceride (TG), total cholesterol (TC), low density lipoprotein cholesterol (LDL-C) and high density lipoprotein cholesterol (HDL-C) in serum were detected by automatic biochemical analyzer. Sirius red staining was used to observe the formation of collagen fibers in the aorta of mice. The serum contents of iNOS and CD206 were determined by ELISA. mRNA expression levels of IL-1β, iNOS, TNF-α, YM1 and Fizz1 in the aorta were detected by RT-PCR. RESULTS: Compared with blank control group, the serum contents of TC, TG, LDL-C and iNOS, mRNA expression levels of IL-1β, iNOS, TNF-α in the aorta were significantly increased in model group (P<0.05 or P<0.01), while the serum contents of HDL-C and CD206 and mRNA expression levels of IL-10, YM1, Fizz1 in the aorta were significantly decreased (P<0.01). There was a thick layer of collagen fibers under the endothelium of aorta. Compared with model group, above serum indexes of mice were improved significantly in administration groups (P<0.05 or P<0.01); mRNA expression levels of IL-1 ,iNOS and TNF-α in the aorta in Huanglian jiedu decoction medium-dose and high-dose groups were decreased significantly (P<0.01), while mRNA expression levels of IL-10, YM1 and Fizz1 were increased significantly (P<0.05 or P<0.01). The vascular endothelium was relatively smooth. CONCLUSIONS: Huanglian jiedu decoction can inhibit the polarization of M1 macrophages and promote the polarization of M2 macrophages, reduce the inflammatory reaction, maintain the stability of atherosclerotic plaque in artery, so as to play the role of anti-AS.
KEYWORDS Huanglian jiedu decoction; Atherosclerosis; Macrophage polarization; Mice
动脉粥样硬化(AS)是一种由脂质沉积、内皮损伤、脂纹及纤维斑块形成等一系列病理改变而导致的慢性炎症性疾病[1]。据《中国心血管病报告2018》显示,随着人们生活水平的提高及飲食习惯的改变,我国心血管疾病患者呈现出低龄化趋势,且患病人数逐年攀升;同时,该病死亡率赶超癌症死亡率,跃居首位,成为我国重大公共卫生问题[2]。AS是诱发多种心血管疾病的病理、生理基础,因此防治AS是降低心血管疾病发病率的重要环节之一[3]。研究表明,巨噬细胞在AS的发生发展中具有关键作用[4]。巨噬细胞有M1和M2两个主要分型,抑制M1型巨噬细胞极化在控制AS斑块形成及斑块稳定性方面有重要作用,而促进M2型巨噬细胞极化则可抑制炎症反应并稳定易损斑块[5-6]。
当前,临床用于治疗AS的药物众多,其中黄连解毒汤在抗AS方面疗效确切[7]。黄连解毒汤首载于《肘后备急方》,由黄连、黄柏、黄芩、栀子等4味中药组成,具有清热燥湿、泻火解毒之功效[8]。相关研究认为,该方可通过抑制巨噬细胞炎症因子的活化而实现对AS斑块周围炎症的控制[9],但其具体作用机制尚未完全明确。鉴于巨噬细胞发生极化后可调控炎症因子的活化,对介导炎症的发生与发展具有重要作用[10]。因此,本研究通过探讨黄连解毒汤对AS模型小鼠M1、M2型巨噬细胞极化的影响,初步阐释该方防治AS的机制,以期为其抗AS治疗新靶点的挖掘提供参考依据。
1 材料
1.1 主要仪器
Filter Max F3型酶标仪购自美国Molecular Devices公司;BS-220型全自动生化分析仪购自深圳迈瑞生物医疗电子有限公司;BX-2型生物显微镜购自日本Olympus公司;EG1150C型包埋机、SM2000R型石蜡滑动式切片机均购自德国Leica公司;PIDRed 96型聚合酶链式反应(PCR)扩增仪购自德国Biometra公司;Allegra X-15R型医用离心机购自美国Beckman Coulter公司。
1.2 主要药品与试剂
黄连(批号190101)、黄芩(批号190144)、黄柏(批号190245)、栀子(批号190785)药材均购自广东康美药业股份有限公司,由广州中医药大学第一附属医院心血管内科罗川晋副主任医师鉴定均为真品。辛伐他汀片(批号B14201903078,规格20 mg)购自荷兰Merck Sharp & Dohme B. V.公司;三酰甘油(TG)试剂盒(批号23743786)、总胆固醇(TC)试剂盒(批号23451352)、低密度脂蛋白胆固醇(LDL-C)试剂盒(批号23377461)、高密度脂蛋白胆固醇(HDL-C)试剂盒(批号23460237)均购自美国Thermo Fisher Scientific公司;诱导型一氧化氮合酶(iNOS)酶联免疫吸附测定(ELISA)检测试剂盒(批号A12257)、甘露糖受体(CD206)ELISA检测试剂盒(批号A14319)、SYBR Green试剂盒(批号AP1479)、TRIzol试剂、天狼猩红饱和苦味酸溶液、苏木精试剂均购自美国ABclonal Technology公司;cDNA合成试剂盒(批号ED37958r)、荧光定量-PCR试剂盒(批号ED47823r)均购自广州晶欣生物科技有限公司;PCR实验中各基因引物序列均由赛默飞世尔科技(中国)有限公司设计、合成;其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 动物
SPF级ApoE-/-小鼠60只,雄性,2月龄,体质量15~25 g,由广州中医药大学实验动物中心提供,动物生产许可证号为SCXK(粤)2018-0034。所有动物均饲养于温度(22±2)℃、相对湿度50%的动物房内。饲养期间自由摄食、饮水,适应性喂养1周后用于实验。本研究得到了广州中医药大学动物实验伦理委员会的批准。
2 方法
2.1 黄连解毒汤的制备
按黄连解毒汤的药材组成称取相应药材(黄连9 g、黄芩6 g、黄柏6 g、栀子9 g),先以8倍量(mL/g)水浸泡1 h,然后煮沸,再改为文火煎煮30 min,趁热用纱布滤过,收集滤液;待滤液自然滴尽后,药渣再次加6倍量水(mL/g)煮沸,然后改文火再煎煮30 min,趁热用纱布滤过,收集滤液。合并2次滤液,并加热浓缩成2 g/mL(以生药总量计)的药液,分装后置于4 ℃冰箱中保存,于灌胃前0.5 h取出并加热。
2.2 分组、造模与给药
将60只ApoE-/-小鼠随机分为空白对照组、模型组、辛伐他汀组[阳性对照,5 mg/(kg·d),剂量参考文献[11]设置]和黄连解毒汤低、中、高剂量组[5、10、20 g/(kg·d),以生药总量计,剂量参考文献[12]设置],每组10只。空白对照组小鼠予以常规饲料,其余5组小鼠均采用高脂饲料[由基础饲料(81%)、猪油(15%)、蛋黄粉(2%)、胆固醇(1.5%)和0.5%胆酸钠(1.5%)组成]喂养12周以建立AS模型(以小鼠血管内皮损伤且内皮下可见厚厚一层胶原纤维为模型复制成功)[13]。造模结束后,各药物组小鼠灌胃相应药液(辛伐他汀组灌胃体积为0.5 mL/kg,黄连解毒汤低、中、高剂量灌胃体积分别为2.5、5、10 mL/kg),空白对照组和模型组小鼠灌胃生理盐水(0.5 mL/kg)。每天给药1次,连续4周。
2.3 小鼠血清中血脂指标含量检测
于末次给药后24 h,小鼠摘眼球取血3 mL,静置1 h,然后以3 000 r/min离心10 min,收集上层血清。严格按照相应试剂盒说明书方法操作,采用全自动生化分析仪检测各组小鼠血清中TC、TG、LDL-C、HDL-C含量。
2.4 小鼠主动脉血管内皮胶原纤维观察
采用天狼猩红染色法进行观察。取血后,腹腔注射3%戊巴比妥溶液对小鼠进行麻醉,然后取其胸主动脉组织适量,放入4%多聚甲醛溶液中固定过夜,经常规梯度乙醇脱水、二甲苯透明、浸蜡、石蜡包埋后切片(厚度约5 μm)。取上述切片脱蜡至水,加入1%天狼猩红饱和苦味酸溶液染色1 h;用水冲洗5 min,加入苏木精试剂复染5 min;用水沖洗5 min,然后经乙醇逐级脱水、二甲苯透明后,用中性树脂封片。采用生物显微镜观察小鼠血管内皮胶原纤维的形成情况(镜下,胶原纤维染色后呈红色,细胞核呈蓝色)。
2.5 小鼠血清中iNOS 、CD206含量检测
采用ELISA法进行检测。取“2.2”项下血清样品适量,严格按照相应试剂盒说明书方法操作,使用酶标仪检测各组小鼠血清中iNOS、CD206的含量。
2.6 小鼠主动脉中M1、M2型巨噬细胞极化相关因子mRNA表达水平检测
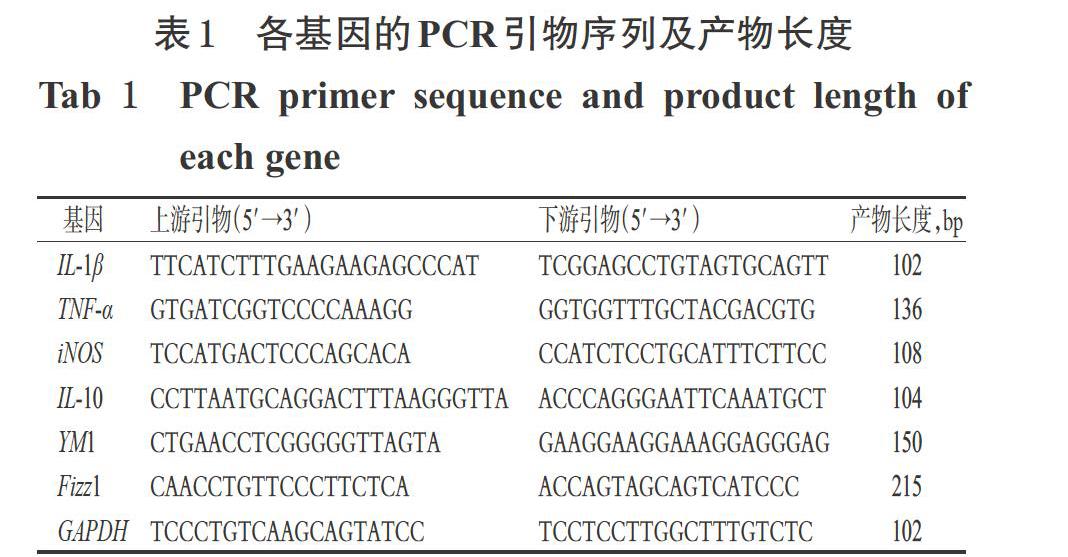
采用实时荧光定量-PCR法进行检测。其中,M1型巨噬细胞分型相关标志物和细胞因子有白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)和iNOS;M2型巨噬细胞分型相关标志物和细胞因子有IL-10、类几丁质酶3样分子(YM1)和炎症区域分子1(Fizz1)。取小鼠胸主动脉组织,采用TRIzol法提取总RNA,鉴定其浓度和纯度后,将总RNA反转录成cDNA,并以cDNA为模板,进行PCR扩增。反应体系(共20 μL)含上、下游引物各2 μL,cDNA模板4 μL,SYBR荧光染料10 μL,无核酸酶水2 μL;PCR反应条件为95 ℃预变性30 s;95 ℃变性5 s,55 ℃退火10 s,72 ℃延伸15 s,共40个循环;最后再以80 ℃再延伸15 s[12]。以GAPDH基因为内参,采用2-ΔΔCt法计算各目标基因mRNA的表达水平。各基因的PCR引物序列及产物长度见表1。
2.7 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 黄连解毒汤对AS模型小鼠血清中血脂指标含量的影响
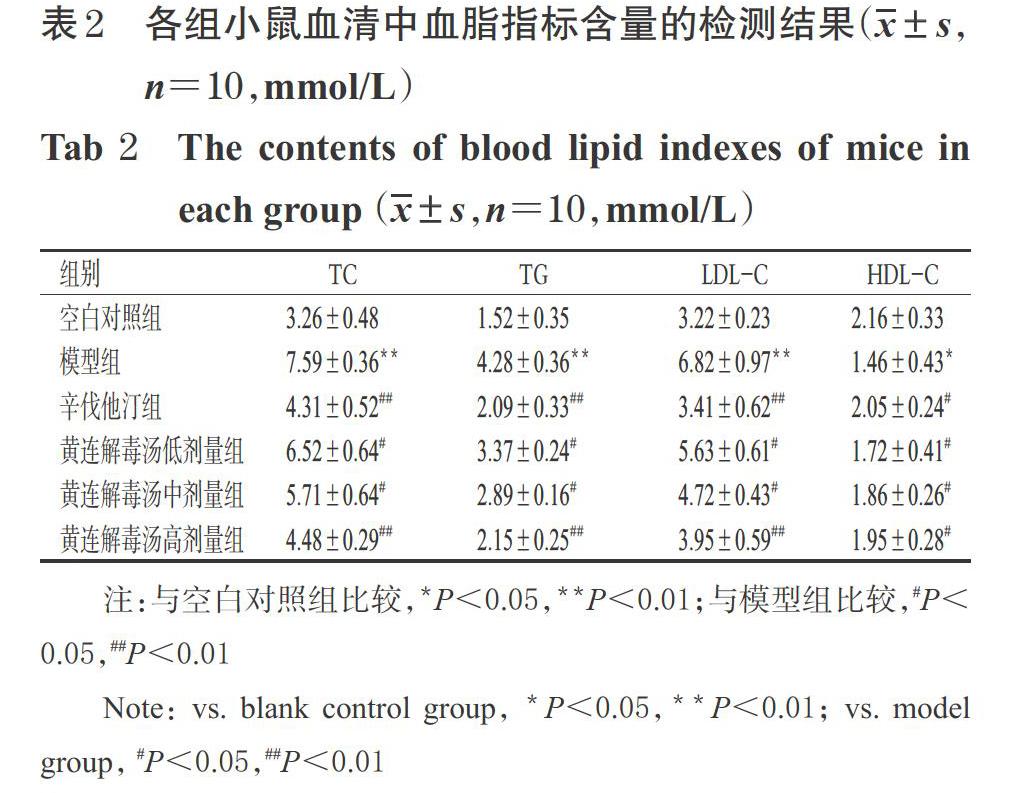
与空白对照组比较,模型组小鼠血清中TC、TG、LDL-C含量均显著升高(P<0.01),HDL-C含量显著降低(P<0.05)。与模型组比较,各药物组小鼠血清中TC、TG、LDL-C含量均显著降低(P<0.05或P<0.01),HDL-C含量均显著升高(P<0.05)。各组小鼠血清中血脂指标含量的检测结果见表2。
3.2 黄连解毒汤对AS模型小鼠主动脉血管内皮胶原纤维的影响
空白对照组小鼠主动脉血管内皮光滑,可见内皮细胞及内皮下弹力纤维,未见内皮下胶原纤维形成。模型组小鼠主动脉血管内皮损伤明显,内皮下可见厚厚一层胶原纤维。黄连解毒汤低、中剂量组小鼠在主动脉血管内皮和弹力纤维之间可见一层薄薄的胶原纤维;辛伐他汀组和黄连解毒汤高剂量组小鼠主动脉血管内皮较光滑。各组小鼠主动脉血管内皮胶原纤维观察的显微图见图1(图中,箭头所指为胶原纤维)。
3.3 黄连解毒汤对AS模型小鼠血清中iNOS、CD206含量的影响
与空白对照组比较,模型组小鼠血清中iNOS含量显著升高(P<0.01),CD206含量显著降低(P<0.01)。与模型组比较,各药物组小鼠血清中iNOS含量均显著降低(P<0.05或P<0.01),CD206含量均显著升高(P<0.05或P<0.01)。各组小鼠血清中iNOS、CD206含量的检测结果见表3。
3.4 黄连解毒汤对AS模型小鼠主动脉中M1、M2型巨噬细胞极化相关因子mRNA表达水平的影响
与空白对照组比较,模型组小鼠主动脉中IL-1β、 iNOS、TNF-α mRNA的表达水平均显著升高(P<0.01),IL-10、YM1、Fizz1 mRNA的表达水平均显著降低(P<0.05)。与模型组比较,辛伐他汀组和黄连解毒汤中、高剂量组小鼠主动脉中IL-1β、iNOS、TNF-α mRNA的表达水平均显著降低(P<0.05或P<0.01),而IL-10、YM1、Fizz1 mRNA的表达水平均显著升高(P<0.05或P<0.01)。各组小鼠主动脉中M1、M2型巨噬细胞极化相关因子mRNA表达水平的检测结果见表3。
4 讨论
AS是临床常见的慢性炎症性疾病,以动脉血管内膜形成粥瘤或纤维斑块为主要特征,可并发多种心血管疾病[14]。AS是现代医学疾病名称,历代祖国医学典籍并未对此病名进行明确记载,但根据AS的临床表现可将其归为中医学的“胸痹心痛”“真心痛”“痰淤”等范畴[15]。相关中医药理论认为,由于气滞、血瘀、痰凝等病理实邪引起热毒内蕴、灼伤脉络,以致络脉拘挛不通、五脏虚损,故发此病[16-18]。基于此,临床上常采用“清热解毒法”防治AS[16]。辛伐他汀是临床用于治疗AS性疾病的有效药物[17],所以本研究选其为阳性对照药物。
黄连解毒汤由黄连、黄芩、黄柏、栀子等4味中药配伍组成,系清热解毒之经典代表方[8,18]。《汤液本草》言,“黄连归心经,黄芩、栀子走肺经,黄檗(即黄柏)归肾经,皆能清热燥湿,各从其类也”。本方中,以苦寒之黄连为君药,主清热燥湿、分泻心火兼中焦之火;臣以黄芩消肿止痛、清泻肺热及上焦之火;佐以黄柏,发挥解毒疗疮、除湿兼泻下焦之火的功效;又佐以栀子引热下行、通泻三焦之火。四药联用,苦寒直折,正切合“热毒蕴结”之病机,有泻火解毒、清热化湿之功,常用于治疗实热火毒、三焦热盛之证[8]。现代药理学研究证实,黄连解毒汤稳定斑块、抑制炎症、抗AS等药理作用突出[19],且临床用于AS及其他心血管相关疾病有确切疗效[20-22]。研究表明,该药可能通过抑制炎症因子的活化,从而实现对AS斑块周围炎症的控制[9];另有研究基于体外实验证实了黄连解毒汤可通过影响M1、M2型巨噬细胞的极化而实现稳定斑块的作用[23-25],但尚未通过体内实验阐明其具体作用机制。
炎症反应贯穿AS的始终,反应过程涉及多种炎性细胞及介质,其中由单核细胞激化后形成的巨噬细胞在AS发生发展的各个阶段都起着关键的调控作用[13,26]。病理状态下,动脉管壁脂质累积,单核-巨噬细胞系统通过氧化吞噬LDL-C转化为泡沫细胞,从而引发过度炎症反应,并导致纤维斑块稳定性降低,进而加剧AS病变[27-28]。在不同诱导因素介导下,具有可塑性和异质性的巨噬细胞可根据刺激条件不同而分化为经典途径中的激活型巨噬细胞(M1型极化)和替代途径中的激活型巨噬细胞(M2型极化)两种亚型[29]。前者主要分布于不稳定斑块中,可分泌大量促炎细胞因子(如IL-1β、TNF-α、iNOS等),并可高表达促炎细胞因子参与炎症反应、病原菌清除和活性氧表达,发挥促生粥样斑块、破坏粥样斑块稳定性的作用,从而促进早期AS的发展[30-31];后者主要分布于稳定斑块中,可诱导IL-10、YM1、Fizz1、CD206等抗炎细胞因子高表达,从而增强免疫系统清除凋亡细胞的能力、抑制炎症反应的发生并维持斑块的稳定性,在AS后期起保护作用[31-32]。研究指出,在不同微环境及条件下,不同巨噬细胞亚型在不同疾病阶段的分布位置及占比均有所不同,各亚型巨噬细胞之间的比例决定着AS斑块的稳定性及疾病的转归[29,32]。
本研究结果显示,不同剂量的黄连解毒汤均能不同程度地降低AS模型小鼠血清中TC、TG、LDL-C含量,升高其HDL-C含量,并有效减少脂质堆积并减少胶原纤维的形成,表明黄连解毒汤具有明显的抗AS作用,其中以高剂量黄连解毒汤的总体效果最好。同时,经黄连解毒汤干预后,AS模型小鼠血清中MI型巨噬细胞极化相关因子iNOS含量明显降低,M2型巨噬细胞极化相关因子CD206含量显著升高,这提示该药能有效抑制M1型巨噬细胞极化,促进M2型巨噬细胞极化;此外,AS模型小鼠主动脉中促炎因子IL-1β、iNOS、TNF-α mRNA的表达均明显上调,而抗炎因子IL-10、YM1、Fizz1 mRNA的表达均显著下调,说明黄连解毒汤可能通过抑制M1型巨噬细胞极化来下调模型小鼠主动脉中促炎因子mRNA的表达,并通过促进M2型巨噬细胞极化来上调抗炎因子mRNA的表达,进而抑制炎症反应的发生并维持动脉内斑块的稳定性,最终达到降低或延缓AS进程的目的。
综上所述,黄连解毒汤可通过抑制M1型巨噬细胞极化、促进M2型巨噬细胞极化,减少炎症反应,维持动脉内粥样斑块的稳定性,从而发挥抗AS的作用。但本研究只基于体内整体变化的宏观数据来分析黄连解毒汤对AS模型小鼠主动脉巨噬细胞极化的影响,而有关该方干预巨噬细胞极化的具体机制仍有待进一步研究。
参考文献
[ 1 ] 王喜欢,张金华,胡亚南,等.大蒜素对高脂饮食ApoE-/-小鼠动脉粥样硬化形成的影响[J].中国动脉硬化杂志,2017,25(2):140-144.
[ 2 ] 胡盛寿,杨跃进,郑哲,等.《中国心血管病报告2018》概要[J].中国循环杂志,2019,34(3):209-220.
[ 3 ] 王莹,宋囡,冷雪,等.四君子汤对高脂诱导ApoE-/-小鼠致动脉粥样硬化主动脉线粒体能量代谢的影响[J].中华中医药学刊,2020,38(8):174-178、279-280.
[ 4 ] TABAS I,BORNFELDT K E. Macrophage phenotype and function in different stages of atherosclerosis[J]. Circ Res,2016,118(4):653-667.
[ 5 ] CHINETTI-GBAGUIDI G,COLIN S,STAELS B. Macrophage subsets in atherosclerosis[J]. Nat Rev Cardiol,2015,12(1):10-17.
[ 6 ] COCHAIN C,ZERNECKE A. Macrophages in vascular inflammation and atherosclerosis[J]. Pflügers Arch,2017,469(3/4):1-15.
[ 7 ] 何武,杨键,蒋敏玲,等.清热解毒法对颈动脉粥样硬化的影响[J].中国中医药现代远程教育,2017,15(24):50-51.
[ 8 ] 项瑞,姜丽.黄连解毒汤抗AS物质基础和药理作用研究概况[J].中国药房,2016,27(4):547-549.
[ 9 ] 于红红,吴玛莉,张智伟,等.黄连解毒汤含药血清对脂多糖诱导的巨噬细胞炎症因子影响研究[J].亚太传统医药,2016,12(14):11-13.
[10] LIU Y,WANG X,PANG J,et al. Attenuation of atherosclerosis by protocatechuic acid via Inhibition of M1 and promotion of M2 macrophage polarization[J]. J Agric Food Chem,2019,67(3):807-818.
[11] 周凤华,程赛博,张宇,等.黄连解毒汤通过调节性T細胞产生抗动脉粥样硬化作用[J].中国实验动物学报,2016,24(3):233-238.
[12] 马雅銮,王蓓蓓,韩俊燕,等.黄连解毒汤对高脂饮食ApoE-/-小鼠全身和主动脉血管局部免疫反应影响的研究[J].中国中西医结合杂志,2013,33(11):1520-1525.
[13] 孙治中,江艳君,纪树亮,等.黄芩苷治疗小鼠AS模型的作用与机制[J].中国组织工程研究,2019,23(19):91-97.
[14] 于红红,吴玛莉,张智伟,等.黄连解毒汤含药血清对巨噬细胞自噬相关基因表达的影响[J].中国免疫学杂志,2016,32(8):1150-1152、1164.
[15] 侯仙明,司秋菊,贾云芳,等.动脉粥样硬化中医病因病机浅论[J].河北中医药学报,2018,33(6):9-11、54.
[16] 张艳,宫丽鸿,礼海.浅谈AS的中医病因病机[J].时珍国医国药,2010,21(5):1125-1126.
[17] LI D Q,LV F F,LI Z C,et al. Anti-atherosclerotic effects between a combined treatment with simvastatin plus hirudin and single simvastatin therapy in patients with early type 2 diabetes mellitus[J]. Ann Transl Med. 2019,7(14):302.
[18] 何小莲,王嵩.黄连解毒汤在心血管疾病防治中的应用[J].解放军预防医学杂志,2019,37(6):190-191、194.
[19] 余兰彬,陈雨,徐国良,等.基于抗炎和氧化应激角度研究黄连解毒汤对AS大鼠作用机制[J].世界科学技术:中医药现代化,2017,19(11):1841-1845.
[20] 韦燕妮,黄启辉.黄连解毒汤治疗心血管系统疾病的药理研究进展[J].中西医结合心脑血管病杂志,2017,15(5):562-565.
[21] 刘亚荣,孙婧.黄连解毒汤对颈AS作用观察及部分机制探析[J].世界中医药,2019,14(10):2688-2692.
[22] 李淑玲,马春,杨丽华.黄连解毒汤对颈AS作用的研究进展[J].中国老年学杂志,2016,36(3):746-747.
[23] 王稳平.基础治疗结合黄连解毒汤对冠心病病人颈总AS斑块和炎症因子的影响[J].中西医结合心脑血管病杂志,2017,15(24):3151-3153.
[24] 盛蒙,许滔,于红红,等.黄连解毒汤含药血清激活PPARγ诱导RAW264.7源性泡沫细胞向M2表型极化[J].中国免疫学杂志,2020,36(3):277-281、288.
[25] 许丽婷,徐彬人,盛蒙,等.黄连解毒汤含药血清对泡沫细胞ABCA1表达与胆固醇含量的影响[J].中国民族民间医药,2020,29(6):10-13.
[26] 黄科,周瑶瑶.姜黄素通过影响巨噬细胞的极性延缓AS进展[J].中国动脉硬化杂志,2019,27(5):386-390.
[27] 景昱,王宣春.巨噬细胞内脂质代谢及泡沫细胞形成机制的研究进展[J].国际心血管病杂志,2020,47(3):143- 147.
[28] 孙小淋,鲁敏,楚英杰.巨噬细胞的异质性与动脉粥样硬化[J].中华心血管病杂志,2019,47(8):660-663.
[29] TAILLEUX A,HAULON S,ZAWADZKI C,et al. Human atherosclerotic plaque alternative macrophage display low cholesterol handling but high phagocytosis because of distinct activities of the PPAR and LXR pathways[J]. Circ Res,2011,108(8):985-995.
[30] 代长良,田野.巨噬细胞在动脉粥样硬化及血管炎症中作用的研究进展[J].心血管康复医学杂志,2021,30(1):75-78.
[31] 吴艾霖,熊怡淞.冠心病患者血浆相关细胞因子检测及临床意义[J].国际检验醫学杂志,2013,34(5):536-538.
[32] 李亮,林丰夏,曾志聪,等.中医药在自噬与AS关系中的干预作用新进展[J].四川中医,2020,38(5):214-217.
(收稿日期:2020-09-16 修回日期:2021-03-24)
(编辑:林 静)
