芒果苷对胰岛素抵抗HepG2细胞糖脂代谢的影响
2021-06-15黎梓霖金惠杰方佳刘奕明林爱华
黎梓霖 金惠杰 方佳 刘奕明 林爱华


中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)09-1082-07
DOI 10.6039/j.issn.1001-0408.2021.09.10
摘 要 目的:分析芒果苷(MGF)对胰岛素抵抗HepG2细胞(IR-HepG2细胞)糖脂代谢的影响,并探讨潜在机制。方法:以人肝癌HepG2细胞为对象,以1 mmol/L棕榈酸+2 mmol/L油酸联合培养建立IR-HepG2细胞模型。以盐酸二甲双胍为阳性对照,分別检测低、中、高浓度MGF(125、250、500 μmol/L)作用24 h对IR-HepG2细胞中校正葡萄糖耗氧量和三酰甘油(TG)、总胆固醇(TC)含量的影响;采用实时荧光定量聚合酶链式反应技术检测细胞中腺苷一磷酸活化蛋白激酶(AMPK)通路上游关键因子脂联素(APN)、脂联素受体2(AdipoR2)、APPL1、AMPK以及下游胰岛素信号通路关键因子胰岛素受体底物1(IRS-1)、蛋白激酶B(Akt)、葡萄糖转运体4(GLUT4)mRNA的相对表达量;采用Western blot法检测AMPK蛋白的磷酸化水平。结果:与对照组比较,模型组细胞校正葡萄糖消耗量和APN、AdipoR2、APPL1、AMPK、IRS-1、GLUT4 mRNA的相对表达量以及AMPK蛋白磷酸化水平均显著降低,TG、TC含量均显著升高(P<0.05或P<0.01);与模型组比较,各药物组校正葡萄糖消耗量和APN(MGF中、高浓度组除外)、AdipoR2、APPL1、AMPK(MGF中、高浓度组除外)、IRS-1(MGF中、高浓度组除外)、Akt(阳性对照组除外)、GLUT4(MGF高浓度组除外)mRNA的相对表达量以及AMPK蛋白磷酸化水平均显著升高,TG、TC含量均显著降低(P<0.05或P<0.01)。结论:芒果苷可能通过激活通路上游靶点APN,进而调控AMPK信号通路,从而促进IR-HepG2细胞对葡萄糖的摄取,降低TG、TC含量,发挥改善胰岛素抵抗及糖脂代谢异常状态的作用。
关键词 芒果苷;胰岛素抵抗;人HepG2细胞;糖脂代谢;腺苷一磷酸活化蛋白激酶信号通路;脂联素
Effects of Mangiferin on Glucose and Lipid Metabolism of Insulin-resistant HepG2 Cells
LI Zilin1,JIN Huijie1,FANG Jia1,LIU Yiming1,2,LIN Aihua3(1. Phase Ⅰ Clinical Trial Center, Guangdong Provincial Hospital of TCM/the Second Affiliated Hospital of Guangzhou University of TCM, Guangzhou 510120, China; 2. Guangdong Provincial Key Laboratory of Clinical Research on Traditional Chinese Medicine Syndrome, Guangdong Provincial Hospital of TCM/the Second Affiliated Hospital of Guangzhou University of TCM, Guangzhou 510120, China; 3. Dept. of Pharmacy, Guangdong Provincial Hospital of TCM/Zhuhai Hospital, the Second Affiliated Hospital of Guangzhou University of TCM, Guangdong Zhuhai 519000, China)
ABSTRACT OBJECTIVE: To analyze the effects of mangiferin (MGF) on glucose and lipid metabolism in insulin resistance (IR) HepG2 cells, and to explore the potential mechanism. METHODS: Using human hepatoma HepG2 cells as research objects, 1 mmol/L palmitic acid and 2 mmol/L oleic acid were used to establish the IR-HepG2 cell model. Using metformin hydrochloride as positive control, the effects of low-concentration, medium-concentration and high-concentration MGF (125, 250, 500 μmol/L) on the corrected glucose consumption, the contents of triglyceride (TG) and total cholesterol (TC) in IR-HepG2 cells were detected. The mRNA expression of APN, AdipoR2, APPL1, AMPK in the upstream of AMPK signaling pathway and IRS-1, Akt and GLUT4 in the downstream insulin signaling pathway were detected by RT-PCR. The phosphorylation level of AMPK protein was detected by Western blot assay. RESULTS: Compared with control group, corrected glucose consumption, mRNA expression of APN, AdipoR2, APPL1, AMPK, IRS-1 and GLUT4, as well as the phosphorylation level of AMPK protein were decreased significantly in model group, while the contents of TG and TC were increased significantly (P<0.05 or P<0.01). Compared with model group, corrected glucose consumption, mRNA expression of APN (except for MGF medium-concentration and high-concentration groups), AdipoR2, APPL1, AMPK (except for MGF medium-concentration and high-concentration groups), IRS-1(except for MGF medium-concentration and high-concentration groups), Akt(except for positive control group), GLUT4(except for MGF high-concentration group)were increased significantly in administration groups, while the contents of TG and TC were decreased significantly (P<0.05 or P<0.01). CONCLUSIONS: Mangiferin may activate APN, which is the upstream target of pathway, and then regulate AMPK signaling pathway, so as to promote glucose uptake of IR-HepG2 cells, reduce TG and TC contents, and improve IR and abnormal glucose and lipid metabolism.
KEYWORDS Mangiferin; Insulin resistance; Human HepG2 cells; Glucose and lipid metabolism; AMPK signaling pathway; APN
2型糖尿病(T2DM)多由胰岛素抵抗(IR)和B细胞功能障碍所致[1],其中IR主要表現为肝脏、肌肉、脂肪等靶组织对胰岛素的敏感性下降以及对葡萄糖的摄取及利用减少[2]。腺苷一磷酸活化蛋白激酶(AMPK)分布于各组织中,其活化后能增加机体对胰岛素的敏感性,改善IR和糖脂代谢紊乱,从而减轻T2DM相关症状[3]。有研究指出,脂联素(APN)为AMPK信号通路的上游靶点,是该信号通路中的关键信号分子,可通过与脂联素受体2(AdipoR2)结合而激活AMPK,而APPL1是AdipoR2与AMPK之间的关键衔接蛋白[4-5]。当AMPK被激活后,AMPK可进一步促进下游胰岛素信号通路中胰岛素受体底物1(IRS-1)的磷酸化,激活蛋白激酶B(Akt);Akt活化可促使细胞中的葡萄糖转运体4(GLUT4)由细胞质转移到细胞膜,从而促进葡萄糖的摄取和利用,最终改善IR[6]。
知母为百合科植物知母Anemarrhena asphodeloides Bge.的干燥根茎,其主要活性成分之一的芒果苷(MGF)具有改善IR和糖脂代谢紊乱的作用[7-8],且这种作用与AMPK及其下游胰岛素信号通路Akt和GLUT4的表达有关[9-10]。有研究表明,MGF能提升糖尿病IR模型大鼠血清中APN的含量[11],但其是否能通过激活这一上游靶点进而调控AMPK信号通路中的各关键因子的表达,尚有待进一步探讨。基于此,本研究以HepG2肝脏细胞IR模型(即IR-HepG2细胞模型)为对象,初步探讨了MGF对其糖脂代谢以及AMPK信号通路的影响,旨在为MGF改善T2DM患者IR的作用机制研究提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括3111型CO2细胞培养箱(美国Thermo Fisher Scientific公司)、Synergy H1型多功能酶标仪(美国BioTek公司)、HR40-ⅡA2型生物安全柜(广州火元医疗器械有限公司)、AB135-S型电子天平(瑞士Mettler Toledo公司)、Microfuge 16型台式微量离心机和Allegra X-22R型多功能台式冷冻离心机(美国Bechman Coulter公司)、7500型荧光定量基因扩增仪和Veriti型PCR逆转录仪(美国Applied Biosystems公司)、KS260型控制型摇床(德国KIA公司)、Min-protean Tetra型垂直电泳系统和ChemiDocTM型高灵敏度化学发光成像仪(美国Bio-Rad公司)等。
1.2 主要药品与试剂
MGF对照品(批号MUST-17040103,纯度98.21%)购自成都曼斯特生物科技有限公司;盐酸二甲双胍对照品(阳性对照,批号100664-201805,纯度98%)购自上海源叶生物科技有限公司;无脂肪酸牛血清白蛋白(BSA,批号WXBC0994V,纯度99%)购自北京索莱宝科技有限公司;MTT试剂(批号QR14912)购自美国MP Biomedicals公司;二甲基亚砜(DMSO,批号RNBF2368)、棕榈酸(PA,批号SLBW9894,纯度98.5%)、油酸(OA,批号SLCC4023,纯度99%)均购自美国Sigma公司;DMEM高糖培养基(批号8119081)、南美胎牛血清(批号2176398)、青霉素-链霉素双抗(批号15140122)、胰酶(批号2120649)均购自美国Gibco公司;葡萄糖氧化酶法检测试剂盒(批号20180801137)购自南京建成生物工程研究所;三酰甘油(TG)试剂盒(批号E1003)、胆固醇(TC)试剂盒(批号E1005)均购自北京普利莱基因技术有限公司;BCA蛋白浓度测定试剂盒(批号P0010)购自上海碧云天生物技术有限公司;彩色蛋白Marker(批号00784045)、5×十二烷基硫酸钠-聚丙酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液(批号VG299802)均购自美国Thermo Fisher Scientific公司;TRIzol试剂(批号213506)购自美国Invitrogen公司;Fast Start Universal SYBR Green Master荧光定量试剂盒(批号04913914001)、Transcriptor cDNA Synth. Kit2反转录试剂盒(批号04897030001)均购自瑞士Roche公司;10×RIPA裂解液(批号75)、兔β-肌动蛋白(β-actin)单克隆抗体(批号4970)、兔AMPK单克隆抗体(批号2603)、兔磷酸化AMPK(p-AMPK)单克隆抗体(批号2535)均购自美国CST公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(批号SA00001-2)购自美国Proteintech公司;ECL发光液(批号1939801)购自美国Millipore公司;扩增引物由上海生工生物工程股份有限公司设计、合成;其余试剂均为分析纯,水为超纯水。
1.3 细胞
人源HepG2细胞株购自中国科学院上海生命科学研究院细胞资源中心。
2 方法
2.1 细胞培养
HepG2细胞复苏后,接种于含10%胎牛血清、1%青霉素-链霉素双抗的DMEM高糖培养基(以下简称“完全培养基”)中,置于37 ℃、5%CO2培养箱中培养(以下培养条件相同),待细胞生长密度达80%左右时,用含0.25%乙二胺四乙酸(EDTA)的胰酶消化并传代至新的培养皿中。
2.2 MGF药液和新鲜培养基的配制
精密称取MGF对照品适量,溶于DMSO中,制得浓度为250 mmol/L的MGF母液,分装。临用前,将上述母液用完全培养基稀释至所需浓度。
取PA、OA适量,加水于75 ℃溶解后,趁热与20%无脂肪酸BSA[以pH为7.4的磷酸盐缓冲液(PBS)溶解]混匀并滤过。临用前,用完全培养基稀释成含3%BSA、1 mmol/L PA、2 mmol/L OA的新鲜培养基。
2.3 细胞分组与IR模型建立
取对数生长期的HepG2细胞适量,随机分为正常组、模型组、阳性对照组(盐酸二甲双胍5 mmol/L,剂量设置参考文献[12]并结合本课题组前期研究结果)和MGF高、中、低剂量组(500、250、125 μmol/L,剂量设置参考本课题组前期研究结果),每组设3个复孔。除正常组加入含3%BSA的完全培养基外,其余各组细胞均参照文献[13]加入“2.2”项下新鲜培养基培养24 h以诱导建立IR模型。建模后,正常组、模型组和各药物组分别替换为不含或含相应药物的完全培养基继续培养。
2.4 细胞葡萄糖消耗量检测
取对数生长期的HepG2细胞适量,以3×104个/孔接种于96孔板中,按“2.3”项下方法分组、造模、给药,同时设置不含细胞的空白对照组。各组细胞培养24 h后,取上清液,参照葡萄糖氧化酶法检测试剂盒说明书方法,以多功能酶标仪检测各孔的葡萄糖含量并计算葡萄糖消耗量:葡萄糖消耗量=空白对照组葡萄糖含量-待测组葡萄糖含量。弃去上清液后,各组细胞加入0.5 mg/mL的MTT试剂适量,于室温下反应10 min,使用多功能酶标仪检测各孔的光密度(OD)值,并计算细胞活力:细胞活力=(待测组细胞OD值-空白对照组OD值)/(正常组OD值-空白对照组OD值)。基于上述葡萄糖消耗量和细胞活力计算校正葡萄糖消耗量:校正葡萄糖消耗量=葡萄糖消耗量/细胞活力。实验重复3次。
2.5 细胞中TG、TC含量检测
取对数生长期的HepG2细胞适量,以1.2×105个/孔接种于6孔板中,按“2.3”项下方法分组、造模、给药。各组细胞培养24 h后,弃去上清液,细胞用预冷PBS洗涤2次,加入RIPA裂解液充分混匀,静置10 min。收集各组细胞裂解液,于70 ℃加热10 min,以2 000 r/min离心5 min,取上清液,参照相应检测试剂盒说明书方法,以多功能酶标仪检测各组细胞中TG、TC含量;同时,采用BCA法测定各孔的蛋白浓度,用于校正TG、TC含量。实验重复3次。
2.6 细胞中AMPK信号通路各关键因子mRNA表达检测
采用实时荧光定量PCR法检测AMPK信号通路上游关键因子APN、AdipoR2、APPL1、AMPK以及下游胰岛素信号通路关键因子IRS-1、Akt、GLUT4的mRNA表达情况。取对数生长期的HepG2细胞适量,以1.2×105个/孔接种于6孔板中,按“2.3”项下方法分组、造模、给药。各组细胞培养24 h后,弃去上清液,细胞经TRIzol法提取总RNA并根据Transcriptor cDNA Synth. Kit2试剂盒说明书方法逆转录合成cDNA。以cDNA为模板,参照Fast Start Universal SYBR Green Master试剂盒说明书配制PCR扩增体系,混匀后,使用荧光定量基因扩增仪进行PCR扩增。反应体系(共20 μL)包括:cDNA模板2 μL,2×SYBR Green Ⅰ Master 10 μL,上、下游引物(其引物序列及产物大小见表1)各0.5 μL,ddH2O 7 μL。反应条件为:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火30 s,共40个循环。以β-actin作为内参,采用2-ΔΔCt法以QuantStudio 7 RT-PCR System(Version 1.1)软件计算各目的基因mRNA的相对表达量,结果均以正常组为标准进行归一化处理。实验重复3次。
2.7 细胞中AMPK蛋白磷酸化水平检测
采用Western blot法检测。取对数生长期的HepG2细胞适量,以1.2×105个/孔接种于6孔板中,按“2.3”项下方法分组、造模、给药。各组细胞培养24 h后,弃去上清液,细胞用预冷的RIPA裂解液充分裂解,收集裂解液,于4 ℃下以12 000 r/min离心15 min,取上清液并采用BCA法测定蛋白浓度。根据蛋白浓度测定结果,加入5×SDS PAGE蛋白上样缓冲液适量,于100 ℃煮沸变性10 min。取变性蛋白,进行10%SDS-PAGE分离后,以湿转法转膜,经5%BSA室温封闭1 h;加入p-AMPK、AMPK一抗(稀释比例均为1 ∶ 1 000)和β-actin一抗(稀释比例为1 ∶ 2 000),于4 ℃孵育过夜;用TBST溶液清洗10 min×3次,加入HRP标记的IgG二抗(稀释比例为1 ∶ 1 000),室温孵育1 h;用TBST溶液清洗10 min×3次,经ECL发光液显色后,使用高灵敏度化学发光成像仪曝光成像。采用Image Lab 5.2.1软件对目的条带进行灰度值分析,以p-AMPK与AMPK条带灰度值的比值(即p-AMPK/AMPK比值)表示后者的磷酸化水平,结果均以正常组为标准进行归一化处理。实验重复3次。
2.8 统计学方法
采用SPSS 20.0软件对数据進行统计分析,采用Graph Pad Prism 7.0软件作图。数据均以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验(方差齐)或Dunnetts T3检验(方差不齐)。P<0.05为差异具有统计学意义。
3 结果
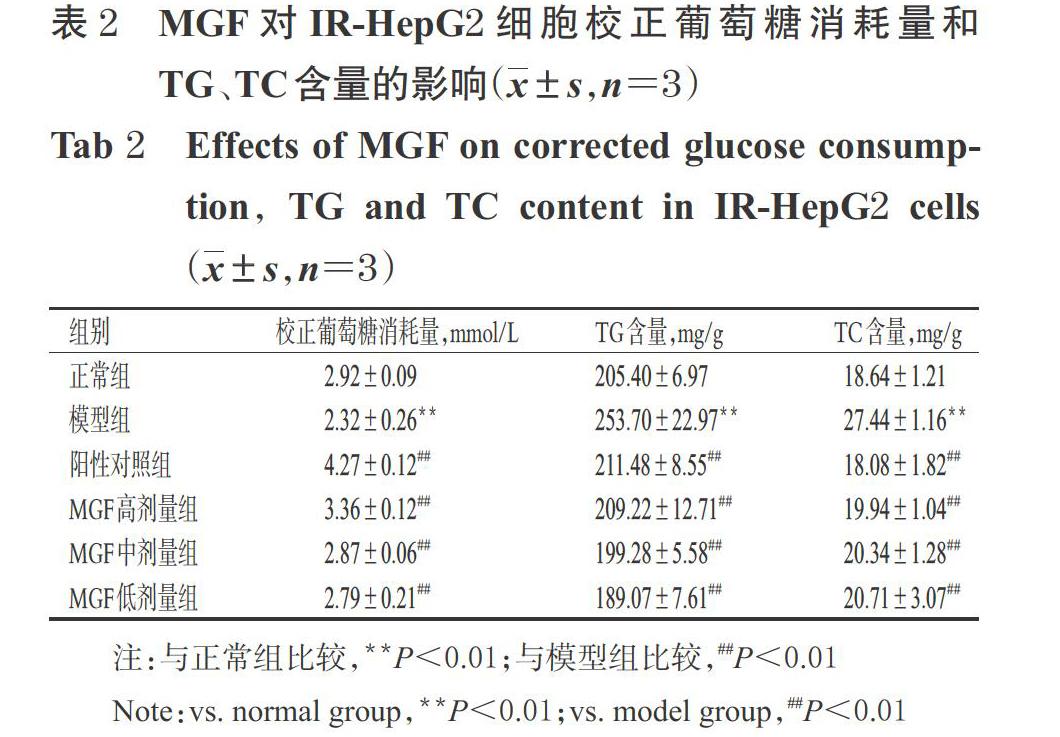
3.1 MGF对IR-HepG2细胞糖代谢的影响
与正常组比较,模型组细胞的校正葡萄糖消耗量显著降低(P<0.01);与模型组比较,各药物组细胞的校正葡萄糖消耗量均显著升高(P<0.01),详见表2。
3.2 MGF对IR-HepG2细胞脂代谢的影响
与正常组比较,模型组细胞内TG、TC含量均显著升高(P<0.01);与模型组比较,各药物组细胞内上述指标含量均显著降低(P<0.01),详见表2。
3.3 MGF对IR-HepG2细胞AMPK信号通路上游关键因子mRNA表达的影响
与正常组比较,模型组细胞APN、AdipoR2、APPL1、AMPK mRNA的相对表达量均显著降低(P<0.05或P<0.01);与模型组比较,阳性对照组和MGF低剂量组细胞APN、AMPK mRNA以及各药物组AdipoR2、 APPL1 mRNA的相对表达量均显著升高(P<0.05或P<0.01),详见表3。
3.4 MGF对IR-HepG2细胞AMPK下游胰岛素信号通路关键因子mRNA表达的影响
与正常组比较,模型组细胞中IRS-1、GLUT4 mRNA的相对表达量均显著降低(P<0.05或P<0.01);与模型组比较,阳性对照组和MGF低剂量组细胞中IRS-1 mRNA,MGF各剂量组Akt mRNA,以及阳性对照组和MGF低、中剂量组GLUT4 mRNA的相对表达量均显著升高(P<0.05或P<0.01),详见表4。
3.5 MGF对IR-HepG2细胞AMPK蛋白磷酸化水平的影响
与正常组比较,模型组细胞AMPK蛋白磷酸化水平显著降低(P<0.01);与模型组比较,各药物组细胞AMPK蛋白磷酸化水平均显著升高(P<0.05或P<0.01),详见图1、表5。
4 讨论
T2DM是一种慢性代谢性疾病,被认为是全世界第五大死亡原因,其主要表现是患者糖脂代谢紊乱[14]。IR是T2DM发生的重要因素,其主要特征是胰岛素作用的靶组织对葡萄糖的摄取和利用减少[2]。肝脏作为胰岛素作用的主要靶组织,是维持糖脂代谢稳定的重要器官[2]。HepG2细胞为人肝癌细胞,由其构建的IR细胞模型是学界公认的可用于研究IR发生机制和降糖药物作用机制的理想模型[15],故本研究参考文献[13]采用1 mmol/L PA+2 mmol/L OA联合培养建立IR细胞模型。
本课题组前期研究表明,以DMSO作为溶剂,MGF最大溶解浓度为250 mmol/L,DMSO体积分数在0.2%(即500 μmol/L)以下对细胞毒性影响小;此外与正常组比较,MGF高、中、低剂量(500、250、125 μmol/L)对HepG2细胞的存活率均无显著影响,且细胞存活率均在90%以上,故本研究选择上述3个浓度进行后续实验。结果显示,MGF高、中、低剂量均可显著提高IR-HepG2细胞的校正葡萄糖消耗量,其中以高剂量作用效果相对最强;同时,其还可显著降低IR-HepG2细胞中TG、TC的含量,提示MGF可调整IR-HepG2细胞的糖脂代谢异常。值得注意的是,经MGF干预后,各剂量组细胞TG含量无明显的剂量依赖趋势,且从具体数据上看,MGF低剂量下调TG含量的效果较明显。有研究指出,APN可降低肝脏组织中TG的含量并上调胰岛素信号的转导,提示TG含量与APN的表达水平有关[16]。经药物干预后,MGF低剂量组细胞内APN mRNA的相对表达量更高,这可能是低剂量组细胞内TG含量更低的原因。
AMPK是一种细胞内能量感受器和调节因子,已被证明与IR、肝脏脂肪病变、糖尿病肾病及糖尿病心肌病的发生密切相关[17-19]。p-AMPK是AMPK的磷酸化形式,p-AMPK/AMPK比值能反映AMPK的活化程度;AMPK磷酸化的增加可有助于AMPK信号通路的激活,从而有利于抗IR作用的发挥[4]。有研究表明,MGF对糖脂代谢紊乱的调节作用与AMPK信号通路有关,但MGF不是该通路的直接激活剂,提示该化合物介导的AMPK激活可能与其上游关键因子有关[18-21]。APN是AMPK信号通路的上游靶点,其水平升高对T2DM、IR具有明显的改善作用[16,22]。研究表明,APN缺乏会导致小鼠脑组织IR、认知功能减退和老年痴呆症样病变[23];另有研究表明,总APN水平与T2DM心血管风险有密切关联[24]。可见,APN可以改善IR、增加机体对胰岛素的敏感性。因此,研究MGF是否通过APN调节AMPK信号通路以改善糖脂代谢紊乱有重要意义。有研究指出,AdipoR2与IR相关的肝功能异常有关[25];此外,初诊T2DM患者血清中APPL1水平异常升高,提示AdipoR2和APPL1均可能参与了T2DM的发生发展[26]。APPL1作为AdipoR2与AMPK之间的关键衔接蛋白,其表达量与APN介导AMPK磷酸化呈正相关[27]。活化的AMPK可激活下游胰岛素信号转导通路,促进糖脂代谢,最终改善IR[7]。IRS-1主要存在于胰岛素敏感组织中,是介导胰岛素及其功能的关键信号蛋白[28]。有研究表明,IRS-1与T2DM患者IR之间存在相关性,该因子异常表达可导致IR的发生,而IR又是T2DM的重要病理机制[29-30]。Akt是葡萄糖代谢中的关键酶,其可被胰岛素激活,介导胰岛素刺激的多种生物学效应[31]。GLUT4作为骨骼肌和脂肪细胞中的主要转运蛋白,是Akt下游调控葡萄糖摄取的重要因子,可在胰岛素的刺激下将葡萄糖转运至胰岛素敏感组织中以促进胰岛素的利用,从而维持血糖的稳定和细胞正常的生理功能[32]。基于此,本研究对上述AMPK信号通路上、下游关键因子mRNA的表达进行了检测。结果显示,采用1 mmol/L PA联合2 mmol/L OA诱导HepG2细胞,可导致IR的发生,并显著下调AMPK信号通路中关键因子APN、AdipoR2、APPL1、IRS-1、GLUT4 mRNA的表达,以及AMPK蛋白的磷酸化水平,而不会显著影响Akt mRNA的表达。经MGF干预24 h后,各药物组细胞中上述关键因子的表达均不同程度地上调,其中APN、APPL1、AMPK、IRS-1、Akt、GLUT4 mRNA的相对表达量以及p-AMPK/AMPK比值均以低或低、中剂量组最优;而MGF各剂量组细胞中AdipoR2 mRNA的相對表达量并无明显的量效关系,且均与阳性对照相当。有研究指出,AMPK为“细胞能量感受器”,细胞的能量状况决定着AMPK的活化程度:APN会促进细胞腺苷三磷酸(ATP)的消耗,使细胞内ATP的含量降低、腺苷一磷酸的含量升高,可使AMPK通路被活化,以参与细胞能量代谢的调节[33]。相比于MGF高剂量组,MGF中、低剂量组细胞的校正葡萄糖消耗量相对较小,即能量摄入相对小,此时可能起到反馈调节作用,使得对应组细胞中APN的表达水平相对较高,提示此时AMPK通路被活化的可能性较高,从而增加了细胞内AMPK及其信号通路关键因子mRNA的表达。
综上所述,MGF可能通过激活通路上游靶点APN,进而调控AMPK信号通路,从而促进IR-HepG2细胞对葡萄糖的摄取,降低细胞内TG、TC含量,发挥改善细胞IR及糖脂代谢异常状态的作用。
参考文献
[ 1 ] ZHENG Y,LEY S H,HU F B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications[J]. Nat Rev Endocrinol,2018,14(2):88-98.
[ 2 ] DAS P,BISWAS S,MUKHERJEE S,et al. Association of oxidative stress and obesity with insulin resistance in type 2 diabetes mellitus[J]. Mymensingh Med J,2016,25(1):148-152.
[ 3 ] DESJARDINS E M,STEINBERG G R. Emerging role of AMPK in brown and beige adipose tissue (BAT):implications for obesity,insulin resistance,and type 2 diabetes[J]. Curr Diab Rep,2018,18(10):80.
[ 4 ] YAN J,WANG C,JIN Y,et al. Catalpol ameliorates hepa- tic insulin resistance in type 2 diabetes through acting on AMPK/NOX4/PI3K/Akt pathway[J]. Pharmacol Res,2018,130:466-480.
[ 5 ] JI R,XU X,XIANG X,et al. Regulation of adiponectin on lipid metabolism in large yellow croaker (Larimichthys crocea)[J]. Biochim Biophys Acta Mol Cell Biol Lipids,2020,1865(5):158711.
[ 6 ] ARIAS E B,CARTEE G D. In vitro simulation of calorie restriction-induced decline in glucose and insulin leads to increased insulin-stimulated glucose transport in rat skeletal muscle[J]. Am J Physiol Endocrinol Metab,2007,293(6):E1782-E1788.
[ 7 ] LIM S M,JEONG J J,CHOI H S,et al. Mangiferin corrects the imbalance of Th17/Treg cells in mice with TNBS-induced colitis[J]. Int Immunopharmacol,2016,34:220-228.
[ 8 ] DU S,LIU H,LEI T,et al. Mangiferin:an effective therapeutic agent against several disorders:review[J]. Mol Med Rep,2018,18(6):4775-4786.
[ 9 ] GIR?N M D,SEVILLANO N,SALTO R,et al. Salacia oblonga extract increases glucose transporter 4-mediated glucose uptake in L6 rat myotubes:role of mangiferin[J]. Clin Nutr,2009,28(5):565-574.
[10] SEKAR V,MANI S,MALARVIZHI R,et al. Antidiabetic effect of mangiferin in combination with oral hypoglycemic agents metformin and gliclazide[J]. Phytomedicine,2019,59:152901.
[11] SALEH S,EL-MARAGHY N,REDA E,et al. Modulation of diabetes and dyslipidemia in diabetic insulin-resistant rats by mangiferin:role of adiponectin and TNF-α[J]. An Acad Bras Cienc,2014,86(4):1935-1948.
[12] ZHU X,YAN H,XIA M,et al. Metformin attenuates triglyceride accumulation in HepG2 cells through decrea- sing stearyl-coenzyme A desaturase 1 expression[J]. Lipids Health Dis,2018,17(1):114.
[13] 金惠杰,邱昆成,李嘉華,等.药对知母-黄柏对胰岛素抵抗的改善作用[J].中国药理学通报,2019,35(7):1020- 1024.
[14] ZHENG T,SHU G,YANG Z,et al. Antidiabetic effect of total saponins from Entada phaseoloides (L.) Merr. in type 2 diabetic rats[J]. J Ethnopharmacol,2012,139(3):814-821.
[15] LI L,LI G,WEI H,et al. The endoplasmic reticulum stress response is associated with insulin resistance-me- diated drug resistance in HepG2 cells[J]. Neoplasma,2015,62(2):180-190.
[16] YADAV A,KATARIA M A,SAINI V,et al. Role of leptin and adiponectin in insulin resistance[J]. Clin Chim Acta,2013,18:80-84.
[17] DASKALOPOULOS E P,DUFEYS C,BERTRAND L,et al. AMPK in cardiac fibrosis and repair:actions beyond metabolic regulation[J]. J Mol Cell Cardiol,2016,91:188-200.
[18] CHELLAPPAN D K,YAP W S,BT AHMAD SUHAIMI N A,et al. Current therapies and targets for type 2 diabetes mellitus[J]. Panminerva Med,2018,60(3):117-131.
[19] DZIUBAK A,W?JCICKA G,WOJTAK A,et al. Metabo- lic effects of metformin in the failing heart[J]. Int J Mol Sci,2018,19(10):2869.
[20] ZHANG Y,LIU X,HAN L,et al. Regulation of lipid and glucose homeostasis by mango tree leaf extract is media- ted by AMPK and PI3K/AKT signaling pathways[J]. Food Chem,2013,141(3):2896-2905.
[21] LI J,LIU M,YU H,et al. Mangiferin improves hepatic li- pid metabolism mainly through its metabolite-norathyriol by modulating SIRT-1/AMPK/SREBP-1c signaling[J]. Front Pharmacol,2018,9:201.
[22] KRAUSE M P,MILNE K J,HAWKE T J. Adiponectin- consideration for its role in skeletal muscle health[J]. Int J Mol Sci,2019,20(7):1528.
[23] NG RC,CHENG OY,JIAN M,et al. Chronic adiponectin deficiency leads to Alzheimers disease-like cognitive impairments and pathologies through AMPK inactivation and cerebral insulin resistance in aged mice[J]. Mol Neurodegener,2016,2016,11(1):71.
[24] LIAN K,GUO X,HUANG Q,et al. Reduction levels and the effects of high-molecular-weight adiponectin via AMPK/eNOS in Chinese type 2 diabetes[J]. Exp Clin Endocrinol Diabetes,2016,124(9):541-547.
[25] L?PEZ-BERMEJO A,BOTAS-CERVERO P,ORTEGA- DELGADO F,et al. Association of ADIPOR2 with liver function tests in type 2 diabetic subjects[J]. Obesity (Silver Spring),2008,16(10):2308-2313.
[26] WANG Y,ZHANG M,YAN L,et al. Serum APPL1 level is elevated in newly diagnosed cases of type 2 diabetes mellitus[J]. Nan Fang Yi Ke Da Xue Xue Bao,2012,32(9):1373-1376.
[27] YANAI H,YOSHIDA H. Beneficial effects of adiponectin on glucose and lipid metabolism and atherosclerotic progressio,2019,20(5):1190.
[28] BOUCHER J,KLEINRIDDERS A,KAHN C R. Insulin receptor signaling in normal and insulin-resistant states[J]. Cold Spring Harb Perspect Biol,2014,6(1):a009191.
[29] TIAN S,JIA W,LU M,et al. Dual-specificity tyrosine phosphorylation-regulated kinase 1A ameliorates insulin resistance in neurons by up-regulating IRS-1 expression[J]. J Biol Chem,2019,294(52):20164-20176.
[30] REHMAN K,AKASH M S H,LIAQAT A,et al. Role of interleukin-6 in development of insulin resistance and type 2 diabetes mellitus[J]. Crit Rev Eukaryot Gene Expr,2017,27(3):229-236.
[31] CAO Y,SUN W. Fuzhu jiangtang granules combined with metformin reduces insulin-resistance in skeletal muscle of diabetic rats via PI3K/Akt signaling[J]. Pharm Biol,2019,57(1):660-668.
[32] KONG D,SONG G,WANG C,et al. Overexpression of mitofusin 2 improves translocation of glucose transporter 4 in skeletal muscle of highfat dietfed rats through AMPactivated protein kinase signaling[J]. Mol Med Rep,2013,8(1):205-210.
[33] 孫维琦,王路红,李环. AMPK细胞能量感受器研究进展[J].北华大学学报(自然科学版),2017,18(2):213- 216.
(收稿日期:2020-11-05 修回日期:2021-02-25)
(编辑:张元媛)
