癸源煎配方颗粒对卵巢储备功能下降模型小鼠的改善作用及机制研究
2021-06-15王月娇孙兆贵徐莲薇郁琳张瑜刘小菲李盛楠丛超赵莉
王月娇 孙兆贵 徐莲薇 郁琳 张瑜 刘小菲 李盛楠 丛超 赵莉

中圖分类号 R271.9;R285.5 文献标志码 A 文章编号 1001-0408(2021)09-1051-06
DOI 10.6039/j.issn.1001-0408.2021.09.05
摘 要 目的:研究癸源煎配方颗粒(GDFG)对卵巢储备功能下降(DOR)模型小鼠的改善作用及机制。方法:将动情周期正常的42只雌性ICR小鼠随机分为对照组、模型组、戊酸雌二醇组(阳性对照,0.15 mg/kg)和GDFG低、中、高剂量组(0.75、1.49、2.98 g/kg),每组7只。除对照组外,其余各组小鼠均腹腔注射顺铂(3 mg/kg)复制DOR模型。造模成功后,给药组小鼠灌胃相应药物,模型组和对照组小鼠灌胃生理盐水,每天1次,连续4周。末次给药后,采用酶联免疫吸附试验测定小鼠血清中抗米勒管激素(AMH)和促卵泡生成素(FSH)水平;采用苏木精-伊红(HE)染色法观察小鼠卵巢组织病理学形态;采用免疫组化法观察小鼠卵巢组织中AMHR受体Ⅱ(AMHRⅡ)、Smad4蛋白的分布情况;采用Western blot法检测小鼠卵巢组织中AMHRⅡ、Smad4蛋白的表达水平。结果:与对照组比较,模型组小鼠血清中AMH水平和卵巢组织中AMHRⅡ、Smad4蛋白表达水平均显著降低(P<0.01),血清中FSH水平显著升高(P<0.01);卵泡组织中可见卵泡皱缩、卵泡核丢失、卵巢间质纤维化、黄体疏松; AMHRⅡ、Smad4蛋白主要分布在卵泡膜上和卵巢间质中。与模型组比较,GDFG各剂量组小鼠血清中AMH水平和卵巢组织中AMHRⅡ、Smad4蛋白表达水平均显著升高(P<0.01),血清中FSH水平均显著降低(P<0.05或P<0.01);卵巢组织中可见各级卵泡、卵泡形态改善,未见明显核丢失和卵丘形成;AMHRⅡ、Smad4蛋白主要分布在卵泡核(GDFG高剂量组除外)及卵巢颗粒细胞膜上(GDFG中剂量组以分布在窦卵泡为主),成熟卵泡核周围或黄体中有少许分布。结论:GDFG可改善DOR模型小鼠的卵巢功能,其机制可能与升高血清中AMH水平和卵巢组织中AMHRⅡ、Smad4蛋白表达水平,改善AMHRⅡ、Smad4蛋白在卵巢颗粒细胞膜和卵泡核内的分布以及降低血清中FSH水平有关。
关键词 卵巢储备功能下降;癸源煎配方颗粒;抗米勒管激素;促卵泡生成素;抗米勒管激素Ⅱ受体;Smad4;小鼠
Study on Improvement Effects and Its Mechanism of Guiyuan Decoction Formula Granules on Model Mice with Decreased Ovarian Reserve
WANG Yuejiao1,2,SUN Zhaogui3,XU Lianwei2,YU Lin3,ZHANG Yu3,LIU Xiaofei1,LI Shengnan2,CONG Chao1,ZHAO Li1(1. Dept. of Gynaecology, Longhua Hospital Affiliated to Shanghai University of TCM, Shanghai 200032, China; 2. Longhua Clinical Medical College, Shanghai University of TCM, Shanghai 200032, China; 3.Shanghai Institute of Planned Parenthood Research, Shanghai 200032, China)
ABSTRACT OBJECTIVE: To study the improvement effects and its mechanism of Guiyuan decoction formula granules (GDFG) on model mice with decreased ovarian reserve (DOR). METHODS: Totally 42 female ICR mice whith with normal estrous cycle were randomly divided into control group, model group, estradiol valerate group (positive control, 0.15 mg/kg) and GDFG low-dose, medium-dose and high-dose groups (0.75, 1.49, 2.98 g/kg), with 7 mice in each group. Except for control group, other groups were given cisplatin (3 mg/kg) intraperitoneally to establish DOR model. After modeling, administration groups were given relevant medicine intragastrically; model group and control group were given normal saline intragastrically, once a day, for consecutive 4 weeks. After last administration, ELISA assay was used to measure the serum levels of anti-Müllerian hormone (AMH) and follicle-stimulating hormone (FSH) in mice. Histopathological morphology of ovarian was observed by HE staining. Protein distribution of AMH receptor Ⅱ(AMHRⅡ) and Smad4 in ovarian tissue were observed by immunohistochemistry. Protein expression of AMHRⅡ and Smad4 were detected by Western blot assay. RESULTS: Compared with control group, the serum level of AMH, the expression of AMHRⅡ and Smad4 protein in ovarian tissue in model group were significantly decreased (P<0.01), while the FSH level in serum was significantly increased (P<0.01); follicles were crumpled and lost nucleus, ovarian interstitial were fibrosis, luteum were loose; AMHRⅡ and Smad4 protein in ovarian tissue were mainly distributed in the follicle membrane and ovarian interstitial. Compared with model group, the serum level of AMH, the expression of AMHRⅡ and Smad4 protein in ovarian tissue was increased significantly in GDFG groups (P<0.01), while the serum level of FSH was decreased significantly (P<0.05 or P<0.01); in ovarian tissue, follicles at all levels could be found and follicle morphology was improved, and no obvious nuclear loss and cumulus formation were found; AMHRⅡ and Smad4 protein were mainly distributed in the follicular nucleus (except for GDFG high-dose group) and the granular cell membrane (mainly distributed in the sinus follicles of GDFG medium-dose group); they were slightly distributed around the mature follicular nucleus or in corpus luteum. CONCLUSIONS: GDFG can improve ovarian function of DOR model mice. The mechanism may be related with promoting serum level of AMH, protein expression of AMHRⅡ and Smad4, improving the distribution of AMHRⅡ and Smad4 protein in ovarian granulosa cell membrane and follicular nucleus, reducing FSH levels.
KEYWORDS Decreased ovarian reserve; Guiyuan decoction formula granules;Anti-Müllerian hormone; Follicle stimulating hormone; Anti-Müllerian hormone receptor; Smad4; Mice
卵巢储备功能下降(DOR),是指卵巢内卵母细胞的数量减少和(或)质量下降,同时伴有抗米勒管激素(AMH)水平降低、窦卵泡数减少、促卵泡生成素(FSH)水平升高、患者生育能力下降[1]。DOR临床表现有月经后期(即月经周期延后7天及以上)、经量减少等,其进一步发展可出现月经频发或月经稀发、闭经,甚至卵巢早衰、生育能力丧失[2]。DOR的病因尚不明确,目前普遍认为其是由多因素所致,如基因损伤、染色体异常、自身免疫损伤、手术损伤、放化疗、感染等;另外,环境变化、生活习惯或嗜好不良,亦可促进DOR的发生发展[3-8]。
目前,西医临床对DOR并无特效治疗方法,一般以调节生活方式、干预心理状态、激素补充等治疗为主[9]。DOR属于中医妇科学“月经后期”“月经过少”等疾病范畴,中医治疗多以滋肾填精、调理冲任、濡养胞宫等为主[10-11]。癸源煎处方是由明代医学大家张介宾的《景岳全书》[12]中“地黄醴”一方加味而成,由熟地黄、枸杞子、肉苁蓉、仙灵脾、菟丝子、鸡血藤、香附等7味药物组成,现已被上海中医药大学附属龙华医院院开发成院内制剂“癸源煎配方颗粒”(以下简写为“GDFG”)。经本课题组前期临床研究发现,该配方颗粒对于DOR患者有较好的改善症状,可保护患者的卵巢功能[13]。目前,本课题组也正在进行GDFG的多中心、大样本的临床随机双盲试验,以期为其上市奠定基础。
相关研究发现,卵巢颗粒细胞异常增殖或凋亡、卵泡发育不良、优势卵泡形成减少,可导致DOR[14-15]。其中,卵泡的发育主要经历募集、选择、成熟等生物过程,其募集与选择过程受AMH、FSH调控:AMH一方面可防止2~8 mm的小窦卵泡过度增长,并降低窦卵泡对FSH的敏感性,从而促进优势卵泡的选择,进而有效防止卵泡池耗竭、调控卵泡生长[16];另一方面,AMH可与AMH受体Ⅱ(AMHRⅡ)结合,然后经过信号传导与公共蛋白Smad4相结合,从而进入细胞核内调控卵巢功能相关基因的表达[17]。然而,GDFG是否可通过AMH/Smad信号通路改善DOR的作用机制尚不明确,基于此,本研究采用腹腔注射顺铂以复制DOR模型小鼠,通过不同剂量GDFG干预后,检测小鼠血清中AMH、FSH的水平,观察其卵巢组织形态和卵泡发育情况,并检测其卵巢组织中AMHRⅡ、Smad4蛋白的分布和表达水平,以探讨GDFG改善卵巢储备功能的机制,以期为中医药防治DOR提供理论依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:MK3型酶标仪(美国Thermo Fisher Scientific公司)、Multizoom AZ100型光学生物显微镜[尼康仪器(上海)有限公司]、GH-200型万分之一电子天平(日本A&D公司)、Centrifuge5804R型高速冷冻离心机(德国Eppendorf公司)、RM2125RTS型石蜡切片机(瑞士Lecia公司)、TissueRuptor Ⅱ型手持式匀浆器(德国Qiagen公司)、Tanno 5200型化学发光凝胶成像仪(上海天能科技有限公司)。
1.2 主要药品与试剂
本研究所用主要药品与试剂有:注射用顺铂(齐鲁制药有限公司,批号FA4A8106A,规格10 mg),GDFG(四川新绿色药业科技发展有限公司),戊酸雌二醇(拜耳医药保健有限公司广州分公司,批号J20171038,规格1 mg),血清AMH、FSH酶联免疫吸附试验(ELISA)试剂盒(上海欲鹏生物科技有限公司,批号分别为LA374189、LF374103),兔源AMHRⅡ单克隆抗体、兔源Smad4單克隆抗体、兔源GAPDH多克隆抗体、ECL化学发光试剂(武汉博士德生物工程有限公司,批号分别为PB1037、PB0446、A00227-1、AR1191),生物素高效标记的山羊抗兔免疫球蛋白G(IgG)多克隆抗体(二抗)、磷酸盐缓冲液(PBS)、山羊血清、RIPA裂解液、BSA溶液、BCA蛋白浓度测定试剂盒、DAB辣根过氧化物酶显色试剂盒(上海碧云天生物技术有限公司,批号分别为A0279、C0221A、C0265、P0013C、ST025、P0012S、P0202),TBST缓冲液(美国Sigma公司,批号91414-10TAB),生理盐水(上海百特医疗用品有限公司,批号H19994067);其余试剂为实验室常用规格,水为纯净水。
1.3 动物
本研究所用动物为SPF级ICR小鼠,雌性,8周龄,体质量为25~30 g,购自上海西普尔-必凯实验动物有限责任公司,实验动物生产许可证号为SCXK(沪)2018-0006。小鼠饲养于上海市计划生育科学研究所清洁级动物实验中心,环境温度为24 ℃、湿度为60%、昼夜光照节律为12 h。饲养期间饲料及饮用水充足,动物可自由饮食、进水。
2 方法
2.1 分组、造模与给药
小鼠适应性喂养5 天后,根据文献[18-19]方法对小鼠进行阴道脱落细胞学检查,筛选出动情周期正常的小鼠共42只,然后随机分为对照组、模型组、戊酸雌二醇组(阳性对照,0.15 mg/kg,剂量根据临床等效剂量换算而得)和GDFG低、中、高剂量组(0.75、1.49、2.98 g/kg,剂量分别为临床等效剂量的0.5、1、2倍),每组7只。除对照组外,其余各组小鼠均腹腔注射顺铂(3 mg/kg,以生理盐水溶解)复制DOR模型。造模期间各组小鼠每天上午9时进行阴道脱落细胞学检查:当其阴道上皮细胞、角化细胞明显减少,白细胞明显增多时,表明造模成功。造模成功后,GDFG各剂量组和戊酸雌二醇组小鼠每日上午9时灌胃相应药液0.3 mL(临用时以生理盐水溶解),对照组和模型组小鼠灌胃等体积生理盐水,连续给药4周。
2.2 小鼠血清中AMH、FSH水平的检测
采用ELISA法进行检测。末次给药后,各组小鼠通过腹腔注射2%戊巴比妥钠(80 mg/kg)麻醉后,于腹主动脉采血。血样于室温静置2 h后,以3 000 r/min离心10 min,取上清液,按试剂盒说明书相关方法操作,采用酶标仪于450 nm波长下测定血清中AMH、FSH的水平。
2.3 小鼠卵巢组织的病理学形态观察
各组小鼠采血后,处死,取其左侧卵巢组织,置于4%多聚甲醛溶液中固定,经70%、80%、90%、95%乙醇和无水乙醇梯度脱水,再以二甲苯透明替换、浸蜡、包埋、切片(厚度约5 μm),平行制备6片。将石蜡切片以二甲苯分次脱蜡,于无水乙醇、90%乙醇、80%乙醇中逐级浸泡,然后以水冲洗。各小鼠取2片切片进行苏木精-伊红(HE)染色(另外4片后续进行免疫组化实验),然后于光学显微镜下观察卵巢组织的病理学形态。
2.4 小鼠卵巢组织中AMHRⅡ、Smad4蛋白的分布情况检测
采用免疫组化法进行检测。取“2.3”项下各小鼠另外4片切片,经脱蜡并复水后,以PBS冲洗5 min×3次,滴加3%H2O2室温静置10 min;以PBS冲洗5 min×3次,置于枸缘酸钠溶液中煮沸10 min以热修复抗原;冷却后以PBS冲洗5 min×3次,滴加山羊血清进行封闭,室温静置20 min;甩去多余液体,滴加AMHRⅡ、Smad4一抗(稀释度均为1 ∶ 500 )50 ?L,室温静置1 h;以PBS冲洗5 min×3次,滴加二抗(稀释度为1 ∶ 2 000)50 ?L,室温静置1 h;以PBS冲洗5 min×3次,经DAB显色10 min后,以PBS冲洗10 min后脱水封片,并于光学显微镜下观察,拍照。当切片中出现明显的棕黄色颗粒则为阳性表达,出现不着色或浅色则为阴性表达。
2.5 小鼠卵巢组织中AMHRⅡ、Smad4蛋白表达水平的检测
采用Western blot法进行检测。取“2.3”项下各组小鼠右侧卵巢组织,剪碎,按照每20 mg组织加入200 μL裂解液的比例加入RIPA裂解液,于匀浆机中研磨,直至裂解液中组织块消失。充分裂解后,以12 000 r/min离心5 min,取上清液,以BCA蛋白浓度测定试剂盒测定蛋白浓度。蛋白经变性后,进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)电泳分离,然后转膜70 min,以5% BSA溶液室温封闭2 h;以TBST洗膜5 min×3次,加入AMHRⅡ、Smad4、GAPDH一抗(稀释度均为1 ∶ 500),孵育过夜;以TBST洗膜5 min×3次,加入二抗(稀释度为1 ∶ 2 000),孵育1 h;以TBST洗膜5 min×3次,经ECL显色后,置于凝胶成像仪中曝光成像。采用Image J 1.8.0软件对蛋白条带的灰度值进行分析,以AMHRⅡ、Smad4与内参GAPDH的灰度值的比值表示相应蛋白表达水平。
2.6 統计学方法
采用SPSS 19.0软件对数据进行统计分析。数据以x±s表示。多组间比较,若数据符合正态分布且方差齐性采用单因素方差分析;若方差不齐,以Kruskal-Wallis H检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 小鼠血清中AMH、FSH水平的测定结果
与对照组比较,模型组小鼠血清中AMH水平显著降低,FSH水平显著升高(P<0.01);与模型组比较,戊酸雌二醇组和GDFG各剂量组小鼠血清中AMH水平均显著升高(P<0.01),FSH水平均显著降低(P<0.05或P<0.01),详见表1。
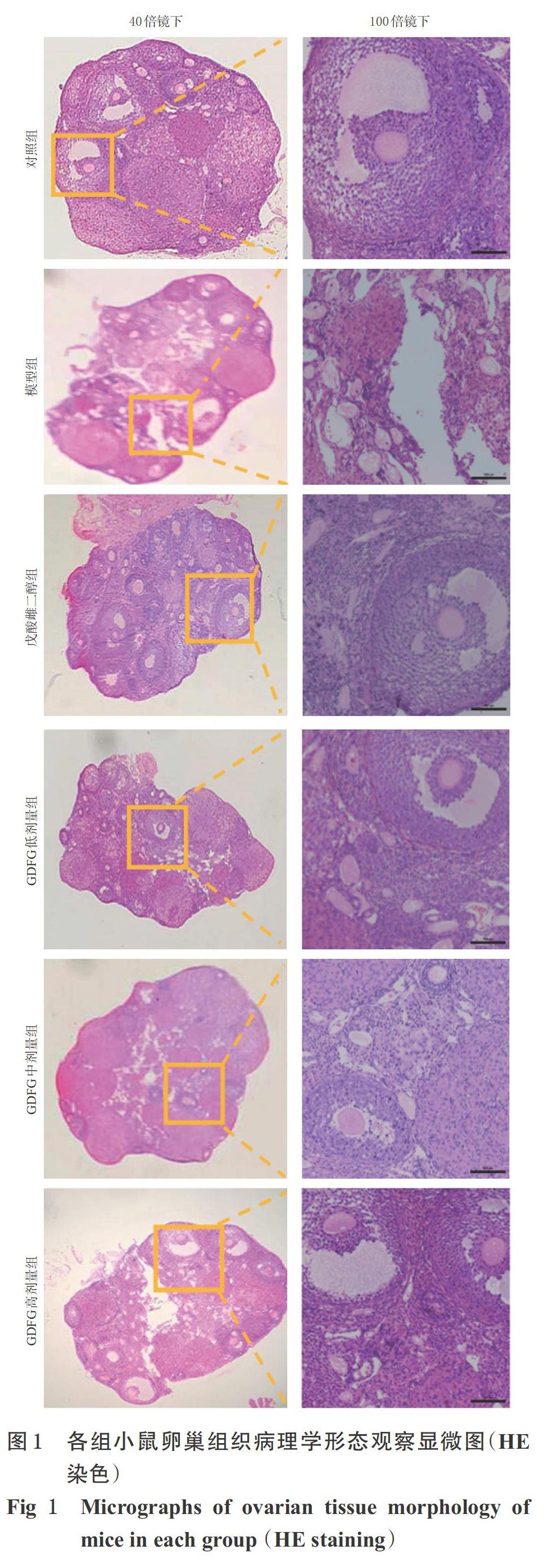
3.2 小鼠卵巢组织病理学形态观察结果
对照组小鼠卵巢组织中可见各级卵泡,窦卵泡、排卵前卵泡形态正常,卵泡液充盈,黄体致密,血管规则;与对照组比较,模型组小鼠卵巢组织中可见卵泡皱缩、卵泡核丢失、卵巢间质纤维化、黄体疏松、卵泡液减少,出现闭锁卵泡;与模型组比较,戊酸雌二醇组和GDFG各剂量组小鼠卵巢组织中可见各级卵泡、卵泡形态改善,未见明显核丢失和卵丘形成,详见图1。
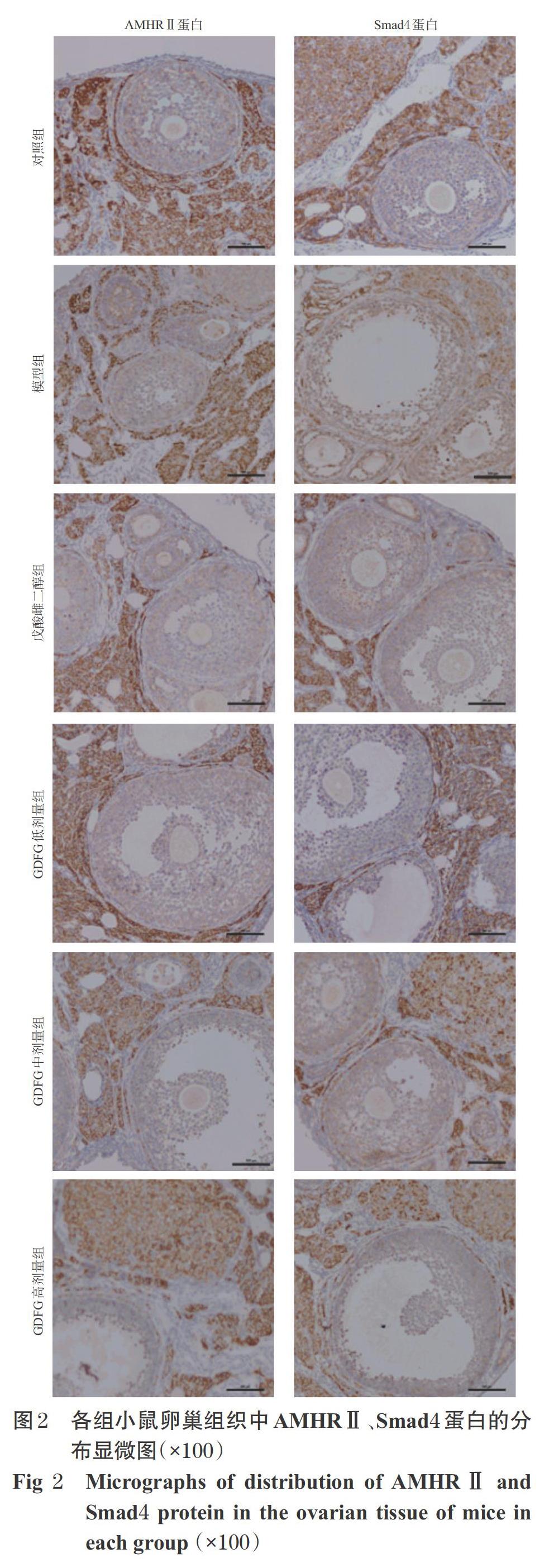
3.3 小鼠卵巢组织中AMHRⅡ、Smad4蛋白的分布情况
对照组小鼠卵巢组织中AMHRⅡ、Smad4蛋白主要分布在卵巢颗粒细胞膜上及卵泡核内,卵泡膜及黄体上亦有分布;模型组小鼠卵巢组织中AMHRⅡ、Smad4蛋白主要分布在卵泡膜及卵巢间质;戊酸雌二醇组和GDFG各剂量组小鼠卵巢组织中AMHRⅡ、Smad4蛋白主要分布在卵泡核(GDFG高剂量组除外)及卵巢颗粒细胞膜上(GDFG中剂量组以分布在窦卵泡为主),成熟卵泡核周围或黄体中有少许分布,详见图2。
3.4 小鼠卵巢组织中AMHRⅡ、Smad4蛋白表达水平检测结果
与对照组比较,模型组小鼠卵巢组织中AMHRⅡ、Smad4蛋白表达水平均显著降低(P<0.01);与模型组比较,戊酸雌二醇组和GDFG各剂量组小鼠卵巢组织中AMHRⅡ、Smad4蛋白表达水平均显著升高(P<0.01),详见图3、表2。
4 讨论
AMH是反映女性卵巢储备功能、评估女性生殖能力的重要指标:AMH由巢内窦前卵泡和小窦卵泡的卵巢颗粒细胞分泌,通过其自分泌及旁分泌作用,抑制原始卵泡募集、减少窦前卵泡和小窦卵泡对FSH的依赖性生长,促进优势卵泡选择,对于卵泡发育成熟有重要的调节作用;AMH分泌减少可导致原始卵泡的募集增加、小窦卵泡对FSH的敏感性增强、卵泡过度生长,加速卵泡储备池耗竭[16]。AMH主要有AMHRⅠ、AMHRⅡ两类受体,AMHRⅡ主要分布在卵巢颗粒细胞膜上,可与AMH直接结合,通过骨形态发生蛋白样激酶磷酸化后与AMHRⅠ形成异聚体复合物,再通过与Smad1/5/8受体蛋白结合并激活公共受体Smad4,从而发挥调控发育的作用[21-22]。但是,当AMHRⅡ蛋白分布于成熟卵泡和间质上时,与AMH结合后,将不能与Smad4结合,从而不发挥调控发育的作用[23-24]。
GDFG是我院妇科用于治疗DOR的常用制剂,经临床研究也发现其可调节患者月经周期、恢复生殖轴、改善卵巢功能,但其作用机制尚不明确[13]。基于此,本研究建立了DOR小鼠模型,以探讨GDFG改善DOR的潜在作用机制。
顺铂为铂类化合物,是临床常用的广谱抗肿瘤药物,具有生殖毒性[18-19],故本研究通过对8周龄ICR小鼠一次性腹腔注射顺铂以复制DOR模型,造模成功后,以临床常用雌激素戊酸雌二醇为阳性对照,进行干预。结果发现,模型组小鼠血清中AMH水平显著降低,FSH水平显著升高;卵巢组织出现闭锁卵泡,卵泡形态皱缩、核丢失、卵泡液减少,且AMHRⅡ、Smad4蛋白主要分布在卵泡核及卵巢间质,其蛋白表达水平显著降低。经药物连续干预4周后发现,GDFG各剂量组小鼠血清中AMH水平均显著升高,FSH水平均显著降低;卵巢组织中卵泡形态改善、未见明显核丢失和卵丘形成,且AMHRⅡ、Smad4蛋白表达水平均显著升高。GDFG各剂量组小鼠卵巢组织中AMHRⅡ、Smad4蛋白主要分布在卵泡核(GDFG高剂量组除外)及卵巢颗粒细胞膜上(GDFG中剂量组以分布在窦卵泡为主),成熟卵泡核周围或黄体中有少许分布。由此说明,GDFG可通过改善AMHRⅡ、Smad4蛋白在卵巢颗粒细胞膜及卵泡核内的分布,减弱AMHRⅡ、Smad4蛋白分布于卵巢间质的倾向,从而促进AMH/Smads信号通路的传导,进而降低血清中FSH水平。
综上所述,GDFG可改善DOR模型小鼠的卵巢功能,其机制可能与升高血清中AMH水平和卵巢组织中AMHRⅡ、Smad4表达水平,改善AMHRⅡ、Smad4蛋白在卵巢颗粒细胞膜及卵泡核内的分布,降低血清中FSH水平有关。后续本课题组将研究GDFG干预小鼠卵巢颗粒细胞AMH/Smads 信号通路的具体环节和靶点,以期观察该制剂对卵巢颗粒细胞增殖的影响,进一步阐释GDFG调节卵泡募集、保护卵巢储备功能的作用机制。
参考文献
[ 1 ] 陈子江,田秦杰,乔杰,等.早发性卵巢功能不全的临床诊疗中国专家共识[J].中华妇产科杂志,2017,52(9):577- 581.
[ 2 ] GUSTIN S L F,DING V Y,DESAI M,et al. Evidence of an age-related correlation of ovarian reserve and FMR1 repeat number among women with “normal” CGG repeat status[J]. J Assist Reprod Genet,2015,32(11):1669- 1676.
[ 3 ] NOTO V,HARRITY C,WALSH D,et al. The impact of FMR1,gene mutations on human reproduction and deve- lopment:a systematic review[J]. J Assist Reprod Genet,2016,33(9):1135-1147.
[ 4 ] ASGARI Z,ROUHOLAMIN S,HOSSEINI R,et al. Comparing ovarian reserve after laparoscopic excision of endometriotic cysts and hemostasis achieved either by bipolar coagulation or suturing:a randomized clinical trial[J]. Arch Gynecol Obstet,2016,293(5):1015-1022.
[ 5 ] SAITO A,IWASE A,NAKAMURA T,et al. Involvement of mesosalpinx in endometrioma is a possible risk factor for decrease of ovarian reserve after cystectomy:a retrospective cohort study[J]. Reprod Biol Endocrinol,2016,14(1):72.
[ 6 ] 丁巖,华克勤.环境因素对卵巢储备功能的影响[J].现代妇产科进展,2015,24(8):636-639.
[ 7 ] 杨萍,张丹,陈丽.不良环境因素对卵巢功能早衰的影响[J]. 中华妇幼临床医学杂志(电子版),2015,11(2):43-45.
[ 8 ] 袁翀英.影响卵巢早衰及卵巢储备功能下降的临床相关因素[J].中外女性健康研究,2016,55(8):209.
[ 9 ] 蒋忠新,李文.早发性卵巢功能不全的生殖治疗现状与展望[J].发育医学电子杂志,2020,8(2):99-105.
[10] 刘小月,黄海涛,卜晓玲,等.基于“治未病”思想分析卵巢储备功能下降的防治[J].世界中西医结合杂志,2020,15(8):1431-1434.
[11] 李锦英,张兆萍,叶金飞,等.基于网络药理学的菟丝子-枸杞子药对治疗卵巢早衰的作用机制研究[J].中国药房,2020,31(18):2202-2209.
[12] 韩虹宇.癸源煎干预卵巢储备功能下降的临床研究[D]. 上海:上海中医药大学,2016.
[13] 张介宾.景岳全书[M].北京:人民卫生出版社,2007:1200.
[14] 杨阳,陶仕英,赵丕文,等.卵巢早衰颗粒细胞凋亡调控机制的研究进展[J].医学研究杂志,2018,47(1):16-20.
[15] 张晓静,黄荷凤.卵巢颗粒细胞中卵泡刺激素的受体后信号传导通路[J].中华妇产科杂志,2009,44(4):309-312.
[16] 胡琳莉,朱桂金.抗苗勒激素(AMH)在卵巢中的作用[J].中国优生与遗传杂志,2006,14(3):9-10.
[17] 陈亚楠,李瑞梅,陈晓丽,等.长链非编码RNA与卵泡发育相关性的研究进展[J].生殖医学杂志,2020,29(12):1677-1681.
[18] 艾浩,薛晓鸥,牛建昭,等.顺铂腹腔注射对小鼠卵巢功能损伤机制的研究[J]. 中国妇产科临床杂志,2008,9(4):282-284.
[19] 周宇,贾玉玲,严大为,等.两种小鼠卵巢早衰模型的比较[J].上海医学,2018,41(8):489-495.
[20] 闫艺之,王颖.影响生长卵泡发育的相关因素[J].中华生殖与避孕杂志,2020,40(1):69-77.
[21] DEWAILLY D,ANDERSEN C Y,BALEN A,et al. The physiology and clinical utility of anti-Müllerian hormone in women[J]. Hum Reprod Update,2014,20(3):370-385.
[22] POOLE D H,OC?N-GROVE O M,JOHNSON A L. Anti-Müllerian hormone (AMH) receptor type Ⅱ expression and AMH activity in bovine granulosa cells[J]. The- riogenology,2016,86(5):1353-1360.
[23] 李赞. AMH对小鼠卵母细胞体外成熟及卵丘扩展的调控作用研究[D].武汉:华中农业大学,2018.
[24] 盖玉强,杜宝霞,马龙,等.不同发情时期Smad4基因在绵羊卵巢中表达规律的研究[J].吉林畜牧兽医,2020,41(10):1-2、4.
(收稿日期:2020-12-21 修回日期:2021-03-11)
(编辑:唐晓莲)
