高病毒载量HBsAg阳性孕妇HBV母婴传播的多因素分析
2021-06-15朱博吕小静田红霞赵玉婵李健霞孙丽娟许剑萍赵志英陈秀丽李素文冯福民戴二黑
朱博 吕小静 田红霞 赵玉婵 李健霞 孙丽娟 许剑萍 赵志英 陈秀丽 李素文 冯福民 戴二黑
世界卫生组织估计,全世界有2.57亿人感染乙型肝炎病毒(HBV),超过9 400万慢性乙型肝炎(CHB)患者[1]。如果不及时治疗,HBV感染慢性化会发展为肝硬化和肝细胞癌[2]。2015年全世界有887 000人死于慢性乙型肝炎病毒感染相关疾病[3],可见HBV感染仍然是世界范围内的主要公共卫生问题。目前尚无彻底消除HBV的特异性治疗方法,仅能抑制病毒复制,减缓肝硬化的进展,降低肝癌的发生率并改善患者生存质量。因此,有效控制乙肝的措施就是从源头预防。有研究显示,感染HBV的年龄越小其发展为慢性化的比例就越高[4],而中国育龄期妇女HBsAg阳性率达5.3%[5],由此可见阻断HBV母婴传播是乙肝防控的关键。虽现阶段的主动被动联合免疫可有效的阻断90%~95%的母婴传播,但是仍有高达5%~10%的感染率[6,7]。大量研究结果证实,采用替诺福韦(TDF)或替比夫定(TBV)对HBV感染孕妇进行抗病毒治疗可提高HBV母婴阻断成功率,但是仍有感染发生[8,9],本研究回顾性分析石家庄市两所医院中接受抗病毒治疗与未接受治疗的高病毒载量乙肝孕妇发生HBV母婴传播的危险因素并探究控制传播的策略,旨在为进一步优化乙肝母婴阻断方案提供科学依据,提高阻断成功率。
1 资料与方法
1.1 一般资料 采用回顾性研究的方法,收集来自石家庄市第五医院和石家庄市妇幼保健院HBsAg阳性孕妇及所分娩婴儿的病历资料。研究已通过医院伦理委员会审批。
1.2 入选与排除标准
1.2.1 入选标准:①年龄:20~40岁;②妊娠20~30周;③血清HBsAg阳性至少6个月;④HBV DNA≥2×105U/ml且HBeAg阳性;⑤丙氨酸氨基转移酶(ALT)小于最高上限(ULN:40 U/L)的10倍;⑥妊娠20周前至少有两次产科超声检查结果;⑦孕妇均是单胎妊娠;⑧所有婴儿在出生后12 h内接受HBIG和乙肝疫苗进行联合免疫预防,并在1、6个月时接种第二剂和第三剂乙肝疫苗。
1.2.2 排除标准:①配偶血清HBsAg阳性;②合并其他病毒感染:如HAV、HCV、HDV、HIV、CMV和EBV等;③曾接受过干扰素或核苷类似物治疗;④肝硬化、肝癌、肝功能衰竭患者;⑤具有先兆流产的临床体征;⑥检查发现有胎儿畸形的证据。
1.3 方法 通过医院信息系统和实验室信息管理数据系统对医院产科数据进行回顾性整理,收集孕妇一般人口学信息、基线信息、分娩时信息,新生儿分娩时的资料以及分娩后7~12个月的HBV感染情况,根据入选和排除标准筛选入组。新生儿HBV感染的定义为出生时HBsAg或HBV DNA阳性,HBV母婴传播定义为婴儿出生后6~12个月HBsAg或HBV DNA阳性。所有数据双录入,对录入结果进行核对、整理分析。
1.4 资料分析 分析接受抗病毒治疗的孕妇和对照组孕妇的一般特征,以婴儿6~12个月血清HBsAg阳性或HBV DNA阳性为因变量,母亲年龄、家族史、不良孕育史、既往妊娠次数、HBeAg阳性情况、基线HBV DNA水平、ALT水平、分娩时HBV DNA水平、用药与否、以及新生儿胎龄、性别、分娩方式、Apar评分、新生儿体重、羊水染色与否为自变量进行单因素分析。以单因素分析中有统计学差异的变量作为自变量,并赋值,母婴传播的发生作为因变量进行多因素logistic回归分析,分析发生乙肝母婴传播的危险因素及该危险因素的影响指标。

2 结果
2.1 3组孕妇和婴儿的一般特征比较 共纳入545例HBsAg阳性的孕妇,孕中期(妊娠20~27周)或孕晚期(妊娠28~32周)开始每日口服300 mg TDF直至分娩的孕妇纳入TDF组(n=174),孕中期或孕晚期开始每日口服600 mg TBV直至分娩的孕妇被纳入TBV组(n=331),不接受任何治疗的孕妇纳入对照组(n=40)。3组孕妇家族史差异有统计学意义(P<0.05),对照组显著高于TDF组和TBV组(P=0.002),但TDF组与TBV组孕妇家族史差异无统计学意义(P=0.210)。TDF组和TBV组基线HBVDNA水平均高于对照组,差异有统计学意义(P<0.001);TDF组和TBV组分娩时HBVDNA水平显著低于对照组(P<0.001),而TDF组与TBV组间差异无统计学意义(P>0.05)。3组孕妇和新生儿不良反应发生率之间差异均无统计学意义(P>0.05),新生儿无畸形发生。见表1。
2.2 3组HBV母婴传播率比较 新生儿HBV感染在TDF组、TBV组和对照组均有发生,3组发生率比较,差异无统计学意义(P=0.413)。TDF组和TBV组母婴传播率均显著低于对照组(P<0.05)。见表1。

表1 3组孕妇和婴儿的一般特征分析
2.3 HBV母婴传播影响因素的单因素分析 母亲孕期是否抗病毒治疗在发生母婴传播的婴儿和未发生母婴传播的婴儿中差异有统计学意义(P=0.015),同时2组分娩时HBV DNA水平差异有统计学意义(P=0.013),两因素是影响HBV母婴传播的危险因素(P>0.05)。见表2。
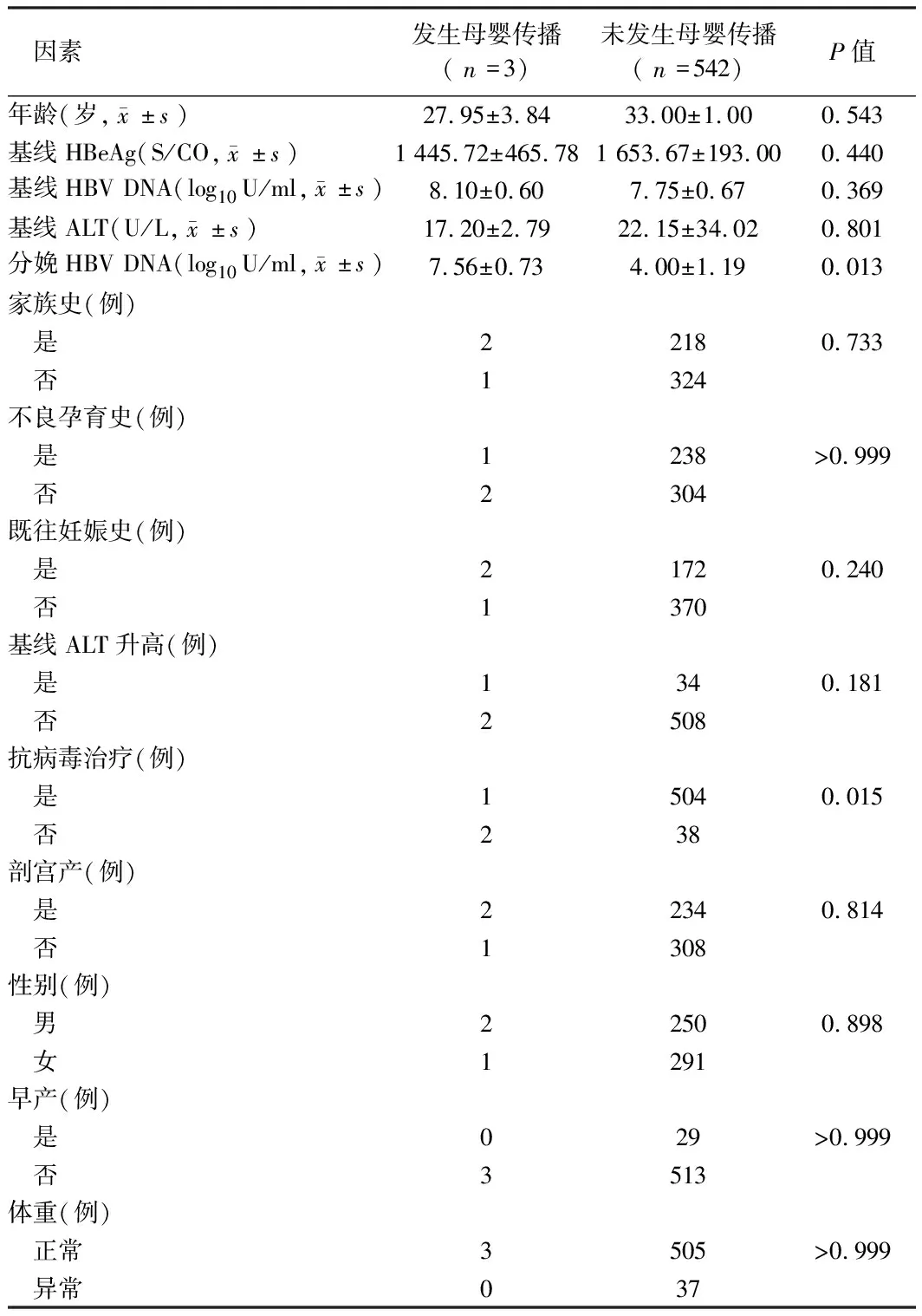
表2 HBV母婴传播影响因素的单因素分析
2.4 HBV母婴传播影响因素的多因素logistic分析 将单因素分析中差异有统计学意义的因素纳入进行多因素logistic回归分析,结果显示仅分娩时HBV DNA水平(OR:2.449,95%CI:1.282~4.677)是发生HBV母婴传播的危险因素。见表3。

表3 HBV母婴传播影响因素的多因素logistic分析
2.5 产妇分娩时HBV DNA水平影响因素的多因素线性回归分析 以产妇分娩时的HBV DNA水平为因变量,产妇年龄、不良孕育史、家族史、妊娠次数、HBeAg水平、基线HBV DNA水平、基线ALT水平、是否抗病毒治疗和治疗时间为自变量进行多因素线性回归分析,结果显示基线HBV DNA水平(B=0.232,P<0.001)、是否抗病毒治疗(B=-1.917,P<0.001)、治疗时间(B=-0.004,P<0.001)可影响分娩时HBV DNA水平。见表4。

表4 产妇分娩时HBV DNA水平的影响因素
2.6 不同孕期接受抗病毒治疗的效果比较 在TDF组和TBV组中,孕中期和孕晚期开始抗病毒治疗孕妇的基线HBV DNA、HBeAg以及ALT水平差异均无统计学意义(P>0.05)。分娩时,TDF组和TBV组HBeAg阴转率和ALT水平差异无统计学意义,TBV组孕中期和孕晚期分娩时HBV DNA水平差异无统计学意义,而在TDF组,孕中期开始抗病毒治疗的孕妇分娩时HBV DNA水平明显低于孕晚期(P=0.002)。见表5。

表5 TDF组和TBV组不同孕期接受抗病毒治疗孕妇特征
3 讨论
多年来,我国政府和医疗卫生部门积极地采取各种措施防控乙肝,自2005年起,中国全部新生儿乙型肝炎疫苗和接种服务不再收取任何费用,以及后续原卫生部颁布的《2006~2010年全国乙肝防治规划》《“健康中国2030”规划纲要》等文件的落实,使我国从乙肝高度流行地区转变为中度流行地区[10-12]。但是,2019年我国传染病新发病例中,乙型肝炎新发病人数仍占全部传染病发病总人数的9.78%[13],研究证实,这主要是由于HBV的母婴传播[14]。
在该研究中,TDF组和TBV组患者从孕中期或孕晚期开始抗病毒治疗,而对照组不接受任何治疗。TDF组、TBV组和对照组新生儿感染乙肝的比例分别是8.05%(14/174))、5.14%(17/331)和7.50%(3/40),差异无统计学意义(P=0.149)。而对婴儿出生后7~12个月时随访结果显示,TDF组、TBV组和对照组的母婴传播率分别为0.00%(0/174)、0.30%(1/331)和5.00%(2/40),抗病毒治疗组的母婴传播率明显低于对照组(P=0.015),但TDF组和TBV组间差异无统计学意义(P>0.05)。3组间孕妇和新生儿均无严重不良反应发生。TBV属合成胸腺嘧啶核苷类似物,直接特异性抑制HBV DNA的聚合酶。TDF是一种有效的核苷酸类似物逆转录酶抑制剂。在诸多研究中已证实,不论是TDF还是TBV,在阻断高病毒载量乙肝孕妇HBV母婴传播方面都表现出良好的疗效[15-17],但是也有研究证实长期使用TBV会产生一定的耐药性而TDF具有较高的耐药屏障,几乎不产生耐药。Wu等[18]在研究中纳入450名HBV DNA≥106IU/ml的HBeAg阳性孕妇,279名在妊娠24~32周内接受替比夫定治疗,其他作为对照,新生儿均接受标准免疫接种,所有试验组的6月龄婴儿均未检测出HBsAg阳性,而对照组阳性率为14.7%,2组中婴儿均未发生严重的不良事件。在另一项多中心、开放标签、随机、平行分组的中国试验结果显示[19],TDF组可显著降低婴儿出生7个月时HBsAg阳性率,TDF组中婴儿HBsAg阳性率为5.2%(5/97),而对照组为18%(18/100)(P=0.007),且TDF表现出良好的安全性。本研究结果与上述研究结果一致,证实高病毒载量孕妇接受TBV或TDF进行抗病毒治疗是安全有效的。
本文对HBV母婴传播影响因素的单因素分析中发现分娩时HBV DNA水平高,以及孕期未接受抗病毒治疗是婴儿发生感染的危险因素,进而对婴儿发生HBV母婴传播的原因进行多因素logistic回归分析,发现母亲分娩时HBV DNA水平是导致乙肝母婴阻断失败的危险因素。本研究中,对照组的基线HBV DNA水平低于TDF和TBV组,但是其分娩时HBV DNA水平高于其他两组,这也进一步证实分娩时高水平HBV DNA是导致母婴传播的重要危险因素。一些研究表明,HBV母婴传播的发生与妊娠28周时的HBV DNA水平无关,而与分娩前的水平有关[20]。Zou等[21]的研究表明,当母亲分娩时血清HBV DNA水平低于106copies/ml时,阻断成功率几乎为100%,而HBV DNA水平高于106copies/ml的母亲可能会发生失败,并且随着病毒载量的增加,失败率也会增加。因此,如何降低高病毒载量孕妇分娩时HBV DNA水平或是成功阻断HBV母婴传播的关键。
进一步分析影响孕妇分娩时HBV DNA水平的因素,以求通过控制分娩时HBV DNA水平提高母婴阻断成功率。在对影响分娩时HBV DNA水平的多因素线性回归分析中发现,基线HBV DNA水平、孕期是否抗病毒治疗以及抗病毒治疗时间早晚是其影响因素。孕妇基线时HBV DNA水平越高,分娩时HBV DNA水平越高(B=0.232,P<0.001),接受抗病毒治疗可降低分娩时HBV DNA水平(B=-1.917,P<0.001),开始抗病毒治疗时间越早,分娩时HBV DNA水平越低(B=-0.004,P<0.001)。基于此发现,我们以开始抗病毒治疗的不同孕期为分层因素,分别分析TDF组与TBV组孕妇分娩时病毒载量状况,发现与孕晚期比较,孕中期服用TDF可以更显著降低孕妇分娩时HBV DNA水平(P<0.001),而在TBV组,孕中期和孕晚期组差异无统计学意义(P>0.05)。目前,在抗病毒治疗开始时间的选择上尚存在一定的争议,卢小娟等[22]研究认为相比妊娠晚期服用替诺福韦抗病毒治疗,在妊娠早、中期用药更能显著降低孕妇HBV DNA水平,提高母婴传播阻断成功率。冉冉等[23]研究同样认为不同孕周服用TDF预防HBV母婴传播的有效性一致,但是较早孕周开始抗病毒治疗,HBV DNA水平下降更明显。然而,也有研究者认为,妊娠24~27周并未进入围产期,过早抗病毒治疗可能增加不良事件,如服药孕周时间长可能更易导致患者产后肝功能异常的发生等[24]。此外,各国乙肝防治指南推荐孕期接受抗病毒治疗的时间也各不相同,美国肝病研究协会(AASLD)和亚太肝病研究协会(APASL)建议应该在妊娠28~32周进行抗病毒治疗[25,26]。欧洲肝脏研究协会(EASL)和我国《慢性乙型肝炎防治指南(2019年版)》则推荐在妊娠24~28周时开始治疗[27,28]。因此,非常有必要对高病毒载量孕妇抗病毒治疗的时间进行严格的大样本前瞻随机对照研究。
高病毒载量孕妇分娩时HBV DNA水平是导致母婴传播的重要危险因素,孕中期或孕晚期接受TBV或TDF均可有效降低孕妇分娩时HBV DNA水平,进而降低HBV的母婴传播率。鉴于TBV和TDF的安全性都很高,孕中期接受TDF进行抗病毒治疗降低分娩时HBV DNA水平的效果更佳且能有效阻断HBV母婴传播,故我们强烈推荐高病毒载量乙肝孕妇在孕中期开始接受TDF治疗进一步提高乙肝母婴阻断成功率。
