小剂量甲氨蝶呤上市后与其相关的肝病不良事件信号检测与分析*
2021-06-15王华玲胡巧织徐珽
王华玲,胡巧织,徐珽
(1.四川大学华西医院药剂科,成都 610041;2.四川大学华西药学院,成都 610041)
近年来,医学数据监测数据库越来越完善,基于此类数据库进行数据挖掘可以较早发现药物不良事件(adverse drug event,ADE)和药物之间关系,为上市药物的安全性研究提供有力的证据[1]。其中,美国食品药品管理局(FDA)不良事件报告系统(FDA adverse event reporting system,FAERS)是最大的不良事件自发呈报资源库,其可量化药物与所报不良事件的关系[2]。甲氨蝶呤可阻止二氢叶酸还原为四氢叶酸,最初于1940年以抗癌药应用于临床[3],后因其抗炎和免疫调节作用被广泛用作改善病情的抗风湿药物(disease-modifying anti-rheumatic drugs,DMARDs)[4]。甲氨蝶呤具有良好的有效性和安全性,现如今仍被用作风湿病[5]、银屑病[6]、银屑病性关节炎[7]、系统性红斑狼疮[8]的一线或者二线治疗药物。作为DMARDs,甲氨蝶呤每周用量通常少于30 mg[9],但仍有近30%患者因不能耐受其产生的药品不良反应(adverse drug reaction,ADR)而不能继续用药,其中最主要的ADR是肝脏毒性[10- 11]。虽然甲氨蝶呤已上市很久,但关于其造成的肝脏毒性的安全性研究资料很少。因此,笔者在本研究基于FAERS,通过数据挖掘的方法检测与药物相关肝病的信号,为小剂量甲氨蝶呤的临床应用提供参考。
1 资料与方法
1.1数据来源 本研究以甲氨蝶呤的通用名(METHOTREXATE)和商品名(NOVATREX,OTREXUP,RASUVO,TREXALL,Rheumatrex,MAXTREX)为检索词,检索FAERS中2018年第一季度至2019年第四季度共8个季度的数据。将收集数据导入Access数据库中,删除重复报道的数据,筛选得到用药名称为methotrexate、 novatrex、 otrexup、 rasuvo、trexall、Rheumatrex、 MAXTREX,每周用药剂量≤30 mg、给药途径为Oral、Intravenous、Intramuscular、Subcutaneous,且在ADR中为首要怀疑药物的报告,共25 269例。
1.2数据处理
1.2.1数据挖掘方法 目前,国内外主要采用的ADR信号检测方法为比例失衡法[1,12],其基本原理是在一个包含所有报告的数据库中,当某特定药物事件组合明显高于整个数据库的背景频率,并且达到一定的标准,就认为产生一个信号[13]。本研究采用的信号检测方法为报告比值比(reporting odds ratio,ROR)法,它属于比例失衡法中一种检测方法,其早期发现信号的能力好且结果偏倚小。采用该方法进行信号挖掘时的计算方法基于四格表,见表1。当a≥3,ROR95%CI下限>1,则表明产生一个可疑信号,提示目标药物与目标不良事件之间存在统计学关联[14]。
表1 比例失衡四格表
1.2.2定义各种与药物相关的肝病ADR 《监管活动医学词典》(MedDRA)术语集适用于除动物毒理外针对人类使用的所有药品开发阶段,由系统器官分类(SOC)、高位组语(HLGT)、高位语(HLT)、首选语(PT)、低位语(LLT)等5个层级构成,PT为基本单元。标准MedDRA分析查询(Standardized MedDRA Queries,SMQ)是若干组MedDRA术语,通常在PT级,旨在协助识别和检索可能相关的安全报告案例。本研究使用的是更新于2019年9月的22.1版MedDRA,其包含225个具体SMQ,“各种与药物相关的肝病——全面搜索”的SMQ包含315个PT,分别为与肝相关的凝血和出血障碍45个、各种与药物相关的肝病——仅严重事件157个、涉及肝脏的各类检查、体征和症状103个、源于肝部的胆汁淤积和黄疸类病症17个,其中有7个重复PT。
1.3信号分析方法 筛选出小剂量甲氨蝶呤发生ADR报告并提取用药信息,含年龄、性别、给药途径。采用SPSS25.0版软件对分类计数资料进行χ2检验,根据P值判断各因素是否显著影响与药物相关的肝病ADR发生情况,以P<0.05表示差异有统计学意义。
2 结果
2.1信号检测结果 筛选后得到总的药物ADR报告10 755 628份,以小剂量甲氨蝶呤为首要怀疑药物的ADR报告44 947份,使用ROR法共检测出各种与药物相关的肝病信号31个,具体包含肝衰竭、纤维化和肝硬化以及其他涉及肝损伤病症11个、涉及肝脏的各类检查、体征和症状12个、源于肝部的胆汁淤积和黄疸类病症1个、非感染性肝炎2个、肝衰竭、肝纤维化和肝硬化以及其他涉及肝损伤的病症1个、良性肝部肿瘤(包括囊状和息肉状)2个、与肝相关的凝血和出血障碍2个。说明书中未包含天冬氨酸氨基转移酶增加、肝良性肿瘤、慢性肝炎、凝血因子V浓度异常等14个信号,见表2。
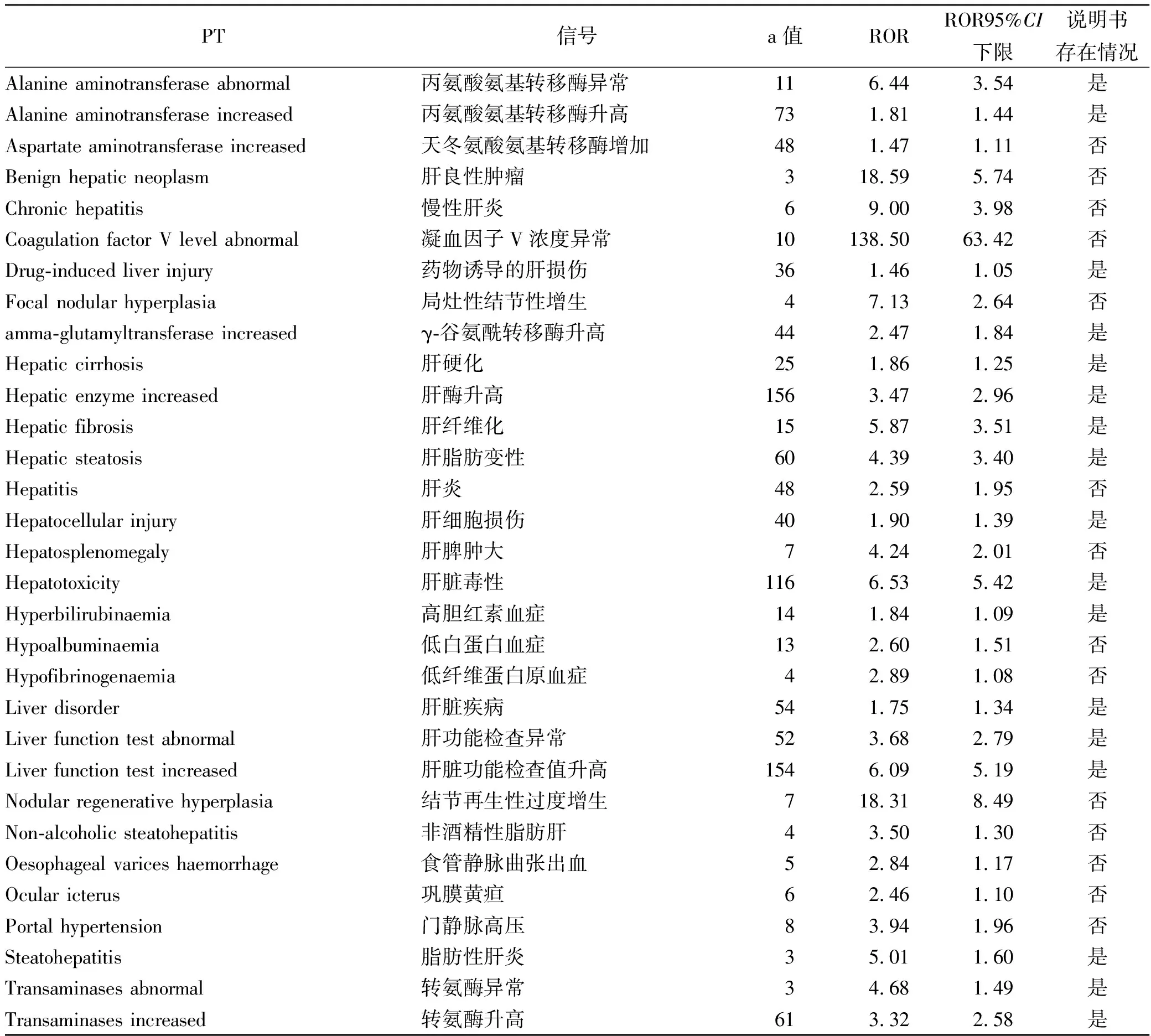
表2 小剂量甲氨蝶呤相关的肝病信号信息
2.2信号分析结果
2.2.1目标信号资料分析 小剂量甲氨蝶呤肝病ADE信号对应报告患者1090例,其中493例用药信息完整。对这493例报告整理可知,女性的构成比(345例,70.0%)高于男性(148例,30.0%);45~74岁年龄组报告(351例,71.2%)高于其他各组之和;口服给药组报告(326例,66.1%)多于其他组,未有静脉给药发生肝病ADE的报告,可能与这种给药方式在甲氨蝶呤中较少使用有关。
2.2.2各影响因素与目标信号的关系 小剂量甲氨蝶呤发生ADE报告共有45 496例,具有完整用药信息共20 835例。与其他ADE比较,肝病ADE在性别(P=0.067)、年龄(P=0.088)、给药途径(P=0.134)分布中均差异无统计学意义。见表3。
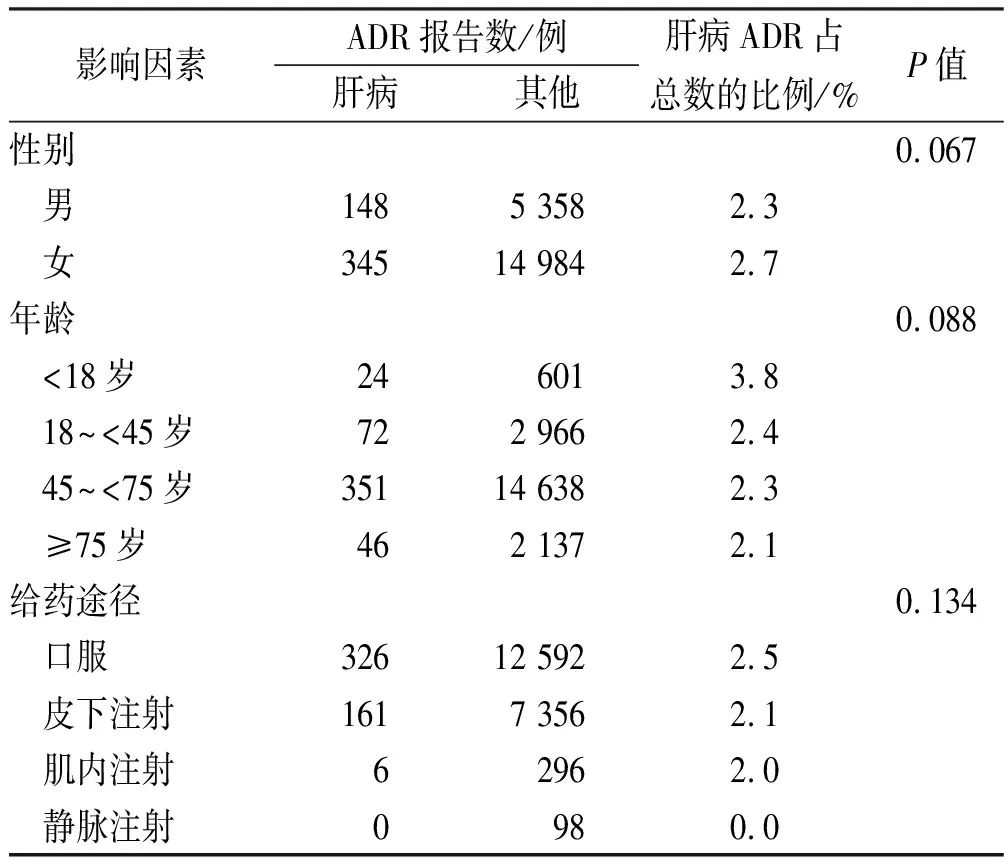
表3 ADR的影响因素
3 讨论
MedDRA的使用使ADR报告以及研究数据标准化,从而促进医药产品的安全使用[15]。目前很多研究都采用SOC法检测不良事件信号,但该方法会遗漏一些实验室检查而降低结果的可靠性。SMQ包含与某个被关注的医学情况或领域相关,并且涵盖有关的症状、体征、诊断等术语组,是一个很好的ADE信号检测工具,因此本研究采用SMQ来检测各个不良事件。FAERS的数据是上市后ADE信号检测的主要信息来源之一,其上报方式简单、涵盖的样本量大、上报人员覆盖面多且对公众开放。但作为一种自发呈报系统,它具有一定的局限。首先,只有小部分不良事件得以呈报,会导致一些信号被低估。其次,无法得到某一不良事件的实际以及在特定人群的发生率。最后,系统中具有缺失信息的报告无法纳入到数据统计过程。
本研究共检测出31个各种与药物相关肝病的信号,主要包含肝衰竭、肝纤维化和肝硬化以及其他涉及肝损伤的疾病及涉及肝脏的各类检查、体征和症状。采用ROR法进行数据处理后所得的ROR值越大,则表明该不良事件和药物的关联性越强。甲氨蝶呤的说明书中未包含肝良性肿瘤、凝血因子V浓度异常、结节再生性过度增生等强信号以及天冬氨酸氨基转移酶增加、食管静脉曲张出血等14个不良事件。其中,凝血因子V浓度异常的ROR值为138.50,提示在临床应用中若患者发生该ADE,应首先考虑是小剂量MTX所导致。对影响ADE发生率的因素进行χ2检验可知,与其他ADE比较,甲氨蝶呤发生肝病ADE在性别、年龄、给药途径等分布中差异无统计学意义。
综上所述,在甲氨蝶呤今后的临床实践中,对于本研究检测出但又不存在于说明书的不良事件信号,应给予重视,特别是凝血因子V浓度异常,并且对各类使用甲氨蝶呤的患者给予相同的重视。
