血清锂浓度水平及危急值在精神科的应用*
2021-06-15张少川陈志祥黄秋燕张海庆杨菠周莉胡怡黄朝红杨春霞
张少川,陈志祥,黄秋燕,张海庆,杨菠,周莉,胡怡,黄朝红,杨春霞
(云南省精神病医院/昆明医科大学附属精神卫生中心1.医学检验科;2.精神科;3.药学部,昆明 650224)
锂盐是精神科常用药物之一,具有治疗指数低、治疗浓度和中毒浓度较为接近的特点,一旦发生锂盐中毒,可引起神经系统、内分泌系统、心血管系统、消化系统和泌尿系统等多方面的损害,严重者可昏迷,并伴有心、肾功能衰竭而导致死亡[1-2]。同时,精神疾病患者存在主诉能力和依从性较差、沟通困难等特点。因此精神病专科医院在使用锂盐时进行碳酸锂浓度监测以及制定锂离子危急值报告制度显得尤为重要。笔者在本研究通过回顾分析某三级甲等精神病专科医院碳酸锂的监测数据、危急值发生率、患者不良反应、临床处置及实验室内样本周转时间(turnaround time,TAT)等,为进一步规范精神病专科医院碳酸锂的使用、完善危急值报告制度,提高精神病专科医院的医疗质量和医疗安全提供科学依据。
1 资料与方法
1.1一般资料 从我院实验室信息系统(laboratory information system,LIS)采集2015年1月—2018年5月共计1915例患者锂离子监测资料,包括住院/门诊号、患者性别、年龄、样本采集时间和接收时间、锂离子监测结果、报告审核上传时间、危急值上报记录等。若为危急值则再次通过医院信息系统(hospital information system,HIS)调阅其病历资料,补充其用药情况、不良反应、临床处置等,对以上信息进行回顾性统计分析。本研究经过本院伦理委员会审核通过。
1.2实验方法
1.2.1监测仪器及试剂 使用罗氏Roche AVL9181电解质分析仪(直接电极法),试剂、校准品、质控品均为Roche原装进口,检测线性范围0.1~6.0 mmol·L-1,每日进行室内质量控制并确保在控。年度室内质量控制变异系数<1.57%。国家级室间质量评价能力验证(proficiency test,PT)> 90分。
1.2.2参考范围及危急值的设定 锂离子参考范围根据神经精神药理学与药物精神病学协会(Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie,AGNP)的治疗药物监测(TDM)专家组发表的2011版、2017版精神药物治疗药物监测实用指南[3-4],碳酸锂说明书以及我院实际情况设定为0.40~1.20 mmol·L-1。危急值的制定在参考AGNP,并且协同医务部对临床科室发放“医学检验科危急值建立征求意见表”后共同协商设定为≥1.50 mmol·L-1。危急值报告采用网络与电话相结合的方式进行,即临床医师在HIS上接收危急值电子报告后进行网络确认,同时检验报告人再进行电话通知护理人员进行危急值确认。
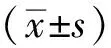
2 结果
2.1临床资料 1915例进行锂离子监测患者中,年龄12~86 岁,平均(39.14±16.28)岁;男577例(30.1%),年龄12~85岁,平均(40.13±19.31)岁;女1338例(69.9%),年龄12~86岁,平均(38.75±14.77)岁。男、女性患者平均年龄比较差异无统计学意义(t=-1.52,P>0.05)。
2.2性别与锂离子浓度及水平分布 1915例患者锂离子监测数据中,锂离子浓度中位数为0.66(0.47,0.87)mmol·L-1,男性0.62(0.42,0.81)mmol·L-1,女性0.69(0.49,0.90)mmol·L-1。女性患者锂离子浓度略高于男性,男女患者锂离子中位数差异有统计学意义(Z=-4.261,P<0.01),锂离子危急值浓度男女之间差异无统计学意义(Z=-0.451,P>0.05)。其中低于有效治疗浓度范围335例(17.49%),处于有效治疗浓度范围1462例(76.34%),高于治疗浓度范围118例(6.16%),其中达到危急值范围39例。锂离子危急值发生率为2.04%,浓度为1.75(1.62,0.90)mmol·L-1;男9例危急值发生率为1.56%,浓度为1.75(1.53,2.09)mmol·L-1,女30例危急值发生率为2.24%,浓度为1.76(1.62,2.03)mmol·L-1,女性患者锂离子危急值的发生率高于男性,见表1。

表1 性别与锂离子浓度水平分布
2.3年龄与锂离子浓度 在不同年龄组中,锂离子浓度随着年龄的增加呈递减趋势,<18岁患者锂离子浓度最高0.71(0.55,0.94)mmol·L-1,不同年龄组间锂离子浓度之间差异有统计学意义(P<0.001),危急值不同年龄段间锂离子浓度差异无统计学意义(P>0.05),但危急值的发生率随着年龄的增加而升高,见表2。

表2 年龄与锂离子浓度
2.4锂离子TAT 我院TAT规定,生化常规采样至样本接收为120 min,接收至发出报告420 min,采样至报告600 min。本文中,采样至接收为83 min,接收至发出报告59 min,整个锂离子监测从样本采集到发出报告共计需要151 min,当出现危急值时TAT均有大幅度缩短,差异有统计学意义(P<0.05),见表3。

表3 锂离子监测实验室周转时间
2.5锂离子危急值患者不良反应 39例危急值中,除3例门诊病历中未提示不良反应,36例(男/女:7/29)中32例在病程记录中均提示不良反应,4例提示未出现不良反应,不良反应发生率达88.89%,其中以神经系统为主(52.78%),7例男性患者均出现不良反应,不良反应发生率为100.00%,女性患者不良反应发生率为86.21(25/29),见表4。

表4 36例锂离子危急值不良反应
2.6锂离子危急值临床处置情况 39例危急值中,锂盐服药剂量为750 mg·d-1的3例,1000 mg·d-1的28例,1500 mg·d-1的6例,2例由于患者自行服药剂量(>10 000 mg)导致中毒,临床处置率为100%,处置方式:降低服药剂量23例(58.97%),停止服药14例(35.90%),紧急抢救2例(5.13%)。
3 讨论
中国医院协会2007年在《患者安全目标》文件中首次阐述危急值这一概念,其中明确要求“建立临床实验室危急值报告制度”[5]。国家卫生计划生育委员会《临床检验专业医疗质量控制指标》(2015版)中提出检验人员其中一项极为重要的工作就是有效处理异常检验结果,并有效建立危急值制度等[6],2016年中华医学会检验医学分会临床实验室管理学组把危急值(critical value)定义为能够提示患者生命处于危险/危急状态的检查数据/结果,此时临床应立即采取紧急适宜的抢救措施[7]。经过十多年的发展,危急值报告制度得到医护人员的广泛认可和重视,在各管理部门、协会组织以及医务工作者的共同努力下日趋规范。
被精神科医师广泛使用的锂盐是目前公认的一线心境稳定剂,可用于治疗躁狂和抑郁交替发作的双相情感性精神障碍等多种精神疾病。其急性治疗的血锂浓度为0.6~1.2 mmol·L-1,维持治疗的血锂浓度为0.4~0.8 mmol·L-1,超过1.4 mmol·L-1容易出现中毒症状(可出现脑病综合征,如意识模糊、震颤、反射亢进、癫发作乃至昏迷、休克、肾功能损害等),达到1.5~2.0 mmol·L-1以上可能危及生命[8-9]。但是目前国内外锂离子危急值的设定没有统一的界限,多设置在1.2~3.0 mmol·L-1范围内[3-4,10-12],我院在制定锂离子危急值时也存在争议,实验室推荐为≥2.0 mmol·L-1,但临床认为锂盐治疗指数低,治疗浓度与中毒浓度较为接近。一方面精神疾病患者存在其特殊性,当患者躯体出现异常时,不能及时准确与医务人员进行表述,而且与锂盐合并使用的其他精神科药物也存在较多不良反应,可能会掩盖部分精神疾病患者临床症状。另一方面由于锂盐不良反应的个体差异很大,在以往的临床案例中,有多位学者报道血清锂浓度正常而患者发生锂中毒[13-14]。临床医护人员主要依靠实验室的检测报告和更加认真细致的临床观察进行诊断和治疗。尤其是出现危急值时,对挽救患者的生命提供极其重要的参考依据,因此对于锂离子危急值的设置需更加谨慎小心,建议危急值设置应该略低一些,经医务部、实验室和临床三方综合协商后我院锂离子危急值设置为≥1.50 mmol·L-1。结合研究中39例危急值100%的临床处置率和88.89%不良反应发生率来看,我院锂盐危急值的设置较为合理,并且得到临床医师的认可。
本文中我院76.34%患者血锂浓度处于有效治疗浓度范围,高于时丽等[15]报道的64.2%而低于王平[16]报道的80.13%。尽管我院锂盐治疗药物浓度监测工作开展多年,临床医师根据TDM结果对患者进行个体化用药指导,取得一定的成效。但仍然有17.49%患者达不到治疗浓度,未获得较好的治疗效果,而4.13%患者血锂浓度高于治疗浓度,面临不良反应的巨大风险,进一步提示临床在使用锂盐治疗期间除密切观察病情外,应重视对血锂浓度的监测。
女性患者锂离子浓度高于男性(P<0.01),同时女性患者危急值的发生率也高于男性。从锂的生物利用度分析,女性体质量较男性平均低16%,每千克体质量血清容量较男性低6%,体内脂肪含量较男性高11%,由于亲脂性药物存留于脂肪组织,导致半衰期延长,女性廓清和排出低于男性,相同剂量下女性血药高于男性[17]。
从锂盐的药动学来分析,锂盐在体内不降解,绝大部分经肾排出,80%由肾小管重吸收,随着年龄的增加,排泄时间减慢,成人半衰期为12~24 h,少年为18 h,老年人为36~48 h,应该随着年龄的增加锂离子浓度逐渐增加。然而在不同年龄组中,随着年龄的增加锂浓度逐渐递减,不同年龄组间锂离子浓度差异有统计学意义(P<0.01)。<18岁患者血清锂浓度最高。考虑为患者服药量不同而导致,但由于总体样本量过大,使用SPSS进行住院/门诊号的随机抽样(simple random sampling),每个年龄段(<18岁,18~65岁,>65岁)随机抽取10例患者,统计其日均锂盐剂量,<18岁为1025(750~1250) mg,18~65岁为1050(500~1500) mg,>65岁为475(250~500) mg。有较多学者[18-19]研究认为锂盐对儿童的疗效、不良反应与成人相似,儿童对锂的耐受普遍良好。鉴于此,我院儿童患者服药剂量接近成人,导致儿童血药浓度高于成人。另外,老年患者由于半衰期较长等原因,我院医师对老年患者的锂盐使用相当谨慎,用药剂量远低于儿童和中年,导致血锂浓度较低。
1915例患者锂离子监测TAT中,3个时间段均低于我院生化常规检验规定的报告时间,特别是出现危急值时TAT均大幅度缩短,在非急诊标本的情况下采样至接收缩短至59 min,接收至报告缩短至39 min,整个检验流程仅需要100 min,比生化常规缩短500 min,比锂离子监测常规样本缩短51min。我院从2015年5月1日开始执行《临床检验专业医疗质量控制指标2015版》到执行WST496-2017 《临床实验室质量指标》,在4年多的实践运用中不断缩短TAT时间,得到广大医护人员的认可。特别是锂离子的监测作为精神病专科医院的特色项目,由于其临床使用的特殊性,尽管样本为常规样本,无论医护人员还是实验室人员,均充分认识到锂离子中毒对患者造成的危害,使锂离子检测的TAT大幅度缩短。
39例危急值患者中(除3例未提示用药后情况),不良反应发生率达88.89%(32/36),其中以神经系统为主,血液系统和消化系统次之,同时出现2个系统不良反应的患者达25%,与张纾等[2]报道的652例锂盐不良反应累及系统比例不一致,高于2016年《国家药品不良反应监测年度报告》中精神系统药品不良反应/事件累及系统排名(神经系统损害33.7%、胃肠损害18.2%、心血管系统损害10.3%)。由于本文报道的是发生锂盐危急值后的不良反应,患者不良反应相对较为严重,不良反应以神经系统为主,在神经系统不良反应的掩盖下部分其他不良反应表现不是很明显,导致临床医师难以进行描述和记录。
综上所述,锂盐的个体化差异较大,长期大量使用锂盐,会引起一系列的副作用甚至毒性反应[1-2,8];而且细胞内锂离子的排出较慢,可延长中毒持续时间;为确保用药安全,对于使用锂盐治疗的患者,建议定期监测锂离子浓度;同时建立符合本院实际的危急值报告制度,可以促进医、护、技间的各环节的配合与协调,进而减少医疗事故的发生,确保患者生命安全。
