血清铁调素及铁代谢指标与脑出血早期病情及预后的相关性研究
2021-06-14孙玙杨水泉胡朝晖梁文俊何杏玲
孙玙,杨水泉,胡朝晖,梁文俊,何杏玲
佛山市三水区人民医院神经内科,广东 佛山 528100
脑出血(Intracerebral hemorrhage,ICH)是急性脑血管病中最严重的一种,有极高的致残率及死亡率。研究表明,ICH 后大量铁沉积在血肿组织周围,继而导致继发性脑损伤[1]。铁调素(serum hepcidin,Hep)通过调控肠道铁的吸收、血清铁的浓度和组织铁的分布调控机体铁代谢平衡,是重要的铁调节多肽激素[2,3],其表达受炎症、铁水平等因素影响。血清铁蛋白(serum ferritin,SF)是机体铁状态的反映指标。炎性因子白细胞介素-6(interleukin-6,IL-6)在ICH 后高度表达,促进Hep 表达上调[4]。关于Hep、SF、IL-6在ICH中的具体作用目前尚未明确,缺乏相关的临床研究报道。本文旨在通过观察ICH 患者血清Hep、SF、IL-6动态变化,分析与神经功能缺损及预后的相关性,可为后续进一步研究ICH 后铁调素在脑铁代谢中的作用机制奠定基础。现报道如下。
1 材料和方法
1.1 病例资料
选取2017年1月至2019年8月本院收治的92例脑出血患者为观察组,入选标准:(1)首次发病;(2)患者在发病后12 h 内入院;(3)符合头颅CT 脑出血征象;(4)符合欧洲卒中指南诊断标准和第四届全国脑血管病会议的诊断标准[5]。排除标准:(1)继发性脑出血;(2)恶性肿瘤;(3)心肝肾功能异常及凝血功能障碍;(4)妊娠期以及哺乳期妇女;(5)入院后48 h内出现昏迷或死亡;(6)行手术治疗患者。观察组男54例,女38例;年龄33~82岁,平均(57.16±11.89)岁;发病时间2~8 h,平均(4.23±0.63)h;高血压病程1~7年,平均(3.25±0.23)年。另选取同期健康体检者92例为对照组,其中男52例,女40例;年龄33~82岁,平均(57.93±10.52)岁。两组受试人员性别构成以及年龄分布等基础资料相比较,经卡方检验后差异无显著性(P>0.05),资料具有可比性。本研究经医院伦理学委员会审核批准(佛科伦理号201610,2016-05-15),所有受试人员家属均知情同意。
1.2 研究方法
1.2.1 血清Hep、SF、IL-6及相关生化指标检测 观察组分别于发病1、3、5、7及14 d 晨起抽取静脉血5 mL,对照组于体检时抽取静脉血5 mL。采用常规实验方法检测空腹血糖、血清铁。采用铁调素ELISA 试剂盒检测血清Hep,全自动电化学发光免疫分析仪检测血清SF,ELISA 法检测血清IL-6。所有操作在标准实验室严格按照试剂盒操作说明完成。
1.2.2 临床神经功能缺损程度评分 患者入院第3 d采用美国国立卫生院神经功能缺损评分(National Institutes of Health Stroke Scale,NIHSS)量表评估神经功能缺损情况。根据评分结果将患者分为3组:轻型31例(NIHSS<4分),中型32例(4分≤NIHSS<15分),重型29例(NIHSS≥15分)。
1.2.3 预后判定 所有ICH 患者的功能结局采用改良的Rankin 量表(mRS)在其发病3月后进行[6]:根据评分结果将患者分为2组:预后好组51例(mRS>2分),预后差组41例(mRS≤2分)。
1.2.4 颅内血肿体积的计算 所有ICH 患者入院当天、入院后第3 d 进行头颅CT 检查。根据ABC 公式,计算血肿体积、病灶体积(血肿体积+水肿体积)及相对水肿体积系数(病灶体积-血肿体积)/血肿体积。
1.3 统计学分析
应用IBM SPSS 21软件进行统计分析,计量资料以()表示,两样本均数比较行独立样本的t检验,多样本均数比较行单因素方差分析,计数资料以率表示,采用χ2检验,并行Pearson 或Spearman 相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 观察组与对照组临床资料比较
观察组与对照组年龄、性别、吸烟、饮酒、糖尿病、收缩压、舒张压、空腹血糖水平比较,差异无统计学意义(P>0.05),见表1。
表1 观察组与对照组临床资料%(例)()Tab.1 Comparison of clinical data between observation group and control group(Mean±SD)

表1 观察组与对照组临床资料%(例)()Tab.1 Comparison of clinical data between observation group and control group(Mean±SD)
2.2 观察组与对照组各时间点血清Hep、SF、IL-6比较
观察组患者血清Hep、SF、IL-6水平在发病1、3、5、7、14 d 均高于对照组,差异具有显著性(P<0.01,P<0.05)。观察组发病1、3、5、7、14 d 血清Hep、SF、IL-6水平逐渐升高,7 d 达到最高峰,14 d 水平下降,但仍高于对照组(表2)。
表2 观察组与对照组不同时间点血清Hep、SF、IL-6含量()Tab.2 Comparison of serum Hep,SF and IL-6 in observation group and control group at different time points(Mean±SD)
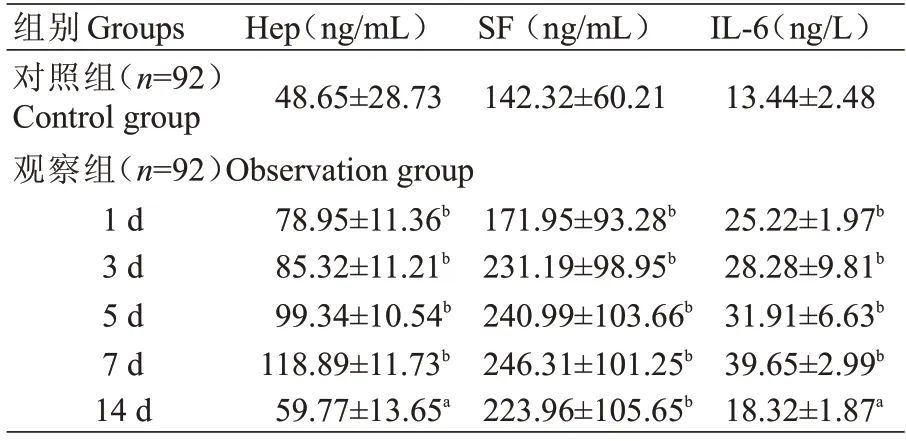
表2 观察组与对照组不同时间点血清Hep、SF、IL-6含量()Tab.2 Comparison of serum Hep,SF and IL-6 in observation group and control group at different time points(Mean±SD)
注:与对照组比较,aP<0.05,bP<0.01Note:compared with the control group,aP<0.05,bP<0.01
2.3 观察组不同神经功能缺损程度患者血清Hep、SF、IL-6比较
发病1 d 内观察组轻、中、重型患者血清Hep、SF、IL-6水平与对照组比较,均高于对照组,差异有统计学意义(P<0.01,P<0.05)。神经功能缺损程度越重,轻、中、重型3组血清Hep、SF、IL-6水平越高,两两比较,差异有统计学意义(P<0.01)。轻、中、重型3组不同时间点血清Hep、SF、IL-6水平两两比较,差异有统计学意义(P<0.01),见表3。
表3 观察组不同神经功能缺损程度患者血清Hep、SF、IL-6含量()Tab.3 Comparison of serum Hep,SF and IL-6 in patients with different degrees of neurological deficit in the observation group(Mean±SD)
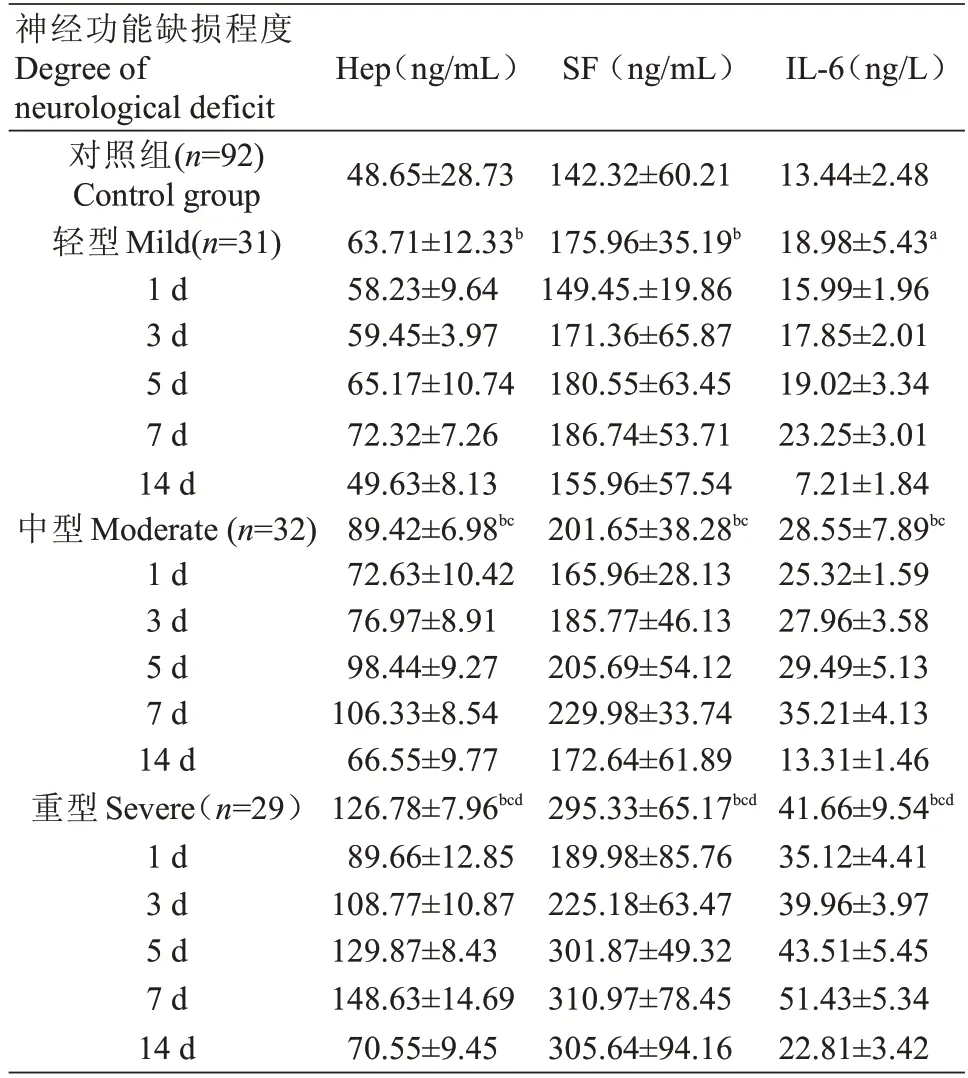
表3 观察组不同神经功能缺损程度患者血清Hep、SF、IL-6含量()Tab.3 Comparison of serum Hep,SF and IL-6 in patients with different degrees of neurological deficit in the observation group(Mean±SD)
注:与对照组比较,aP<0.05,bP<0.01与轻型组比较,cP<0.01与中型组比较,dP<0.01Note:compared with the control group,aP<0.05,bP<0.01;compared with light group,cP<0.01;compared with medium group,dP<0.01
2.4 观察组不同预后程度患者血清Hep、SF、IL-6比较
预后好组与预后差组比较,预后越差,血清Hep、SF、IL-6水平越高,差异有统计学意义(P<0.01)。预后好组、预后差组两组不同时间点血清Hep、SF、IL-6水平两两比较,差异有统计学意义(P<0.01)(表4)。
表4 观察组不同预后程度患者血清Hep、SF、IL-6含量()Tab.4 Comparison of serum Hep,SF and IL-6 in patients with different prognosis in the observation group(Mean±SD)
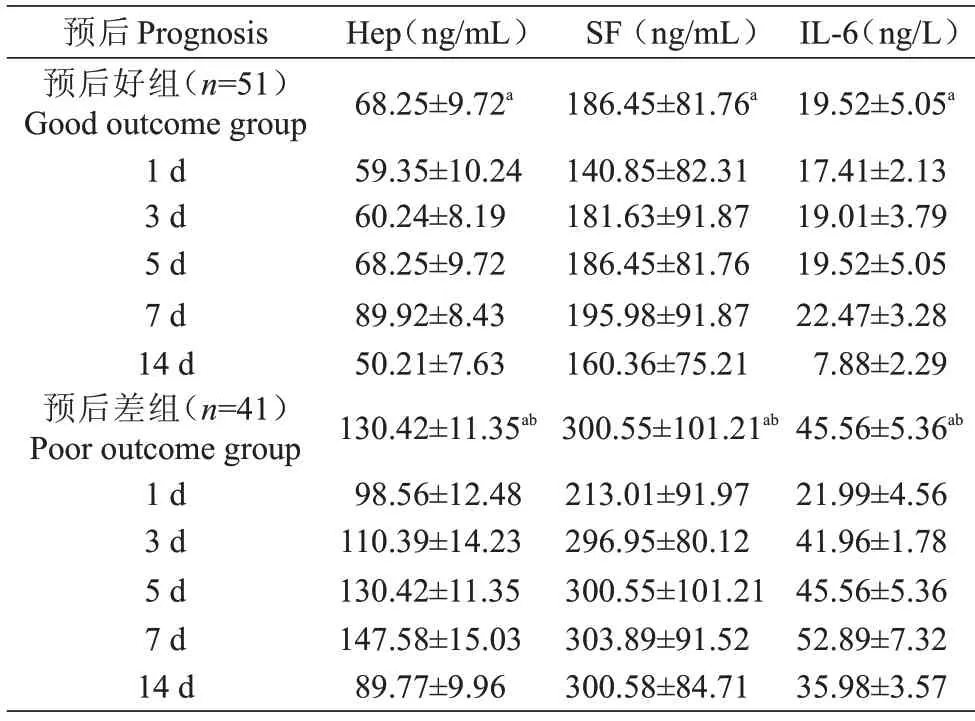
表4 观察组不同预后程度患者血清Hep、SF、IL-6含量()Tab.4 Comparison of serum Hep,SF and IL-6 in patients with different prognosis in the observation group(Mean±SD)
注:与对照组比较,aP<0.01与预后好组比较,bP<0.01Note:compared with the control group,aP<0.01;compared with the good prognosis group,bP<0.01
2.5 相关性分析
入院时ICH 患者血清Hep 水平与收缩压、舒张压、空腹血糖、血清铁均不相关(P>0.05);但血清Hep水平与SF 及IL-6水平呈正相关(P<0.01)。血清Hep与相对水肿体积系数即(血肿周围水肿体积与血肿体积的比值)在入院当天无显著相关性(r=0.304,P>0.05),入院第3 d 呈正相关(r=0.752,P<0.05),见表5。
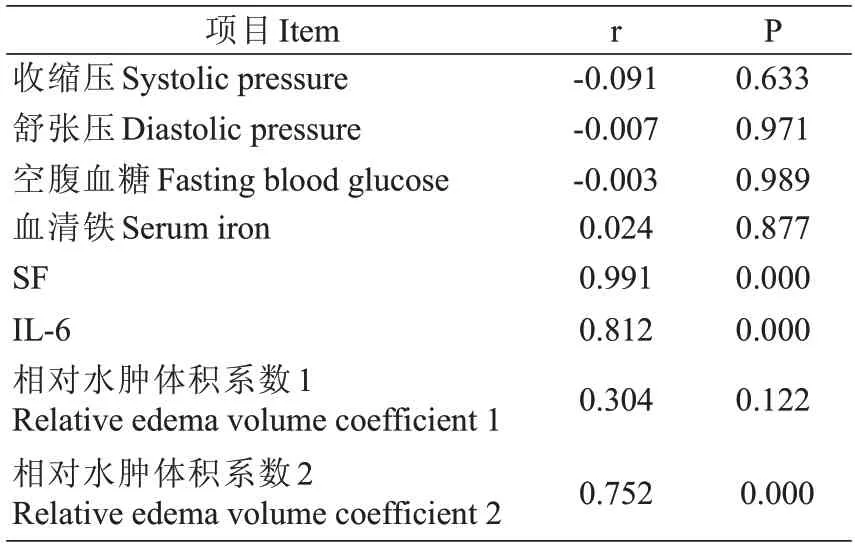
表5 相关性分析Tab.5 Correlation analysis
3 讨论
脑出血(ICH)后的血肿代谢产物会引起一系列继发性脑损伤,继而导致患者神经功能缺损[7]。脑出血发生后,血肿的血红蛋白分解为铁离子和胆绿素,因铁离子氧化性较强,并参与脑细胞代谢过程,在继发性脑水肿形成及神经细胞损伤中具有重要作用[8]。研究表明铁离子水平过高或者过低均会引起脑功能损伤[9]。深入研究脑出血后继发性脑损害,特别是铁代谢的病理生理机制,针对性采取干预措施,对于改善脑出血患者的预后具有显著意义。
铁调素(Hep)在机体铁代谢平衡的调控中具有重要的作用[3],是重要的多肽铁调节激素,Hep 升高会抑制脑微血管内皮细胞内铁离子外排入血减少而产生毒性作用[2]。Xiong 等[10]的研究证实,ICH 患者血清Hep 水平明显升高,是导致神经功能缺损的独立危险因素。Hep 的表达主要受铁、缺氧、炎症等的影响[2]。有研究表明ICH后高度表达的炎性因子IL-6可以促进Hep 表达上调,进而加重神经细胞的氧化应激损伤[5]。血清铁蛋白(SF)是人体内铁的主要储存形式,能准确反映脑含铁量[11,12],具有稳定、易检测等优点。ICH后血脑屏障通透性增加,大量铁蛋白进入血液,导致SF 升高[13]。SF 可用于ICH 病情严重程度的判断[14],其水平高低可间接反映ICH 脑水肿程度。
在此理论基础之上,本研究针对性地探讨了ICH患者Hep、SF、IL-6的动态变化,及与神经功能缺损及预后结局的相关性。本研究结果显示,观察组患者Hep、SF、IL-6水平较对照组均明显升高,且随着发病天数逐渐升高,7 d 达到最高峰后下降,但14 d 时水平仍高于对照组。ICH 后SF 水平逐渐增高,7 d 达到最高峰,证明脑出血引起铁蛋白增高,结果与国内外研究相一致。同时笔者发现,IL-6及Hep 也出现相应的变化。IL-6属于机体脑组织炎性反应过程中的炎性细胞因子之一,变化过程与ICH 后炎症反应的高峰时间点相似,Hep 的表达升高提示可能与ICH 后炎症反应有关。Hep、SF、IL-6水平在ICH 后逐渐升高,均在第7 d 达到高峰,这与ICH 后炎症反应及脑水肿的高峰点相吻合。
本研究通过对ICH 患者的神经功能缺损程度及预后进行分析发现,神经功能缺损程度越重,预后越差的ICH 患者,Hep、SF、IL-6水平就越高。且不同神经损伤程度、不同预后的血清Hep、SF、IL-6水平具有显著性差异。说明血清Hep、PF、IL-6水平对脑出血后神经功能缺损程度及预后情况均有较高的影响作用。血清Hep 水平与SF 及IL-6水平呈正相关,说明Hep、PF、IL-6在ICH 后的变化亦是互相影响的。其可能原因为:(1)脑出血后脑细胞坏死越严重,铁蛋白随着细胞的破坏而溢出进入血液中使得铁蛋白的含量增加;(2)脑组织破坏越大,炎症反应越明显,炎性因子IL-6相应表达亦越高。随着IL-6浓度的升高,易导致患者血脑屏障被破坏,从而增加脑血管通透性,进一步加剧脑水肿严重程度;铁蛋白作为急性炎性反应的标记之一,血清铁蛋白水平升高反映了脑卒中后全身炎性反应的水平,故脑出血越严重,SF 水平越高;(3)IL-6可以促进Hep 表达上调,铁调素与细胞膜上的Fpn1结合导致细胞内铁外排减少,从而导致铁在脑组织内大量蓄积,继续导致继发性脑损伤;铁蛋白的同时升高同时也可加速脑组织损伤[15]。另外本研究中血清Hep 水平与血清铁不相关,考虑脑出血时脑组织内铁离子水平虽然升高,但由于血脑屏障的存在,血清铁水平无显著相关变化,故血清铁不考虑为反映脑出血后铁代谢的理想指标。血清Hep 与相对水肿体积系数在入院当天不相关,入院后第3 d 呈正相关,考虑在脑出血早期,红细胞及血红蛋白未造成大量破坏,血清Hep 水平较低,随着病程进展,大量红细胞破坏导致铁超载,其毒性作用加剧脑水肿。脑出血血清Hep 水平可能提示脑水肿高峰期水肿体积的大小,可以为脑出血后水肿的评估和治疗提供线索。血清Hep、SF、IL-6水平与脑出血的发生、病情严重程度、预后有密切关系,可作为判断ICH 早期病情及预后的评价指标。本研究存在一些局限性,入选的病例数少,为小样本的临床研究,铁代谢与脑出血的关系复杂,ICH 后血清Hep、SF、IL-6增加水平对患者预后结局的贡献度仍不清楚等问题,尚需要进一步深入研究。