白细胞介素-10通过乙二醛酶1影响脊髓钝挫伤大鼠运动功能的恢复
2021-06-14牛英杰董越娇王若遥赵鑫鑫母姝祺张晓荣成
牛英杰,董越娇,王若遥,赵鑫鑫,母姝祺,张晓,荣成
成都医学院 1.临床医学院;2.基础医学院实验教学中心,成都 610500
脊髓钝挫伤(spinal cord contusion,SCC)是临床常见的神经系统疾病,发病率呈逐年上升趋势,愈后不良,给个人、家庭及社会造成严重负担,但至今无有效治疗方法。脊髓损伤后的继发性损伤是引起神经元凋亡和神经功能障碍的主要原因[1,2]。氧化应激和炎症反应在脊髓继发性损伤中扮演重要角色[3,4]。白细胞介素-10(IL-10)是一种多功能细胞因子,主要由Th2细胞、单核巨噬细胞等合成。在脊髓损伤后,IL-10通过抑制局部单核细胞,巨噬细胞的浸润和炎症介质核因子NF-κB 的表达对SCC 早期的炎性反应具有明显的抑制作用[5,6]。然而,IL-10影响脊髓损伤的机制不清楚。氧化应激是脊髓损伤后的继发过程,其可造成脊髓功能永久性障碍。GLO1(glyoxalase I,GLO1)是乙二醛酶系中的第1个酶,全长约3.4 kb,位于人第6号染色体的p21.3~p21.1[7];GLO1是糖代谢中的关键酶,主要参与丙酮醛解毒,能调节细胞生长,与阿尔茨海默病、癌症等多种疾病的发生有关[8~10],而且GLO1在氧化应激反应中起关键作用,其表达减少可引起神经元线粒体损伤[11]。研究表明NF-κB 调节GLO-1蛋白的表达[12],因此,GLO1在脊髓损伤中可能有阻止氧化应激产生的作用。但是,GLO1在脊髓损伤后的表达与作用机制研究较少,GLO1和IL-10两者之间的相互关系及作用机制仍不清楚。本实验采用实时荧光定量PCR(qRT-PCR)检测IL-10与GLO1的基因表达变化,用慢病毒介导的RNA 干扰技术抑制IL-10的表达,用生物信息学方法预测GLO1和IL-10之间的关系,探讨抗氧化应激因子GLO1与抗炎因子IL-10之间的相互关系。
1 材料和方法
1.1 实验动物及分组
66只健康成年Sprague-Dawley(SD)大鼠,3月龄,雌雄不限,220~280 g,由四川大学实验动物中心提供,分笼饲养,温度22~25 ℃。大鼠编号采用Excel生成随机数,随机数表法分为Sham 组(n=9)、SCC 组(n=27)、Vector 组(n=15)和IL-10 SH 组(n=15),进而分为3 d,7 d,28 d 3个亚组。Sham 组随机选取3只大鼠用于免疫组化染色;SCC 组、Vector 组和IL-10 SH组各随机选取9只大鼠用于免疫组化染色。Sham组、Vector 组和IL-10 SH 组各随机选取6只大鼠于7 d进行qRT-PCR 检测;SCC 组随机选取18只大鼠分别于3 d,7 d,28 d 进行qRT-PCR 检测。所有实验遵循成都医学院伦理委员会要求。
1.2 实验方法
1.2.1 动物模型和组织制备 采用改良的Allen’s 打击法制备大鼠脊髓钝挫伤模型。大鼠腹腔注射3.6%水合氯醛(1 ml/100g),麻醉生效后俯卧位固定,在T9~11的位置做背部正中纵向切口,逐层分离皮肤、筋膜和肌肉,剥除T10的棘突及其椎板,充分暴露T10节段脊髓,用自制打击仪从30 mm 高处自由下落,钝挫伤脊髓,逐层缝合伤口。术后消毒并腹腔注射2 ml 青霉素,正常饮食,每天早中晚各1次按摩膀胱排尿直至可以恢复自主排尿为止。
1.2.2 慢病毒载体制备 将高干扰效率的IL-10 siRNA 序列(GeneCopoeia,广州)克隆到红色荧光蛋白(red fluorescent protein,RFP)标记的载体中。再将该载体5 μg 和慢病毒包装质粒1 μl(GeneCopoeia,广州)共转染到293T 细胞生成病毒颗粒(IL-10-SHLV)。48 h 后取含有慢病毒细胞的上清液,置于0.45 μm 的醋酸纤维素过滤器中过滤,除去滤液,再取5 mL 离心(3500 r,25 min),除去上清液,将沉淀重新溶解在500 μl PBS 中。置于-80 ℃冰箱冻存。
1.2.3 慢病毒转染 取Vector 组和IL-10 SH 组大鼠,麻醉与手术方法同前,充分暴露脊髓T10节段,使用脑立体定位仪于脊髓拟打击点左右两侧分别向两组大鼠脊髓蛛网膜下注射5 μm 的Vector 和IL-10-RNAi-LV,进针3~5 mm,针体与水平面成45 ℃,依次缝合肌肉、筋膜及皮肤,进行消毒及抗感染处理。
1.2.4 免疫组织化学 大鼠于脊髓损伤后3 d、7 d 及28 d 进行脊髓组织取材,麻醉同前,用4%多聚甲醛的磷酸缓冲液(PB,PH=7.4)进行灌注,灌注后立即采集脊髓损伤段(1~3 cm),保存于上述相同溶液中,固定48 h 以上。常规石蜡包埋切片,每张切片厚度为5 μm。用SP 三步法进行免疫酶组织化学染色,即常规脱蜡、水化、高压抗原修复10 min,3%H2O2去离子水37 ℃孵育10 min 灭活内源性过氧化物酶,0.01 mol/L PBS 漂洗后,10%的羊血清37 ℃10 min 封闭非特异性抗原,滴加一抗(GLO1,Rb,1:200,北京博奥森),4 ℃过夜,次日取出复温,0.01 mol/L PBS 漂洗后依次滴加SP 试剂盒(SP-9001,北京中山金桥)B 液与C 液于37 ℃孵育15 min,间隔用0.01 mol/L PBS 漂洗,DAB显色,苏木素复染,1%盐酸酒精分色,梯度乙醇脱水,二甲苯透明,中性树胶封片。Motic 光学显微镜下拍照,400倍下采集图片,应用Image J 对图片的阳性细胞数及IOD 值进行检测。
1.2.5 免疫荧光检测脊髓损伤组织中IL-10定位 脊髓组织标本被放置于0.1 M 磷酸盐缓冲液(pb)中含20%蔗糖溶液。在标本沉入瓶底之后将其放入冷冻切片机(Leica CM1900,Wetzlar,Hesse,德国),做20 mm 厚的连续水平切片。之后,脊髓组织用磷酸缓冲液配置的0.2%TritonX-100清洗后,用PBS 缓冲液配置的山羊血清封闭。加入一抗IL-10(rabbit,Boster,1:100),4 ℃孵育24 h,用PBS 清洗后,将组织在荧光二 抗IgG(配比为anti-rabbit Cy3:red=1:200;antimouse 488:green=1:100,Alexa 公司)37 ℃下孵育4 h。与此同时,对照组在PBS 缓冲液中孵育。最后,用荧光显微镜观察切片。
1.2.6 qRT-PCR 检测mRNA 表达水平 术后7 d 取材。大鼠麻醉同前,仰卧位开胸,用眼科剪在心尖处剪开,经左心室插管入主动脉,灌注灭菌生理盐水200 ml 左右,灌注后立即采集脊髓损伤段(1~3 cm)放入进口无RNase 的1.5 mL EP 管中,用TRIZOL 裂解液并匀浆至无肉眼可见组织块,提取总RNA。按照RevertAidTM First Strand cDNA Synthesis Kit 试剂盒说明书进行,逆转录为cDNA,-20 ℃冰箱储存备用。设计大鼠内参β-action、GLO1和IL-10的引物序列(表1)。从-20 ℃冰箱中取出损伤脊髓段,按照宝生物(大连)有限公司的试剂盒说明进行qRT-PCR。反应条件:95 ℃,2 min 后,95 ℃变性15 s,52 ℃退火20 s,60 ℃延伸40 s,循环40次。以β肌动蛋白(β-actin)为内参照。最后得到S 形动力学曲线,读出Ct 值,人工校正后按2-△△Ct 计算出相对表达量。
1.2.7 运动功能评价 所有的对照组和实验组动物进行BBB(Basso,Beattie,Bresnahan)评分。随机选取动物于无障碍空地自由活动5 min,观察和记录动物后肢的运动功能,按照BBB评分表进行随机双盲评分。
1.2.8 生物信息学预测 应用GeneMANIA(http://www.genemania.org/)预测GLO1与IL-10之间的生物信息学关系。
1.3 统计学分析
2 结果
2.1 脊髓损伤后,IL-10对大鼠运动功能的影响
2.1.1 脊髓损伤后的运动功能改变 脊髓损伤后BBB 评分立即降至0分,并在之后的3 d、7 d 和14 d 逐渐增加,相较于对照组P<0.05(n=6)(图1A)。
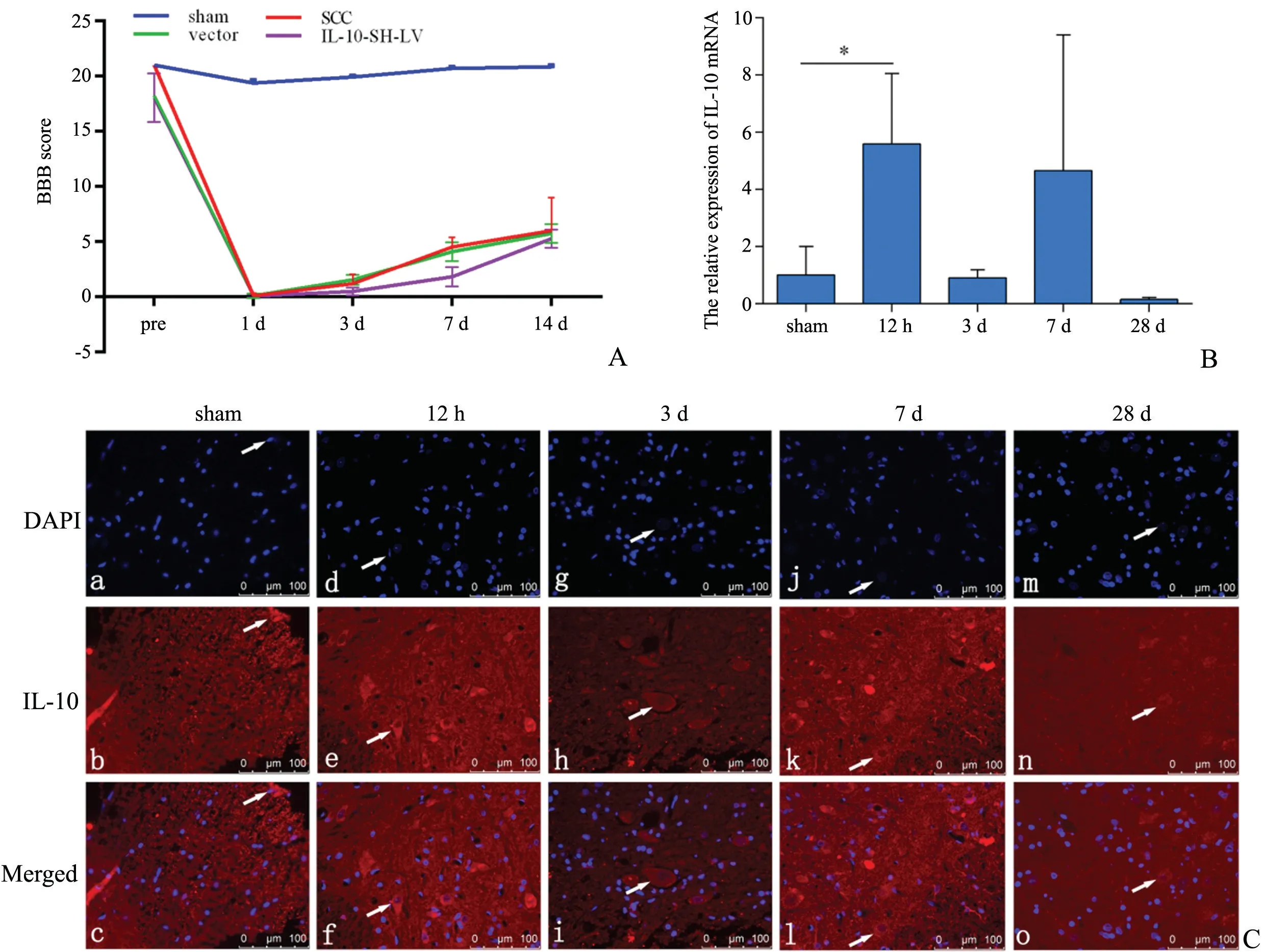
图1 脊髓损伤后BBB 评分比较及IL-10的表达和定位A:脊髓损伤后各组BBB 评分B:脊髓损伤后不同时间点IL-10基因表达C:免疫荧光染色检测不同时间点各组脊髓前角IL-10表达(400×)a~c,d~f,g~i,j~l,m~o 依次显示不同时间点DAPI(蓝色),IL-10(红色)和Merged 白色箭头指示免疫阳性的神经元bar=100 μmFig.1 The comparison of BBB sores and the expression and location of IL-10 after SCCA: BBB scores of every group after SCC; B: The expression of IL-10 at different time after SCC; C: The location of IL-10 of different groups(immunofluorescence staining,400×);Figures C-a-c);C-d-f);C-g-i);C-j-l);C-m-o)showed DAPI(blue),IL-10(red)and Merged at different time.The white arrow showed the immunoreactive positive neurons,bar=100μm

表1 引物序列信息Tab.1 Information of primer sequences
2.1.2 抑制IL-10降低后脊髓损伤运动功能的恢复在脊髓损伤后的3,7和14 d,BBB 评分结果显示,IL-10-SH-LV 组的分数低于Vector 组,P<0.05(n=6,图1A),且IL-10干扰后的BBB 评分相较于SCC 组更低,提示,IL-10可能促进脊髓损伤的恢复。
2.1.3 IL-10在脊髓损伤后的定位表达和变化 qRTPCR 结果显示脊髓损伤后,IL-10的表达随即增加,随时间推移逐渐降低(P<0.05)(图1B)。具体结果如下:术后12 h,IL-10的mRNA 表达量(5.59)相较于sham 组mRNA 的含量(1.00)增加(P<0.05),随时间推移在3 d(0.91),28 d(0.15)呈现逐渐降低的趋势,且均低于sham 组(图1B)。免疫荧光结果显示IL-10免疫阳性产物(红色)位于脊髓前角灰质的神经元和神经胶质细胞中,如图1C a~o。同时,细胞核被DAPI 染为蓝色(图1C)。
2.2 IL-10通过GLO1影响脊髓损伤的功能恢复
2.2.1 慢病毒介导的IL-10重组体构建 为进一步确定脊髓损伤大鼠中IL-10的作用及其机制,本实验构建了IL-10的重组体。3个IL-10的siRNA 序列(F1,F2,F3)被转染到293T 细胞中,利用qRT-PCR 筛选出转染效率最高的序列。结果显示转染过F1,F2和F3序列后,IL-10的表达分别为0.14,1.05和0.28,即F1序列是最有效的IL-10-SH-LV 序列(图2A~B)。免疫荧光染色结果显示,IL-10在细胞中被RFP 标记,证明IL-10-SH-LV 被成功转染到宿主细胞中(图2C)。

图2 慢病毒介导的IL-10重组体构建A:IL-10-siRNA-LV 序列的简要信息 增强荧光蛋白(mcherryFP)作为一个受体基因被插入包含氨苄西林和pUC Ori 位点的质粒中B:qRT-PCR结果比较显示F1序列是3个IL-10干扰序列中最有效的*P<0.05 C:免疫荧光染色图片显示IL-10转入293T 细胞(IL-10-RNAi-LV 呈红色,400×)bar=100 μmFig.2 Construction of IL-10 siRNA vectorA: The information of IL-10-siRNA-LV,mcherryFP was inserted in the plasmid as a receptor gene:including antibiotic sites:ampicillin and pUC Ori; B:The sequence of F1 was the most effective one in the three interference sequences which detected by qRT-PCR (* P<0.05); C: IL-10-RNAi-LV (red)fluorescent picture showed IL-10 was transfered into 293T cells(immunofluorescence staining,400×),bar=100 μm
2.2.2 GLO1在脊髓损伤后的定位和表达 采用qRT-PCR 检测GLO1的表达,结果显示,脊髓损伤后12 h,GLO1表达显著下降,但在损伤后的3 d、7 d 和28 d,其表达逐渐增加,但相较于sham 组GLO1的表达均降低(P<0.05)。免疫组化结果显示,GLO1免疫阳性反应物位于脊髓灰质的神经元内;IL-10干扰后,GLO1免疫阳性产物位于脊髓前角灰质的神经元和神经胶质细胞中。采用Image J 统计GLO1阳性细胞数,显示脊髓损伤后GLO1阳性细胞减少,但之后逐渐上升,结果和qRT-PCR 一致(P<0.05);IL-10干扰后GLO1阳性细胞的积分密度(IOD)值高于Vector 组,见图3。

图3 GLO1在体内的表达和定位A:脊髓损伤后各时间点GLO1的相对表达B:脊髓损伤后各时间点GLO1免疫阳性细胞数 C:免疫组化染色图片显示各时间点脊髓前角GLO1表达(400×)红色箭头指向阳性神经元bar=100 μm a:GLO1在sham 组的定位b~e:免疫阳性产物在12 h、3 d、7 d 和28 d 亚组中位于神经元细胞浆中*P<0.05,与sham 组相比#P<0.05,7 d 与28 d 相比Fig.3 The expression and location of GLO1 in vivoA:The relative expression of GLO1 at different time after SCC;B:The number of GLO1 positive cells at different time after SCC; C: The immunoreactive positive reactant of GLO1 in the anterior horn of the spinal cord at different time after SCC(immunohistochemical staining,400×),the red arrow pointed to the positive neurons,bar=100μm.a:the location of GLO1 in the sham group;b-e:the immunoreactive positive reactant located in the neuron plasma at 3d,7 and 28d subgroups.Note:compared with the sham group*P<0.05;7d compared with 28d#P<0.05
2.2.3 IL-10通过GLO1协同调控脊髓损伤 为研究不同炎症因子对脊髓损伤后氧化应激的影响,明确与脊髓损伤后氧化应激关系最密切的炎症因子,本实验采用慢病毒介导的RNAi 技术干扰多个炎症因子及抗炎因子,探究抗氧化应激因子GLO1的表达变化,具体因子如下:IL-10-SH-LV、TNFα-SH-LV、IL-6-SHLV、AQP4-SH-LV、IL-1β-SH-LV。qRT-PCR 结果显示,相较于Vector 组(0.17),慢病毒干扰IL-10后,GLO1的表达(0.27)增加最为显著(P<0.05),IL-1β-SH-LV组GLO1的表达量最低(0.13)(图4A~B)。免疫组化结果显示,IL-10干扰后,GLO1免疫阳性产物位于脊髓前角灰质的神经元和神经胶质细胞中。Image J 检测,GLO1的免疫反应阳性神经元和IOD 计数均显示:GLO1的表达量随时间推移逐渐增加,且在3 d、7 d、28 d 相较于Vector 组增加(P<0.05)(图4D)。
2.2.4 生物信息学预测 采用GeneMANIA 生物信息学预测IL-10和GLO1之间的关系,结果显示:IL-10和蛋白C(protein C,Proc),激肽释放酶2(Kallikrein 2,Klk1c2)、电压门控钾通道亚基KV9.1(potassium voltage-gated channel modifier subfamily S member 1,Kcns1)共表达,同时,所有上述因子与4-羟基苯丙酮酸双加氧酶(4-hydroxyphenylpyruvate dioxygenase,Hpd)共表达。此外,GLO1和Hpd 享有相同的蛋白结构域(图4C)。综上,生物信息学结果提示:IL-10和GLO1之间可能有一定的相互作用。

图4 IL-10和GLO1之间的关系A:慢病毒介导的不同基因干扰后GLO1的相对表达变化 B:慢病毒介导的IL-10转染后GLO1的表达C:生物信息学预测IL-10和GLO1之间的关系 D:免疫组化染色图片显示IL-10干扰后GLO1在脊髓前角的定位(400×)bar=100 μm a~c,e~g:IL-10干扰后各组不同时间点GLO1阳性细胞的定位 红色箭头指向GLO1阳性神经元 黑色箭头指向GLO1阳性神经胶质细胞d:IL-10不同组GLO1的阳性细胞数比较h:IL-10干扰后GLO1阳性细胞的IOD 值 *P<0.05,两组相比Fig.4 The relationship of IL-10 and GLO1A:The relative expression of GLO1 after different genes were inhibited by lentivirus(IL-10-SH-LV、TNFα-SH-LV、IL-6-SH-LV、AQP4-SH-LV、IL-1-SHLV);B:The expression of GLO1 after inhibiting IL-10 mediated by lentivirus;C:GeneMANIA forecasted the relationship of IL-10 and GLO1;D:The location of GLO1 in the ventral horn of spinal cord after IL-10 was inhibited(immunohistochemical staining,400×),bar=100μm.D-a-c,e-g:The location of immunoreactive positive reactant of GLO1 at different time points of every group after IL-10 was inhibited.The red arrows pointed to the positive neurons,the black arrows pointed to the positive neuroglial cells;D-d:The comparison of different groups’number of GLO1 positive cells;D-h:IOD of GLO1 positive cells after IL-10 was inhibited.The two groups compared*P<0.05
3 讨论
脊髓损伤(SCC)是一种常见的高致残神经系统创伤,脊髓损伤后的继发性损伤可导致严重的神经功能丧失,进而引起组织、器官功能障碍,其发生机制与炎症反应和氧化应激有密切联系。其中,IL-10是一种重要的抗炎因子,GLO1是重要的抗氧化应激因子,参与疾病的能量代谢环节,它们的表达和调控影响着脊髓损伤的修复,是临床治疗脊髓损伤的潜在靶点。然而,脊髓损伤后IL-10和GLO1之间的关系尚不清楚。本实验从3个方面研究IL-10在脊髓损伤模型中的角色。首先,在现象水平,检测IL-10在脊髓损伤大鼠的表达和定位。其次,在功能水平,慢病毒介导的RNAi 干扰IL-10的表达,确定IL-10在大鼠运动功能中的作用。最后,在机制水平,GeneMANIA 生物信息学用于检测相关的功能机制,qRT-PCR 进一步证明结果。所有结果显示,IL-10和GLO1共表达、共定位。干扰IL-10后,GLO1的表达上调,可能影响脊髓损伤大鼠运动功能的恢复。
3.1 脊髓损伤后,IL-10对大鼠运动功能的影响
在本实验中,首先观察脊髓损伤大鼠运动功能的改变。BBB 评分结果显示,脊髓损伤后大鼠后肢运动立即降至零,虽然随时间推移会部分恢复,但未恢复至正常水平。qRT-PCR 结果显示,在脊髓损伤后早期,IL-10的表达增加,随后却低于对照组。免疫荧光结果显示,IL-10主要位于损伤脊髓组织前角灰质的神经元和神经胶质细胞中。所有实验结果提示:IL-10在脊髓损伤后可能扮演着重要的角色。据报道IL-10主要由巨噬细胞和单核细胞产生,是一种免疫调节因子,能阻断免疫炎症发展过程的多个环节,具有广泛的免疫抑制活性[13,14]。研究表明,IL-10不仅可以下调多种炎症因子和凋亡因子,如白细胞介素1β(IL-1β)、白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、TNFα和caspase 3、Bax,此外,它还能上调多种抗炎因子,如Bcl-2、Bcl-xl 等[15,16]。有研究表明脊髓损伤后30 min 内全身应用IL-10可显著抑制细胞凋亡,保护脊髓,促进脊髓功能的恢复[17]。Oruckaptan 等[18]发现,系统性调节IL-10可以减轻早期的损伤反应,甚至可能限制脊髓损伤后24 h 内的组织损伤。Zhou 等[19]研究证实,IL-10通过脊髓神经元中的IL-10受体激活NFkappaB 转录出Bcl-2和Bcl-xl,进而诱导出一连串信号级联反应,提示IL-10可能在脊髓损伤中起直接的神经保护作用。综上,IL-10在脊髓的神经保护和神经修复中起重要作用。因此,在脊髓损伤早期增加IL-10的表达有益于抑制炎症反应,促进大鼠运动功能的恢复。总之,增加IL-10的表达可能是治疗脊髓损伤的一个潜在靶点。
3.2 抑制IL-10上调GLO1可能通过影响能量代谢促进脊髓钝挫伤大鼠运动功能的恢复
为进一步探索IL-10在脊髓损伤中的作用,本实验使用慢病毒介导的RNA 干扰技术抑制IL-10的表达,BBB 评分结果显示IL-10干扰组运动功能明显低于对照组,但是所有组的分数随时间逐渐增加。结果提示,抑制IL-10的表达会阻碍脊髓损伤大鼠运动功能的恢复。此外,IL-10干扰后GLO1表达增加最为明显。而且,在脊髓损伤后,GLO1表达变化与BBB评分成正比。生物信息学提示IL-10与GLO1通过其他因子有共定位、共表达的关系。qRT-PCR 结果在基因水平进一步证明干扰IL-10后,GLO1的表达显著增加,提示IL-10可能调节GLO1的表达。综上,IL-10可能和GLO1存在相互作用。IL-10是一个重要的抗炎因子,在脊髓损伤修复中扮演重要的角色[17,20]。Thompson 等[21]研究表明,外源性注射IL-10可促进大鼠脊髓损伤后的修复,进一步改善后肢的运动功能。之前所有研究表明IL-10对脊髓损伤大鼠运动功能恢复起促进作用。本研究也进一步证明了IL-10对SCC恢复的益处;而且,qRT-PCR 结果显示干扰IL-10后,GLO1的表达增加。研究表明,GLO1蛋白分布在人体所有组织中,共编码184个氨基酸,可调节细胞内生长,对细胞起到重要的保护作用,其生理功能是对MG(甲基乙二醛)的解毒作用,MG 是AGEs(晚期糖基化终产物)的有效前体;GLO1是氧化镁解毒乙醛酶系统的限速酶;GLO1不仅参与糖尿病的发生发展,而且参与肿瘤的形成;GlO1抑制剂有抗肿瘤的作用;脊髓损伤后氧化应激的出现,可导致神经元和神经胶质细胞丧失,进而造成脊髓功能永久性障碍,而GLO1可阻止氧化应激的产生,且GLO1表达水平或活性降低将导致组织损伤;脊髓损伤急性期内IL-10表达显著增加,而且IL-10通过抑制NF-κB的激活从而抑制其他炎症因子,进而发挥抑制早期炎症反应的作用,文献显示NF-κB 可促进IL-10的表达,NF-κB 位于GLO1启动子区,NF-κB 亦可上调GLO1的表达[22~32]。综上所述,GLO1在脊髓损伤后起重要作用,其可能通过氧化应激中的能量代谢发挥作用。然而,GLO1在脊髓损伤大鼠中的确切功能尚不清楚。
本实验证明GLO1参与脊髓损伤大鼠运动功能的恢复,研究结果与之前的实验一致;此外,抑制IL-10的表达降低上调GLO1的表达,有助于脊髓损伤大鼠运动功能的恢复。总之,IL-10可能通过GLO1影响大鼠脊髓损伤的恢复,这可能为临床脊髓损伤的基因治疗提供潜在的靶点。
