小肠间质瘤合并肝转移的临床诊治(附1 例个案报告)
2021-06-13陈国梁侍新宇姚慧慧武冠廷万岱维何宋兵
陈国梁,侍新宇,姚慧慧,武冠廷,顾 闻,万岱维,汪 良,何宋兵
(1.苏州大学医学部,江苏 苏州 215123;2.苏州大学附属第一医院普外科,江苏 苏州 215006)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是起源于形态和免疫表型与Cajal间质细胞相似细胞的一类肿瘤。GIST年发病率在(11~14.5)/100万,占所有胃肠道肿瘤的1%~3%[1-2]。发生在胃肠道的原发性GIST,因表现出症状而被诊断的占69%,术中意外诊断的占21%,其余10%因尸检发现。CD117是c-kit原癌基因表达的蛋白,作为一种酪氨酸激酶生长因子受体,是GIST特异的免疫组织标志物之一。组织病理学和免疫组织化学染色与其他免疫标记物,包括CD34、DOG1、平滑肌肌动蛋白(SMA)、S100蛋白和结蛋白的应用,有助于GIST同其他原发性的胃肠道间充质肿瘤的鉴别诊断。GIST可以发生在从食管到直肠的胃肠道的任何位置,但小肠是第二常见的受累部位(30%~40%)[3]。由于小肠GIST发病率相对较低,症状无特异性且多变,影像学表现也多种多样,从而导致小肠GIST诊治的延迟或误诊[4]。
GIST最常见的转移部位是肝脏和腹膜,其中15%~20%可发生同时性肝转移,另有约25%的患者可出现异时性肝转移。因为小肠GIST的生物学行为往往异于其病理分期,一般仅有3%~38%组织学检验呈恶性,却多达68%的GIST发生远处转移,且症状表现不典型,往往在小肠GIST还未出现临床症状的情况下就已经出现了肝脏的转移灶,常因体检意外发现,因而容易导致误诊和误判,给小肠GIST合并肝转移的治疗造成了困难。Seesing等[5]研究认为,R0切除是影响预后的独立因素之一,在病理诊断明确的基础上应当积极行手术切除。
本文我们通过对我科收治的1 例小肠间质瘤伴肝转移患者的临床资料进行分析,试图通过我们的报道及对以往研究的回顾,旨在帮助了解小肠GIST肝转移患者的治疗方法和改善预后,现报道如下。
1 临床资料
患者男性,28岁,因“体检发现小肠肿块伴肝占位一周”入院。患者1 周前体检查腹部CT示:左下腹小肠区不规则软组织肿块,肝左叶占位。后患者入住当地医院,查胸腹部增强CT示:左下腹小肠区见不规则软组织肿块,考虑恶性肿瘤可能;肝脏左叶占位两枚:转移瘤待排;肝右叶及右肾小囊肿。胃镜检查示:浅表性胃炎;肠镜检查未见明显异常。于当地医院予补液、补铁等治疗后出院。
患者为求进一步诊治至我院消化内科行全麻下小肠镜检查,经口小肠镜检查见空肠距幽门50 cm有一巨大新生物,呈菜花样,表面高低不平,活检质脆,易出血,活检后予去甲肾上腺素稀释液冲洗止血,余所见食管、胃、十二指肠未见明显溃疡、狭窄及隆起性病变(图1)。经肛小肠镜检查所见结肠、回肠未见明显溃疡、狭窄及隆起性病变。术后予半流质饮食,抑酸护胃、止血、补液等辅助治疗。术后活检病理报告显示(空肠距幽门50 cm黏膜)GIST,局灶腺上皮低级别上皮内瘤变(图2)。免疫病理I20-05891:瘤细胞CK(-),EMA(-),CD117(+),DOG-1(+),SMA(-),S100(-),Desmin(-),Ki-67(+,30%)。
后我科以“小肠肿物,肝占位待查:恶性肿瘤”收住入院,病程中患者无腹痛腹泻、黄疸、恶心呕吐、黑便便血等不适主诉。查体:神清,精神可,轻度贫血貌。巩膜及全身皮肤无黄染,全身浅淋巴结未扪及肿大。腹平,未见胃肠型及蠕动波,无腹壁静脉曲张,腹软,全腹无压痛、反跳痛,Murphy征(-),肝脾肋下未及,未触及包块,移动性浊音阴性,肠鸣音5 次/min。双下肢无凹陷性水肿,生理反射存在,病理反射未引出。实验室检查:甲胎蛋白2.84 μg/L,癌胚抗原1.91 ng/mL,CA199<2.00 U/mL。考虑为小肠肿物,肝占位待查。完善相关检查,排除手术禁忌后,于2020-07-14行腹腔镜下小肠部分切除术+腹腔镜下肝部分切除术+腹腔镜下胆囊切除术。
术后解剖标本(图3),后续常规病理显示:(小肠)GIST(核分裂>5/50 HPF),局灶坏死,侵及全层,两切端未见肿瘤累及;(左半肝)考虑GIST转移,切缘未见肿瘤累及;(胆囊)未见肿瘤累及(图4)。免疫病理:CD117(+),Dog-1(+),CD34(+),SDHB(弱+),Ki-67(约40%+)。
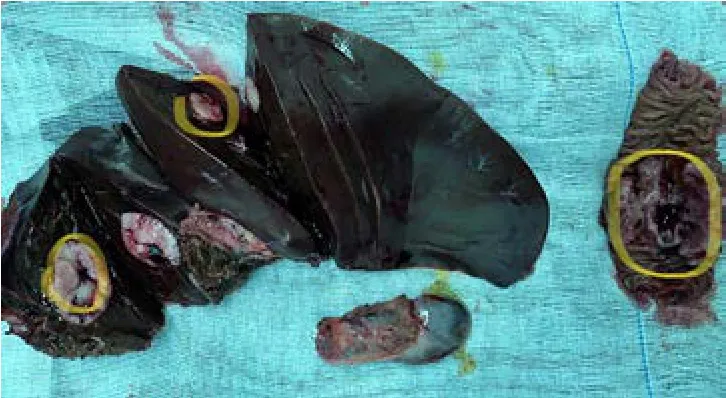
图3 手术标本情况(小肠,肝脏和胆囊)

图4 肝脏肿瘤病理镜像(HE×40)
病人术后体征平稳,肝功能无明显异常,恢复顺利,伤口愈合情况理想,于术后第8天出院(图5)。3 个月后复查,患者恢复情况良好。

图5 出院时手术切口情况
2 讨论
GIST是一种交界性,具有恶变潜能的非定向分化肿瘤,起源于间叶组织,多见于胃肠道,小肠受累亦不少见,占GIST的30%~40%。发生于胃肠道以外的GIST较为少见,肝脏原发性GIST更是极为罕见,因此发生于肝脏的间质瘤多为GIST的转移病灶。根据文献预估GIST肝转移的年发病率为(1.2~2.6)/100万,其中的70%为异时性的,即GIST术后发生的肝转移,Chiappa等[6]报道的GIST的术后复发或转移的时间为4~36 个月,中位时间为12 个月,最长可达32 年。而本病例报告的患者发生肝转移发生于GIST同期,更为少见,占胃肠道肿瘤的0.05%~0.24%。
2.1 病因 GIST多发生于中老年人,40 岁以下患者少见,发病无性别差异[7]。国内有队列研究显示,32 例小肠间质瘤患者的免疫组化显示CD117(100%)、CD34(81.2%)、DOG1(93.8%)、SMA(37.5%)、S100(9.4%)和Desmin(6.2%)阳性表达[8]。CD117、DOG1和CD34等免疫学指标在小肠间质瘤患者主要为阳性,另一组数据显示超过75%的人在KIT中显示突变,另有5%~10%的GIST患者存在与编码PDGFRA受体酪氨酸激酶相关的基因突变。酪氨酸激酶家族的原癌基因c-kit或血小板转化生长因子受体-α基因(PDGFRA)基因功能获得性突变是GIST,也是小肠GIST合并肝转移的重要的分子学特征。
GIST转移多见于腹腔种植和肝转移,淋巴转移罕见。相较于胃间质瘤,小肠间质瘤具有更强的侵袭性和更高的危险度,因而也具有更高的肝转移风险[9]。这与GIST的生物学行为有关,尽管具有恶性组织学特征的间质瘤仅占GIST的1/3左右,但2/3的GIST均可出现远处转移。发生肝转移时转移灶常多发,多两叶肝同时发生,具体的转移机制目前尚不清楚。先前有专家提出,推测GIST恶性程度和转移复发倾向的指标为GIST肿瘤大小和50 HPF下核分裂相的数目:(1)肿瘤直径小于2 cm且核分裂相数目小于5/50 HPF为极低度恶性;(2)肿瘤直径2~5 cm且核分裂相数目小于5/50 HPF为低度恶性;(3)肿瘤直径5~10 cm且核分裂相数目小于5/50 HPF或直径小于5 cm核分裂相为(6~10)/50 HPF为中度恶性;(4)直径大于5 cm且核分裂相大于5/50 HPF或直径大于10 cm或核分裂相大于10/50 HPF为高度恶性,也有肿瘤较小却发生转移的相关报道。
本例患者肿瘤原发灶介于2~5 cm,病理报告显示核分裂相大于5/50 HPF,考虑是中度恶性的GIST伴肝转移,但患者年仅28 岁,而40 岁以下的患者少见,因此这一病例非常罕见,经过病史询问发现有烟酒等不良嗜好,且因工作需要时常昼夜节律颠倒,饮食作息习惯均较差,暴露因素极多,虽然家族史无异常,父母体健,家族中亦无相似患病史,但不能排除遗传性癌症易感综合征的可能,嘱患者定期随访监测。
2.2 临床表现 GIST的常见临床表现与肿瘤的大小、部位、与肠壁的位置关系及肿瘤的恶性程度有关,包括上腹部疼痛不适、腹部包块、个别患者出现呕血便血,肠道的梗阻甚至穿孔,多为其首次表现的临床症状,一旦出现往往说明肿瘤侵犯较广,无特异性临床表现[10]。因为肿瘤较小,病程时间短,危险度较低,患者大多不能意识到疾病的发生。即使出现了远处转移,如肝脏转移,可能依旧缺乏确切的临床症状。本例患者即为体检发现的小肠区不规则肿块和肝脏占位。因而GIST伴肝转移的术前诊断和鉴别诊断往往较为困难,依赖术后病理。
2.3 诊断 因为本病的临床表现和影像学检查都缺乏特异性,诊断主要依靠病理组织学和免疫组化检查。虽无特异性,但CT检查有一定的帮助[11],可表现为肠壁增厚,肠管重叠等[4]。本例患者采用了增强CT来进一步区分显现小肠区域的团块,对原发病灶的揭示起到了关键作用。CT检查也可以对小肠间质瘤的良恶性分期起到一定的提示作用,如果肿块较大,增强CT显示呈不均匀强化或肿块内有明显的坏死或液化表现的,以及显示周围器官侵犯,远处转移的,则可考虑为恶性GIST。如果出现肝脏转移,增强CT可以显示出较为典型的影像学表现,如“牛眼征”“环形强化”等。近年来64位螺旋CT的应用,可以搜集获得各向同性的影像信息,以便于多平面重建(MPR),从而确定肿瘤形态及生长特点,便于判断与肠道黏膜的位置关系,观察周围血管侵犯和脏器压迫,了解GIST的定位。同时64位螺旋CT以其薄层快速扫描的技术特点,可以清晰稳定地获得CTA的图像。根据寻航等[12]的研究,准确可靠的CTA可以显示肿瘤的血供特点,从而帮助GIST的定位和定性诊断,为后面的手术治疗奠定基础。对于本病例而言,考虑到肝脏占位,怀疑肝脏转移性恶性肿瘤,在不能判定小肠原发灶的前提下,可以行肝脏B超,以明确其病变的性质。如果多次影像学检查阴性,而症状明显,可行CT引导下肝脏穿刺以明确肝脏病变。
内镜活检病理依旧是小肠间质瘤常规诊断的金标准,纤维小肠镜和双气囊小肠镜是目前广泛应用的小肠肿瘤诊断工具。镜下可表现为不同类别的肿块,带蒂或者不带蒂,有时可与黏膜面的溃疡相通。生长的形式可分为三型:黏膜下型(腔内型):向腔内生长;肌壁间型(哑铃型):向腔内外同时生长;浆膜下型(腔外型):向浆膜层生长。取活检后的病理切片可见肿瘤细胞多为不同形态的梭形细胞,可呈编织状排列,亦可无明显排列结构,混杂有片状或者灶状的上皮样细胞。某些GIST患者可表现为细胞稀少而胶原细胞偏多,周围血管玻璃样变或黏液样变。不仅形态,GIST免疫学表型也与Cajal间质细胞相似,CD117、DOG1和CD34等免疫学指标大多呈阳性,而S-100阴性可排除神经源性,GFAP阴性可排除胶质瘤,都对GIST的鉴别诊断起到了重要的帮助。同时Ki-67增殖指数越高,代表肿瘤的恶性程度越高。
一般而言,在术前病理明确的基础上,术后病理可以更好地验证术前的判断,并为接下来的治疗做好准备。本例患者术前没有取肝脏的活检,因此术后病理的意义更多地在于明确肝脏肿瘤的性质,从另一个角度佐证小肠间质瘤的诊断。
2.4 治疗 手术治疗是GIST伴肝转移的传统而有效的首选治疗方法,肿瘤的完整切除是保障患者生存时间的重要前提[13]。在以伊马替尼为代表的c-kit和PDGFR-α基因特异性受体为靶点的酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)上市后,手术联合伊马替尼辅助治疗的综合性方案获得了广泛的认可。射频消融和介入治疗在治疗GIST肝转移时也有一定的适用性[14]。
根据Seesing等[5]的报道,48 例GIST伴肝转移的患者在接受了术前术后的TKI治疗后,中位生存时间达到90 个月,1 年生存率为93%,3 年生存率为80%,5 年生存率为76%。进行的多因素分析显示R0切除是影响预后的唯一独立因素,也有报道GIST伴肝转移,不行手术的生存时间仅为19 个月,无疑表明手术质量在TKI广泛应用后依然是影响患者预后的决定性要素。但伊马替尼的意义也不容忽视,如果不使用TKI药物,GIST伴肝转移的患者的5 年生存率仅30%。而在Seesing等[5]的研究中,在使用了TKI有效的患者中,5 年生存率达到了95%。但如果拒绝手术,仅口服伊马替尼对GIST伴肝转移患者进行治疗,不仅生存期达不到预期,仅为48 个月,还有较大的可能短期内出现耐药。因而目前针对小肠间质瘤肝转移的患者的治疗还是以手术结合靶向药为主。
2.4.1 手术治疗:因为缺乏足够的循证医学依据,目前GIST合并肝转移的手术治疗尚未形成统一标准。通行的经验为,小肠段的肿瘤依据其位置和分级决定具体的手术方式,同其他实体瘤的切除原则相同,应完整切除瘤体及其转移或浸润的组织,由于壁内浸润常较有限,不需要进行扩大解剖切除,以部分切除或楔形切除获取阴性切缘是指南推荐的切除手段,切缘距肿瘤1 cm左右即可[15]。小肠间质瘤有两个特点,其一是GIST往往只有一层极薄的包膜,甚至无包膜,手术极易破溃,所以应极力避免挤压造成播散转移[16]。切除的标本亦应包在塑料袋内移出体外以避免肿瘤溢出及再种植在切口部位。其二是GIST的淋巴转移极少(琥珀酸脱氢酶复合物功能失活者除外),清扫并非手术重点,通常不必行广泛的淋巴结清扫或扩大根治术。
对于肝脏转移灶的手术原则尚无定论,一般的经验为:在保证残肝足以供给生命需求的前提下,只要患者基本情况良好,能够耐受手术,就应该积极切除肝脏转移灶。术前通过Child分级,吲哚菁绿代谢实验,肝脏残留体积测定等方法来推测肝脏储备功能,预估切除大小。Ferrero等[17]认为在排除肝脏损害的前提下,保留残肝在标准肝体积的25%以上都可保证生命需求。此次病例切除了左半肝,约占肝脏的35%,且患者术前无病毒性肝炎史或肝脏手术史,术前肝功能正常,术后肝功能保存完好。
尽管超过一半的GIST可以完整切除,但如果GIST肝脏转移灶过大,首次手术难以完整切除,或者切除范围过大,影响术后肝功能的恢复,则可考虑先行口服伊马替尼以使肿瘤降期,从而减少术后并发症,提高完整切除率。对于特定的患者,门静脉栓塞术(PVE)和肝实质离断联合门静脉结扎二步法肝切除(ALPPS)可以有效使残留一侧的肝脏细胞增生,从而增大残肝体积,保护残肝功能[18]。
当肝脏转移灶难以切除时,可以考虑肝脏移植手术。肝脏的减瘤手术则有一定的争议,在此不做讨论。
2.4.2 射频消融:主要用于小于3 cm的肝脏肿瘤,通过局部热作用达到毁损肿瘤的目的,对GIST肝转移的患者也有一定的治疗价值。在多个临床试验中,发现联合使用TKI和射频消融使患者的中位生存期达到90 个月,5 年生存率达到100%,可见对于较小的肝脏转移灶,射频消融一样可以起到根治的效果[19-20]。
2.4.3 介入治疗:如果传统治疗方法失败,对于重症肝转移瘤患者,经动脉栓塞化疗治疗(TACE)将成为一种选择。尽管传统认为GIST对化疗并不敏感
[9],但TACE或可在一定程度上延长患者的生存期。
2.4.4 药物治疗:一代TKI伊马替尼和二代TKI舒尼替尼的应用已经成为GIST肝转移患者术前术后的治疗准则。对于手术可以顺利切除且不会引起并发症的GIST患者,术前可以不必服用伊马替尼。因为切除范围过大可能引起较多后遗症的患者,术前口服伊马替尼400 mg BID可以起到使肿瘤降期的作用,从而有效减少术后并发症。但如果应用过程中发生不耐受,产生了严重的副反应,则可考虑换用舒尼替尼。同时,资料显示,伊马替尼口服至少需要6 个月才能发挥最大疗效,因而推荐尽量延长服用时间,可在即将要开始手术前再停药,并在术后患者能耐受口服伊马替尼的前提下立即恢复使用。舒尼替尼则需停药1 周方可手术,术后需在经过仔细评估后方能恢复使用。考虑到TKI药物可能出现的耐药情况,以及确保患者对药物的敏感性,事先进行基因检测是一个值得推荐的方案。术后新辅助治疗应参照术前情况,如果术前应用过TKI,则应酌情恢复,否则应根据病理情况,低危患者可以不使用,而中高危患者,伴有显著复发风险者,则鼓励使用。之后应3~6 个月复查一次,高危患者须3 个月复查一次,推荐每年进行至少一次影像学检查。
如果GIST难以切除,或出现复发和转移迹象,例如本例肝转移患者,则应首先应用TKI药物确保病情平稳,评估能否进行手术,并了解患者的依从性。若无法进行手术,则应继续采用新辅助治疗进行保守治疗。使用原则同上述的可能引起严重并发症的一般切除。如果难以切除或复发转移的GIST病程中出现了恶化,如仅为局部进展,应在继续采用新辅助治疗的基础上可以考虑手术、消融及介入,也可以依据耐受情况增加伊马替尼的用量。如果是全身广泛的进展表现,则应酌情增加伊马替尼的用量,或是换用舒尼替尼,如果舒尼替尼应用后依旧出现进展表现,则换用瑞格非尼并积极进行影像学评估。
值得一提的是,TKI药物的疗效与c-kit和PDGFR-α基因特定区域有无突变密切相关。KIT外显子9突变患者对伊马替尼敏感度较差,而外显子11突变患者则较敏感。伊马替尼对PDGFR-α突变患者大多能起到较好的效果,但需要指出的是,外显子18 D842V突变患者对伊马替尼耐药。在新药Avapritinib上市前,临床对18 D842V突变患者基本束手无策,但最新的NCCN指南推荐Avapritinib可以有效治疗此类患者。但TKI药物容易出现耐药,这与c-kit及PDGFR-α中产生了伊马替尼耐药突变有关。现有的解决办法为换用其他TKI药物,例如改用第二代舒尼替尼。也有极少数患者c-kit及PDGFR-α突变阴性,与琥珀酸脱氢酶复合物功能失活有关。此类患者对TKI药物不敏感,但可采取尝试性治疗[21]。
2.5 预后 即使已经完成了首次完整切除,小肠间质瘤依旧非常容易在2 年内出现腹腔内的局部复发和远处转移,有报道称,18 个月的随访结束后,90%的患者出现了复发和转移。有研究认为,复发前间隔5 年以上的肝转移患者预后好于复发时间小于5 年的患者。远期预后的评估有赖于术后病理提供的核分裂相、肿瘤大小以评估危险度,以及术前有无出现组织侵犯和远处转移,患者的年龄,服用TKI药物的依从性以及基因决定的药物敏感性和疗效都会直接影响预后[22]。临床工作者主要参与的,是强调术中的R0切除,完整剥离肿瘤和侵犯转移组织,以及针对患者的药物敏感情况,选用合适的TKI,对于肝转移的中高危患者,应保持随访,及时复查,定期进行影像学检查。对于复发病例的处理,现在存有一定的争议,常规认为不宜进行二次手术,而是应长期服用TKI药物保守治疗。但Kawamura等[23]开展的研究认为,各基因突变型患者均能从二次手术中受益。因此,有待进一步的临床研究来阐明GIST的预后情况及应对之策。
综上,GIST伴肝转移的患者,在术前病理清晰明确,高度怀疑的前提下,密切关注患者的基因突变情况,并依据患者的年龄,耐受及敏感情况,依从性和经济水平,一般情况和营养水平,选用合适的TKI药物,酌情在术前及术后应用,以此为基础,积极地开展手术切除。同时应重视患者术后的恢复情况,记录患者的病程并敦促其及时的复查和摄片以排除复发和转移。GIST伴肝转移在常规治疗上并不复杂,但许多细节上也提出了一系列的挑战,只有做到每个环节的细致入微,才能真正为患者谋福祉,切实改善患者预后。
