精元康胶囊治疗脾肾亏虚型癌因性疲乏的临床研究
2021-06-11孙宏新申俊丽孙民朋段启孟亚奇
孙宏新, 申俊丽, 孙民朋, 段启, 孟亚奇
1.河南中医药大学第一附属医院,河南 郑州 450000;2.河南中医药大学,河南 郑州 450046
恶性肿瘤现已成为严重威胁人类健康的疾病,癌因性疲乏(Cancer-Related Fatigue,CRF)成为肿瘤患者生活质量下降的主要原因之一[1]。研究显示,在接受化疗、放疗及生物治疗的癌症患者中,约58%至90%的患者出现乏力,晚期癌症患者的疲劳患病率从51%至89%不等[2]。CRF通常伴有乏力、精神和睡眠障碍,常导致患者社交、认知和职业能力的下降,持续时间较长,影响患者的生存质量[3]。
目前,社会心理干预、体育运动、营养支持等疗法经常被用来改善CRF患者症状,但其整体疗效却并不理想[4-7]。精元康胶囊是我们基于中医经典理论,并结合临床实践研制出的复方,属于正规医院制剂。前期研究发现[8-11],精元康胶囊从骨髓有核细胞、骨髓造血细胞生成率、造血微环境等方面改善化疗所致骨髓抑制,具有潜在改善癌因性疲乏症状及提高患者生活质量的疗效。
基于此,本研究拟通过随机对照试验来验证精元康胶囊缓解CRF患者的临床疗效并初步探讨其作用机制。
1 资料与方法
1.1 研究对象 收集2019年1月至2019年12月在河南省中医院、河南中医药大学第一附属医院、河南中医药大学第三附属医院肿瘤科门诊就诊且符合纳入标准的患者100例。研究对象进入试验前均签署知情同意书,本研究通过河南省中医院伦理委员会审查。
1.2 筛选标准
1.2.1 西医诊断标准 (1)恶性肿瘤诊断标准①参考《临床诊疗指南·肿瘤分册》[12]中的标准确诊为肿瘤患者,或病理学明确诊断为肿瘤患者;②按国际抗癌联盟(UICC)的TNM分期标准,经病理学诊断为ⅢB期-Ⅳ期的恶性肿瘤患者。(2)CRF诊断标准 参照国际疾病分类(ICD-l0)应用指导手册中的诊断标准[13]。CRF是主观感觉疲劳异常严重,这种疲乏不适症状每次发作持续时间超过2周,且在近1月反复发作,活动或休息不明显缓解。除了具备以上条件,并且出现以下的至少5个不适症状:①主观感觉身体非常虚弱,周身乏力;②做事无法集中精神;③没有激情或有强烈的失落感,无精打采;④轻度或严重睡眠障碍;⑤即使通过休息、甚至睡眠方式,乏力仍不能缓解;⑥无法正常活动或活动能力受限;⑦容易出现悲伤、愤怒、焦躁、受挫感明显等不良情绪;⑧对于先前能够正常进行的日常活动,完成能力下降;⑨在短时间内,记忆力迅速下降、减退,甚至丧失;⑩活动后疲乏加重,但休息后疲乏症状仍持续甚至几个小时都不能减轻。
1.2.2 中医证候诊断标准(脾肾亏虚型) 标准制定严格参考《中药新药临床研究指导原则》[14](2002版)、“十三五”规划本科教材《中医诊断学》及专家意见进行脾肾亏虚辨证。拟定癌因性疲乏症状分级量化表,纳入疲倦乏力、头晕、心悸少寐、恶心呕吐、食欲减退、夜尿频次、腰膝酸软、梦多易醒、癌痛、唇甲无华、面色苍白或萎黄、舌淡,苔薄白,脉细无力为主症;耳鸣、盗汗、四肢发麻、大便异常为次症。主证2项,加次证1项;或主证1项,加次证2项,即可诊断。主证按无、轻、中、重分别给与0、3、6、9分,次症同样分为四个级别分别给与0、2、4、6分,所有条目相加之和为中医证候积分。由两位副主任医师以上级别的医师判定后,方可入组。
1.2.3 纳入标准 ①按国际抗癌联盟(UICC)的TNM分期标准,经病理学诊断为ⅢB期-Ⅳ期的恶性肿瘤患者;②符合国际疾病分类(ICD-l0)应用指导手册中CRF诊断标准;③符合中医临床辨证为脾肾亏虚证型患者;④年龄18~80岁,预期生存期超过3个月;⑤KPS评分≥60分;⑥近1月未行化疗、放疗治疗的患者;⑦无精神类疾病,神志清楚,能够理解知情同意书内容,表达清晰,自愿参加此次研究。
1.2.4 排除标准 ①已知对本研究使用药物过敏者;②妊娠期、哺乳期妇女,以及有受孕可能未使用避孕措施者;③同时采用同类受试药物或正在接受其他药物临床试验者;④有严重的心、脑、肝、肾等器质病变,造血功能障碍者;⑤明显吞咽困难、进食梗阻、肠道梗阻及严重感染者。
1.2.5 脱落标准 ①因患者自身原因未按时、按疗程用药,不能判定疗效者,或重要指标资料缺乏而影响疗效判定者;②用药过程出现不能预料且比较严重的其他并发病者;③中途放弃治疗,自愿退出者。
1.2.6 终止试验标准 ①出现无法耐受的严重不良反应而终止的病例,同时进行详细记录。②因病情进展,需要住院治疗的患者。
1.3 样本量估算及分组方法
(1)样本量计算:根据前期临床观察健脾益肾颗粒有效率为50%,临床观察精元康胶囊预计有效率预计为86.7%,规定α=0.05(单侧检验),β=0.10(单侧检验),p2为历史对照的总体率,p1为试验结果的总体率,p1≠p2,令 p=(p1+p2)/2,根据两样本率比较所需样本含量计算公式[13]
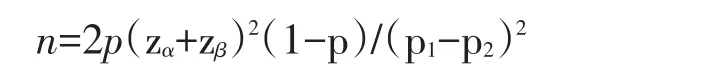
该试验:p2=0.50,p1=0.867,p=(0.867+0.70)/2=0.7835,令单侧界值 zα=1.645,单侧界值 zβ=1.282,代入上述公式得出n=45,脱落率按照10%计算,则样本量为50例,观察组、对照组各50例,共需纳入样本数为100例。
(2)完全随机分组方法由SPSS 21.0软件完成。以前瞻性的随机对照法进行临床研究。采用SPSS 21.0软件中“随机数字生成器”产生随机分配结果。将随机分配结果制成随机卡片,装入不透光的信封并在信封上编上序号备用。研究人员按其初次就诊先后顺序对应提前设计好的随机信封序号,拆开信封,取出随机卡,按随机卡分组进行用药。将符合纳排标准的病例按上述方法分为观察组及对照组各50例。
1.4 治疗方法
观察组:口服精元康胶囊(精元康胶囊组成:熟地、淫羊藿、山药、女贞子、人参、黄芪、当归、鸡血藤、砂仁、甘草、生姜、大枣等。规格:0.5 g/粒,河南省中医药研究院制剂室提供,批准文号:豫药制字Z05010636,批号:160302)。服药方法:从初次就诊开始第1天口服至第60天,4粒/次,tid,30天为1个周期。对照组:口服健脾益肾颗粒(健脾益肾颗粒组成:党参、枸杞子、女贞子、白术、菟丝子、盐补骨脂。规格:30 g/袋,10袋/盒,生产企业:重庆希尔安药业有限公司,批准文号:国药准字Z10983006)。服药方法:从初次就诊开始第1天口服至第60天,30 g/次,bid,30天为1个周期。(注:两组患者均从初次就诊开始口服药物,30天为1周期,连续观察2周期。治疗前后进行安全性指标和不良事件评估,直至疾病进展或出现不良反应不能耐受为止。两组患者基础治疗一致,均不使用放化疗、以及和观察药物近似影响疗效判定的药物。)
1.5 疗效评价
1.5.1 疲乏状况评估 采用Piper疲乏自评量表修订版(Revised Piper’s Fatigue Scale,RPFS)[15,16]对患者的疲乏状况进行评价。此表包括22个纳入评分的条目和5个不纳入评分的开放性问题,分为4个维度进行评价疲乏程度。其中行为维度包括3~8条共6个条目,情感维度包括9~13条共5个条目,感觉维度包括14~18条共5个条目,认知维度包括19~24条共6个条目。每个条目评分0~10分,分数越高,疲乏症状越严重。总量表及每个维度评分等于各项所属条目分数平均分。同样,所得分值越高,CRF程度越严重。根据得分情况,把CRF分为轻、中、重三个等级,评分分别为0~3分、4~6分、7~10分。
1.5.2 生活质量评估 采用卡氏评分(Karnofsky Performance Status,KPS)评价生活质量。该量表分为100分~0分,共11个等级,分数从髙到低,生存质量逐渐降低。疗效评定:显效:KPS治疗后较治疗前上升≥20分;有效:10分≤KPS上升<20分;稳定:0分<KPS上升<10分;无效:KPS不升或下降≥10分。
1.5.3 中医证候疗效评估 采用中医症状与体征记分标准表记录两组病例中医临床症状、体征的改善情况。记录两组患者治疗前后中医证候积分,并进行评价。疗效评定标准:临床痊愈:临床无不适症状或稍有不适感,证候积分减少90%~100%;显效:症状大部分减轻,仍有不适,证候积分减少70%~90%;有效:症状、体征都有所减轻,证候积分减少30%~70%;无效:临床表现无任何减轻,甚至加重,证候积分减少<30%。计算公式(尼莫地平法):(治疗前证候积分-治疗后证候积分)/治疗前积分×100%。
1.5.4 血清免疫学评估 记录两组治疗前后外周血中各T淋巴细胞亚群,主要为总T成熟细胞(CD3+)、T辅助细胞(CD4+),T抑制细胞(CD8+)、T辅助细胞与T抑制细胞的比值(CD4+/CD8+)。治疗前后进行组内和组间比较评价疗效。
1.5.5 血清炎性因子评估 记录两组治疗前后外周血中肿瘤坏死因子-α(TNF-α)、白介素6(IL-6)。对治疗前后进行组内和组间比较评价疗效。
1.5.6 安全性评价 根据治疗前后血常规、肝功能、肾功能指标,对安全性进行评价,观察并记录各项不良事件。
1.6 统计分析
采用SPSS21.0统计软件进行数据分析,计数资料采用χ2检验,计量资料符合正态分布用t检验,不符合正态分布用秩和检验,等级资料比较采用秩和检验。P>0.05表示差异无统计学意义,P<0.05表示有差异统计学意义。
2 结果
2.1 一般资料
观察组治疗期间1例受试者中途退出,2例受试者服用影响疗效判定的药物,共纳入47例;对照组中2例患者服用其他影响疗效评价中药,1例资料收集不完整,缺乏重要指标,2例因出现其他症状住院治疗,入组45例。本研究最终纳入92例受试者。观察组中男26例、女21例,肺癌25例、胃癌12例、结直肠癌10例,Ⅲ期24例、Ⅳ期23例,年龄分布37~80岁;对照组中男24例、女21例,肺癌24例、胃癌12例、结直肠癌9例,Ⅲ期23例,Ⅳ期22例,年龄分布36~80岁。两组在年龄、性别、癌种分布及临床分期方面差异无统计学意义(P>0.05),两组基线均衡可比。
2.2 两组疲乏状况
观察组治疗后疲乏总分、行为、情感、感觉、认知维度,评分均较治疗前明显下降(P<0.01)。对照组治疗后较治疗前疲乏总分、行为、感觉、认知评分明显下降(P<0.01)。治疗后与对照组比较,观察组疲乏总分、行为、感觉维度评分认知评分改善情况优于对照组(P<0.01)。见表1。
表1 两组治疗前后Piper疲乏量表分评分(±s,分)Table 1 Changes in Piper scores between two groups after treatment
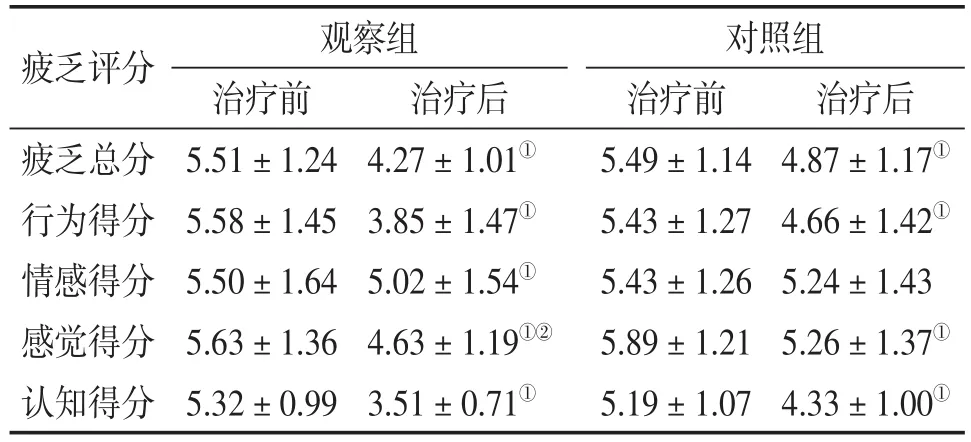
表1 两组治疗前后Piper疲乏量表分评分(±s,分)Table 1 Changes in Piper scores between two groups after treatment
注:与本组治疗前比较,①P<0.01;与对照组治疗后比较,②P<0.05。
治疗后4.87±1.17①4.66±1.42①5.24±1.43 5.26±1.37①4.33±1.00①疲乏评分疲乏总分行为得分情感得分感觉得分认知得分观察组治疗前5.51±1.24 5.58±1.45 5.50±1.64 5.63±1.36 5.32±0.99治疗后4.27±1.01①3.85±1.47①5.02±1.54①4.63± 1.19①②3.51±0.71①对照组治疗前5.49±1.14 5.43±1.27 5.43±1.26 5.89±1.21 5.19±1.07
2.3 生活质量
与本组治疗前相比,对照组(P<0.05)与观察组(P<0.01)患者均较治疗前KPS评分增高。治疗后观察组KPS评分提高程度高于对照组(P<0.01),见表2。
表2 两组治疗前后KPS评分比较(±s,分)Table 2 Changes in KPS scores between two groups after treatment

表2 两组治疗前后KPS评分比较(±s,分)Table 2 Changes in KPS scores between two groups after treatment
注:与本组治疗前比较,①P<0.01;与对照组治疗后比较,②P<0.01。
治疗后84.26± 12.11①②77.56±11.51①分组观察组对照组例数47 45 KPS评分治疗前70.21±8.467 68.89±7.752
2.4 中医证候积分
2.4.1 证候积分 与本组治疗前比较,两组患者中医证候积分均明显下降(P<0.01)。治疗后观察组中医证候总分改善情况优于对照组(P<0.05),见表3。
表3 两组治疗前后中医证候积分比较(±s,分)Table 3 Changes in Traditional Chinese Medicine(TCM)syndrome scores between two groups after treatment

表3 两组治疗前后中医证候积分比较(±s,分)Table 3 Changes in Traditional Chinese Medicine(TCM)syndrome scores between two groups after treatment
注:与本组治疗前比较,①P<0.01;与对照组治疗后比较,②P<0.05。
治疗后56.88± 10.39①②64.78±13.97①分组观察组对照组例数47 45中医证候积分治疗前80.89±12.99 75.96±10.84
2.4.2 证候积分疗效 观察组47例中显效12例、有效28例、无效7例,有效率85%;对照组45例中显效7例、有效15例、无效23例,有效率49%。观察组有效率明显高于对照组(P<0.01)。见表4。

表4 两组中医证候疗效比较Table 4 Overall efficacy of TCM syndrome scores between two groups
2.5 血清免疫学 与本组治疗前比较,对照组CD3+、CD4+及CD4+/CD8+比值上升(P<0.05);观察组 CD3+、CD4+值显著上升(P<0.01),CD4+/CD8+比值上升(P<0.05),CD8+水平较前显著下降(P<0.01)。治疗后与对照组比较,观察组患者CD3+、CD4+及CD4+/CD8+水平均高于对照组(P<0.05),CD8+水平低于对照组(P<0.05),见表5。
表5 两组治疗前后免疫学指标比较(±s)Table 5 Changes in immunological indicators between two groups

表5 两组治疗前后免疫学指标比较(±s)Table 5 Changes in immunological indicators between two groups
注:与本组治疗前比较,①P<0.05;与对照组治疗后比较,②P<0.05。
治疗后68.33±7.11①35.16±9.12①26.18±6.84 1.68±0.93①T细胞亚群CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+观察组治疗前68.62±8.73 37.88±7.60 28.44±5.48 1.41±0.45治疗后70.09±9.48②42.49±7.86②24.34±5.23 1.73±0.51①②对照组治疗前65.66±8.62 33.76±6.68 27.62±5.18 1.52±0.67
2.6 血清炎性因子 与本组治疗前比较,对照组患者(P<0.05)与观察组患者(P<0.01)TNF-α、IL-6水平均降低。治疗后与对照组比较,观察组TNF-α和IL-6水平低于对照组(P<0.05),见表6。
表6 两组治疗前后患者炎症介质指标疗效比较(±s)Table 6 Changes in inflammation indicators between two groups

表6 两组治疗前后患者炎症介质指标疗效比较(±s)Table 6 Changes in inflammation indicators between two groups
注:与本组治疗前比较,①P<0.05;与对照组治疗后比较,②P<0.05。
组别治疗后24.81±14.48②25.62±13.75①观察组对照组TNF-α(pg/mL)治疗前23.35±10.31 22.73±11.33治疗后18.44±9.66②19.86±10.66①IL-6(pg/mL)治疗前36.50±13.42 32.70±11.95
2.7 安全性
2.7.1 血常规评价 与本组治疗前比较,观察组Hb较治疗前明显上升(P<0.01),WBC平均水平较前稍有增高(P<0.05);对照组中Hb较前上升(P<0.05)。治疗后与对照组比较,观察组Hb平均水平增高更多(P<0.05),见表7。
表7 两组治疗前后血常规比较(±s)Table 7 Plasma WBC,Hb and PLT between two groups of patients

表7 两组治疗前后血常规比较(±s)Table 7 Plasma WBC,Hb and PLT between two groups of patients
注:与本组治疗前比较,①P<0.05;与对照组治疗后比较,②P<0.05。
PLT(×109/L)158.96±41.14 154.28±38.76 163.38±41.87 164.27±37.14组别观察组对照组时间治疗前治疗后治疗前治疗后WBC(×109/L)5.23±1.09 5.52±0.82①5.05±1.05 5.26±0.82 Hb(g/L)117.06±13.50 123.34±8.27②115.42±12.85 119.51±9.16①
2.7.2 肝、肾功能评价 两组患者治疗前ALT、AST、BUN、Cr平均水平差异无统计学意义(P>0.05)。治疗后两组患者ALT、AST、BUN、Cr较治疗前无明显差异(P>0.05),见表8。
表8 两组治疗前后患者肝、肾功能比较(±s)Table 8 Plasma ALT,AST,BUN and Cr between two groups of patients
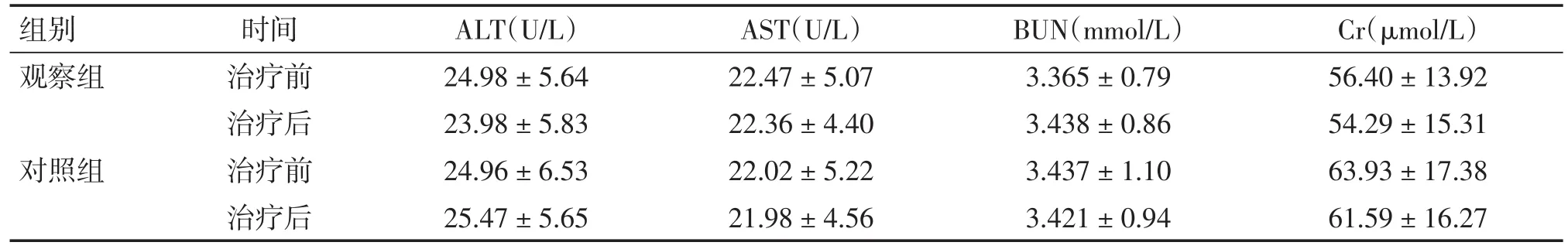
表8 两组治疗前后患者肝、肾功能比较(±s)Table 8 Plasma ALT,AST,BUN and Cr between two groups of patients
组别观察组对照组时间治疗前治疗后治疗前治疗后ALT(U/L)24.98±5.64 23.98±5.83 24.96±6.53 25.47±5.65 AST(U/L)22.47±5.07 22.36±4.40 22.02±5.22 21.98±4.56 BUN(mmol/L)3.365±0.79 3.438±0.86 3.437±1.10 3.421±0.94 Cr(μmol/L)56.40±13.92 54.29±15.31 63.93±17.38 61.59±16.27
3 讨论
CRF是恶性肿瘤患者常见的症状之一,严重影响着患者的生活质量。目前,CRF发病机制复杂,仍不完全清楚,可能是由多种因素造成的[17]。CRF发病与肿瘤生长密切相关,同时肿瘤的相关治疗如化疗、放疗等也可引起CRF的发生。目前相关研究表明,CRF发病机制可能与促炎性细胞因子、HPA轴失调、昼夜节律失调、骨骼肌萎缩和遗传失调相关[18-23]。研究表明肿瘤引起的癌性贫血、疼痛、睡眠障碍、抑郁症状与炎症细胞因子参与有关[24-26]。其中,IL-6、IL-1β、TNF-α等细胞因子浓度的变化,与疼痛、抑郁以及疲乏相关[27]。肿瘤原发病灶可释放炎症因子,如IL-2,IL-6,TNF-α等引起肿瘤自身的增长、转移,同时这些炎症因子能够使体内5-羟色胺、皮质醇的分泌水平发生异常,从而使生物节律发生改变,导致患者自身免疫力下降,出现周身乏力、嗜睡或失眠症状[8]。
“阳化气,阴成形”理论贯穿了肿瘤发生、发展及肿瘤治疗的整个过程。《灵枢·百病始生》曰:“积之始生,得寒乃生”,肿瘤的发生不外乎痰、瘀、毒病理产物,其根本原因是体内阳气不足,阳虚不能生化,体内气血津液代谢失常形成病理产物积聚形成。癌因性疲乏属于中医“虚劳”病范畴,“邪之所凑,其气必虚”。因此在肿瘤的治疗中,应当遵循“善补阳者,必于阴中求阳”原则,在治疗过程中在补阴药中加入少量补阳药以“少火生气”,调整机体阳气,达到“化气”消阴体之瘤。
精元康胶囊以熟地、淫羊藿为君药,淫羊藿性温善补肾阳,与熟地纯阴之品配伍能达到“阴中求阳”疗效。山药补益脾阴,兼能固精。此外,精元康胶囊中人参与熟地配伍气血双补、阴阳兼顾。当归为血中圣药,配伍鸡血藤补血活血;砂仁醒脾化湿,理气和胃,全方共奏补脾益气、强脾壮肾、调和脏腑阴阳之效。精元康胶囊前期大量的基础实验研究及临床研究,均显示精元康在改善骨髓抑制及提高患者免疫力、改善临床症状方面均取得了一定的疗效。前期对环磷酰胺导致骨髓抑制小鼠模型研究证实,精元康胶囊可以上调抗凋亡基因Bcl-2的表达,下调促凋亡基因Bax的表达,对骨髓细胞凋亡相关通路产生影响,从而防止造血细胞因化疗药物引起的细胞凋亡[8]。研究发现,精元康能够明显减轻非小细胞肺癌(non-small cell lung cancer,NSCLC)化疗引起的骨髓抑制,能够减轻化疗导致的恶心、呕吐、纳差等胃肠道反应,有效缓解神疲乏力、自汗盗汗、纳呆食少、腹胀腹泻、腰膝酸软等症状,提高生活质量,增加体重[9,10]。艾滋病是一种免疫缺陷性疾病,精元康胶囊可显著减轻艾滋病及HAART疗法导致的骨髓抑制,提高淋巴细胞CD4+水平,从而增强免疫力[28]。基础实验证实精元康胶囊能够使小鼠模型骨髓有核细胞数、胸腺指数、脾脏指数升高,且呈现剂量依赖性[29]。对照药物健脾益肾颗粒的药理研究发现其能够降低肿瘤细胞的增殖能力,同时也能增强NK细胞活性、提高CD4+T细胞数量,改善受损的免疫系统。临床中,健脾益肾颗粒也经常被用来减轻肿瘤患者术后放、化疗副反应,提高机体免疫功能以改善脾肾虚弱所引起的多种疾病[30-33]。
本研究发现精元康胶囊能够改善脾肾亏虚型CRF患者的临床症状,提高KPS评分,降低中医证候积分,改善生活质量,但是对情感维度无明显改善,因此在治疗过程中应及时对患者心理状态变化进行适当疏导。
精元康胶囊可能通过提高CD3+、CD4+及CD4+/CD8+的表达,抑制CD8+的生成,从而提高机体免疫力。同时具有抑制TNF-α、IL-6炎症因子,抑制炎症反应的作用。在造血系统方面,可提升白细胞及改善贫血。这些可能是精元康胶囊治疗CRF的重要机制。
