二次铝灰中氮化铝的特性及其脱除工艺研究进展
2021-06-11张宇李勇李春雷屈毅王毅
张宇, 李勇, 李春雷, 屈毅, 王毅
1.兰州理工大学 石油化工学院,甘肃 兰州 730050;2.中国铝业股份有限公司兰州分公司,甘肃 兰州 730080
据统计,中国在2019年金属铝生产量高达3 504万t[1],而每生产1 t铝就会产生110 kg的铝灰,这意味着中国年产超过350万t的铝灰,加之以往未处理填埋堆存的铝灰,目前中国积存铝灰已愈千万吨。铝灰是铝加工过程中产生的一种危险固体废弃物[2],可分为一次铝灰和二次铝灰(Secondary aluminum dross,SAD)[3]。一次铝灰产生于铝加工过程中(如电解氧化铝),主要成分为金属铝及其氧化物,铝含量占总质量的50%以上。SAD通常是指一次铝灰回收金属铝后的残渣,铝含量占总质量的5%~20%,主要成分为氧化铝、氮化铝(AlN)、尖晶石、其它金属化合物和无机盐[4],呈松散的小颗粒或尘粒状。
铝灰中含有AlN是《国家危险废物名录》(2016)将其列为具有毒性、易燃性的有色金属废物的主要原因之一[5]。AlN的存在不仅使得铝灰在受潮时释放出具有刺激性气味的氨气,还可能出现氨氮(N-NH3)团聚现象,对地下水产生高毒性风险[6]。由于缺乏低成本、规模化、相对成熟的处理工艺,就地填埋和堆积仍是当前SAD的主要处置方法[7]。就地填埋和堆积不仅造成SAD中铝资源的浪费,同时还带来了严重的环境污染问题,因此,SAD的无害化、减量化、资源化处理迫在眉睫,而AlN的脱除、转化成为铝灰无害化处理中一个至关重要的问题。鉴于此,本文介绍了SAD中AlN的来源、存在形式及其危害,重点阐述了AlN在不同条件下的转化机理及影响因素,讨论了SAD中AlN的脱除工艺的特点及优缺点,指出了今后SAD脱氮工艺的研究方向。
1 氮化铝的物理化学特性
AlN是铝加工或一次铝灰高温回收金属铝过程中铝液与氮气接触后的产物[8],在冷却后以不规则的颗粒存在于铝液表面浮渣中,进而被机械或手动收集存留于铝灰中[9,10]。铝灰中AlN的含量因收集深度和收集速度的不同而存在差异,但其生成是不可避免的。
AlN主要以大颗粒块状或针状颗粒单独存在、或与α-Al2O3共存于铝灰中[11]。铝灰中AlN含量与铝灰粒径密切相关[12],一般而言,铝灰粒径越小AlN含量越高,但当粒径小于100 μm时,由于高比表面积,AlN可能被氧化或羟基化形成氧化铝或氢氧化铝,因此AlN主要存在于粒径为100~200 μm的铝灰颗粒中[12]。
AlN的主要晶型为六角纤维状和闪锌矿状,其XRD特征峰分别为35.9°、37.8°、49.8°和38°、44°、65°。这两种晶型都具有较高的反应活性[14],既可以与水反应生成氨气(NH3),还可与酸或碱生成铝盐或氢氧化铝,同时AlN在高温焙烧的条件下可以氧化生成α-Al2O3。反应吉布斯自由能随温度的变化如图1所示,从图1可以看出Al与N2生成AlN在常温下就可自发进行,因此SAD中AlN的生成不可避免。在303 K~373 K温度范围内AlN与水、酸或碱的反应均能自发进行,高温下AlN也可向生成α-Al2O3的方向自发进行。
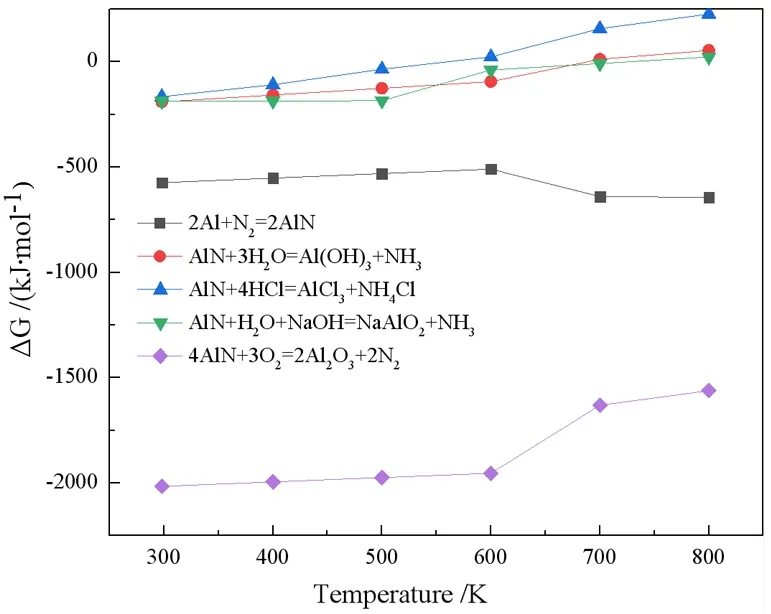
图1 温度对吉布斯自由能的影响
2 氮化铝的水解行为研究
2.1 氮化铝水解机理
SAD中α-Al2O3因稳定的化学性质难以与水反应[15],而相对于Al而言,AlN因大的比表面积而与水的反应性更高[16],因此,研究AlN水解机理就成为SAD无害化处理过程中主要的问题。
在303~373 K范围内,如图1所示,AlN水解反应的吉布斯自由能为-217.54~-194.59 kJ/mol,说明AlN水解在标准条件下可自发进行[17]。AlN的水解是放热的,同时生成了NH4+和OH-[18-20],因此水解环境的温度和pH随着时间的推移而增高。此外,AlN水解动力学模型可用未反应核模型描述[21],即反应过程中AlN的颗粒大小不变,核心不发生反应,但反应的界面不断向核心推进的非催化液固相反应模型。
AlN的水解产物与温度密切相关,相应水解方程式如(1)~(3)[22]:
AlN+3H2O=Al(OH)3+NH3↑(T<351 K)
(1)
AlN+2H2O=AlOOHamorph+NH3↑(T>351 K)
(2)
NH3+H2O↔NH4++OH-
(3)
AlN在温度高于351 K时水解倾向于生成无定型的偏铝酸(一水软铝石,AlOOHamorph),在温度低于351 K时水解倾向于生成Al(OH)3。但SVEDBERG等人[23]发现AlN在温度为85 ℃水解1 h后存在不同比例的AlOOHamorph和Al(OH)3相,这是因为水解产物AlOOHamorph是不稳定的,在一定条件下经过足够长的时间会转化为稳定的Al(OH)3结晶[24]。因此AlN的水解过程可以总结为3个互相依赖的阶段:水解初期(又称培育阶段)、AlOOH的形成和转化阶段(第二阶段)和Al(OH)3的形成和生长阶段(第三阶段)[25]。
在反应初期,AlN表面会生成一层薄的水合氧化铝层,该产物层会阻碍水解反应的进行,因此AlN在水解反应初期存在一个诱导期[21],诱导期随温度的升高而缩短[26],随溶液pH的降低而增加。
以上研究主要集中于AlN粉末和AlN陶瓷的水解行为,但SAD成分复杂,一个或多个组分的出现使得SAD中AlN反应活性更高(水解反应平衡常数K为4.88×1057)。因此,SAD中AlN的水解过程不同于AlN粉末或AlN陶瓷,其不存在诱导期[24],并且水解产物仅存在Al(OH)3相,不存在AlOOH相。
2.2 影响氮化铝水解的因素
AlN的水解行为影响因素主要有水解温度、水解时间、溶液pH及其它因素。
不同条件下铝渣灰中AlN水解后的含量如表1所示[27],从表1可以看出,AlN水解程度与水解温度呈正比关系,随着水解温度的升高,水解速率会加快,水解程度会更高。AlN水解程度与水解时间也呈正比关系,随着水解时间的延长,水解速率逐渐降低,但水解程度会更高。
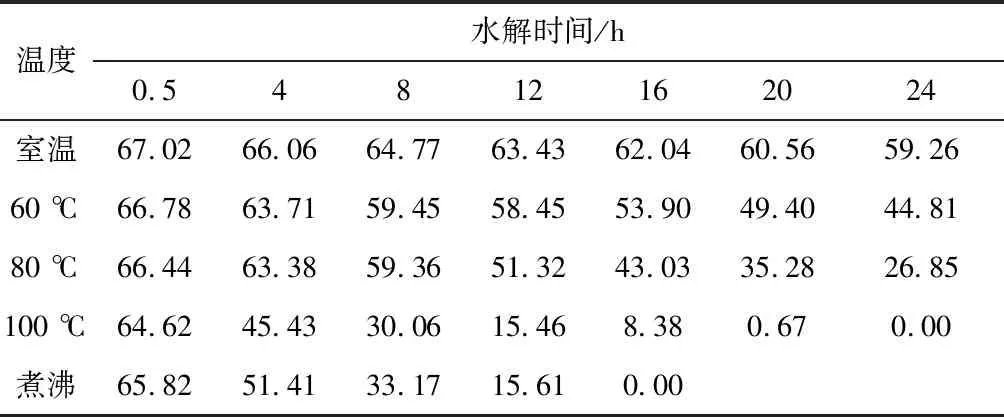
表1 不同条件下铝渣灰中AlN水解后的含量/%
水解影响因素的主次关系依次为水解时间、水解温度[28],因此水解时间越长、水解温度越高,AlN水解程度越大。
AlN水解程度还受到溶液pH的影响,碱性环境中的OH-会加强水解产物粒子的凝胶作用,进而促进AlN水解[29,30];酸性环境中AlN表面会有一层铝盐的覆盖,阻止了水与AlN的接触,进而水解受到抑制[31,32],反应放热温度显著降低,但这一过程中占主导地位的控制机理尚不清楚。
其它因素如粒度、搅拌速度、液固比等对AlN水解程度有一定影响,粒度越小、搅拌速度越快、液固比越小的反应条件对AlN水解有一定程度的促进作用。
3 氮化铝的氧化行为研究
3.1 氮化铝氧化机理
AlN作为一种非氧化物,在600~1 300 ℃有氧的情况下对氧的亲和力极强[33,34],部分氧会固溶入AlN点阵中,从而形成铝空位,能向着生成Al2O3的方向进行[35],进而发生氧化转变为Al2O3。符合下列反应式(4):
4AlN+3O2=2Al2O3+2N2
(4)
在空气中AlN的氧化过程包括先转变为富氧态的AlN,然后再转变为非晶态的Al2O3,再氧化成θ-Al2O3,然后进一步晶型转变生成最终产物α-Al2O3[36],动力学研究表明AlN的氧化反应具有较小的活化能和较大的指前因子,因此具有较大的反应速率,氧化温度越高,时间越短。在氧化初期存在一个短时间的反应控制环节,而后扩散控制成为主要控制环节,因此AlN氧化过程受反应机制和扩散机制交替控制[37]。
AlN的氧化机理[38]如图2a所示,包括:(1)O2分子向AlN颗粒表面的过渡层扩散;(2)O2在AlN颗粒表面的活性位点的吸附;(3)O2和AlN颗粒在表面相互作用;(4)生成的N2从固体表面脱附,生成的α-Al2O3覆盖在固体表面;(5)生成的N2向大气中扩散。对于AlN氧化模型如图2b所示,其动力学模型也可视为产物层控制未反应核模型,反应过程中AlN的颗粒大小不变,核心不发生反应,但反应的界面不断向核心推进,直至α-Al2O3膜完全覆盖在表面,反应界面无法向内部推进时反应终止。
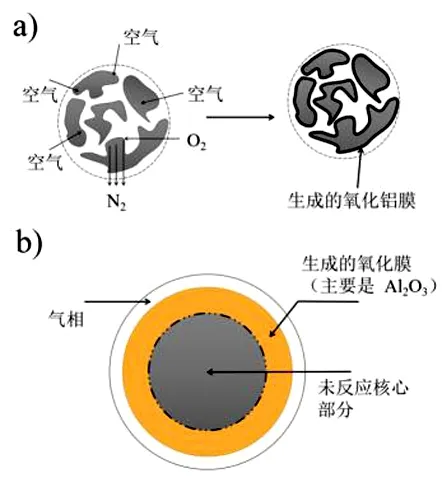
图2 (a)AlN氧化反应机理图;(b)AlN氧化反应模型图
3.2 影响氮化铝氧化的因素
一般认为,影响AlN氧化的因素主要有以下三个:氧化温度、氧化时间、气氛组成。
随着氧化温度的升高,AlN氧化速率加快,AlN表面由AlN和α-Al2O3共存[39]向α-Al2O3方向转变,温度越高,AlN氧化程度越大。
AlN氧化与氧化时间符合抛物线规律,随着氧化时间的推移,AlN氧化速率先增大后减弱,最终氧化停止,氧化时间的延长有一定程度的抑制效果[40]。这也说明AlN氧化主要受扩散机制影响,生成的氧化层一定程度上阻碍了氧化进行。
在氧气浓度较低的情况下,O2的氧化能力有限,AlN没有完全氧化[41],仅在表面形成了氧化薄膜,这层氧化薄膜会阻碍AlN的进一步氧化。
综上所述氧化温度越高,反应氧气浓度越大均有利于AlN的氧化。氧化时间与AlN的氧化程度呈现抛物线关系,为使AlN氧化达到最大程度,选择适宜的氧化时间尤为重要。
4 二次铝灰的除氮工艺
依据AlN的转化行为可将SAD的除氮工艺分为湿法和火法,湿法通过将SAD与过量的溶剂混合,其中的AlN与溶剂反应达到二次铝灰除氮的目的,火法则利用AlN在高温下氧化转变为化学性质稳定的α-Al2O3,达到降低二次铝灰反应性的目的。
4.1 湿法除氮工艺
湿法除氮工艺中使用最广泛的溶剂是工业用水,其特点是利用AlN与水反应后产生的氨气在水中溶解度大的特点实现了SAD的除氮。Berzelius Umwelt—Service AG(B.U.S)公司[42]将预处理过的SAD在80 ℃水中处理2~3 h,过程中产生的气体主要为氢气、氨气、甲烷等,其中氨气溶解在水中,该工艺已建立商业化的处理厂。倪红军等人[43]在温度为30~100 ℃的水中加入SAD粉末和反应剂并进行搅拌、过滤、烘干,最终得到除氮后的残渣。反应后的铝灰渣中的氮元素形成铵盐,并且在整个处理过程中没有氨气的溢出,有效避免了氨气对环境的污染以及对人的伤害。
水作为溶剂虽然有工艺简单、经济性高的优势,但该中性环境中AlN水解程度不高,只有高pH值才能使AlN有效水解,因此,碱性溶剂能大大提高SAD除氮效果。陈湘清等人[44]将铝灰与石灰混合水洗催化脱氨,在石灰投料比为10%、温度为80 ℃条件下反应20 h后残渣中AlN含量降至3%,脱氨过程中释放的气体机械收集后其中氨气体积浓度为12%。付明波等人[45]将铝灰按一定比例与水混合形成料浆,过滤后滤渣和碱液混合,保温搅拌水解,最终残渣中AlN含量为0.52%。
酸性溶剂可以除氮,还可以回收AlN中的Al,实现SAD的Al资源的回收利用。Li等人[46]使用二氧化碳的饱和水溶液进行处理,以吸收生成的氨,弱酸性的H2CO3溶液有助于氨的吸收转化。二氧化碳通气速率为40 mL/min,溶液可达到饱和。在矿浆比为120、温度为291 K条件下反应3 h,AlN转化为NH4HCO3,从溶液中逸出的氨量迅速减少,达到了氨吸收的目的。Amer等人[47]在温度为373 K、浆比0.1的条件下反应5 h,稀硫酸一次浸出除去杂质后,浓硫酸加压浸出将AlN制得硫酸铝和硫酸铵,通过该工艺可以回收88.5%左右的铝和氮作为铵铝矾。
湿法虽然是SAD除氮工艺中最常用的处理方法,处理过程中能避免氨气的释放,但不能避免氢气、甲烷等气体的释放,若这些易燃易爆气体积聚在厂房周围,则会给生产带来严重的安全隐患。因此,为实现除氮工艺过程中无易燃易爆气体的产生,研究者将目光转向火法除氮工艺。
4.2 火法除氮工艺
近年来,火法处理工艺因在焙烧过程中既能将AlN转化为Al2O3及N2,又能将碳化铝转化为Al2O3及CO2、金属铝转化为Al2O3,降低SAD的反应性,又可生产其它高附加值产品,实现SAD的资源化而受到青睐。火法通过添加不同的焙烧剂制备不同产品,例如添加碳酸钠等碱性物质制备偏铝酸钠[48],进而制备净水剂或建筑基材,还可添加特定比例的氧化钙、氧化镁制备钙铝黄长石/镁铝尖晶石复相材料[49]。
田林等人[50]将SAD与碳酸钠质量比11.4、焙烧温度1 000 ℃、焙烧时间2 h条件下浸出制得冶金级Al2O3,浸出渣为一般固体废弃物。Tripathy等人[51]对碳酸钠焙烧铝灰后碱浸回收铝的试验基础上进行改进,碱浸过程中加入2%的NaOH可以回收90%的铝。该工艺降低了所需温度和碱量,实现SAD的低能耗、低成本的无害化工艺。
火法在处理过程中存在着焙烧物在炉中烧结成硬块、尾气成分不明及尘粒扩散等问题,同时能耗极大,因此目前针对火法工艺研究较少。湿法、火法工艺虽都能有效实现SAD的除氮,但均存在不足之处,这必须得到足够的重视。火法-湿法联用是未来处理SAD的有效途径,SAD经过火法处理安全地降低其反应性,再经过湿法浸出回收其中有价金属,实现了SAD的资源化。
5 结语
氮化铝带来的环境污染使得二次铝灰成为危险废弃物,针对二次铝灰的无害化处理就必须解决氮化铝的转化问题。
(1)氮化铝的转化可分为水解反应和氧化反应,二次铝灰中的氮化铝的水解过程不存在诱导期,水解产物仅为氢氧化铝,水解过程受影响的主次因素为水解时间、水解温度,因此选择最佳的水解时间以及水解温度尤为重要。
(2)氮化铝的氧化行为可用未反应核模型描述,该过程受反应机制和扩散机制交替控制,氧化过程受焙烧时间的影响呈抛物线趋势,因此选择适宜的焙烧时间是实现氮化铝完全转化的重要因素。
(3)湿法与火法除氮工艺都可实现铝灰的有效脱氮,但目前工艺还存在缺乏铝灰中氮化铝等相关检测标准、尾气成分及含量不明确、工艺尚不成熟等问题。这些问题在工艺中不可忽视,因此未来研究者应着重关注这些问题,对改善铝灰无害处理的操作环境、提高处理过程的安全性、实现工艺的规模化具有重要意义。
