琥珀酸脱氢酶抑制剂类杀菌剂水生生态毒理学研究进展
2021-06-11敬同坊李同宾李北兴
李 红, 敬同坊, 李同宾, 李北兴,3,4, 慕 卫*,,3,4
(1. 山东农业大学 植物保护学院,山东 泰安 271018;2. 山东省蔬菜病虫生物学重点实验室,山东 泰安 271018;3. 山东省高校农药毒理与应用技术重点实验室,山东 泰安 271018;4. 山东省农药环境毒理研究中心,山东 泰安 271018)
琥珀酸脱氢酶抑制剂类 (succinate dehydrogenase inhibitors,SDHIs) 杀菌剂通过抑制病原菌线粒体呼吸电子传递链上的蛋白复合体II,阻断三羧酸循环和线粒体电子传输系统,干扰菌体的呼吸作用[1-4],从而达到抑菌/杀菌的目的。SDHIs属于广谱性杀菌剂,对作物上的灰霉病、白粉病、霜霉病、锈病及纹枯病等多种病害有良好的防效[5],已成为目前杀菌剂市场的主体类别,是全球各大公司开发的重要目标[6]。目前,该类杀菌剂代表品种氟唑菌酰胺 (fluxapyroxad)、啶酰菌胺(boscalid)、苯并烯氟菌唑 (benzovindiflupyr)、氟唑环菌胺 (sedaxane) 及氟唑菌苯胺 (penflufen)等2016年的销售额已达数亿美元,这些杀菌剂对水稻病害均有一定的防效,其中氟唑菌苯胺已登记用于水稻纹枯病防治,其他药剂也有逐步应用于水稻田的趋势[7]。据国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC) 报道,大部分SDHIs杀菌剂对哺乳动物、鸟类、蜜蜂和蚯蚓等环境生物相对安全,但对水生生物具有较高的毒性[8]。因此随着此类杀菌剂应用范围的扩大和在环境中暴露风险的增加,其对水生生物的毒性效应及毒理学机制研究也受到了广泛的关注。本文拟从SDHIs杀菌剂对水环境的污染状况及其对水生生物的毒性效应出发,就该类杀菌剂的水生生态毒理学研究进展进行综述,以期为加强SDHIs杀菌剂的使用管理,降低其对水生生态系统的风险提供理论依据。
1 SDHIs杀菌剂对水环境的污染状况
SDHIs杀菌剂广泛应用于农业生产,易通过渗透、地表径流、大气漂移等多种途径进入水体,对水环境造成污染。研究表明,在不同地区水体中均可检测到SDHIs杀菌剂 (表1)。
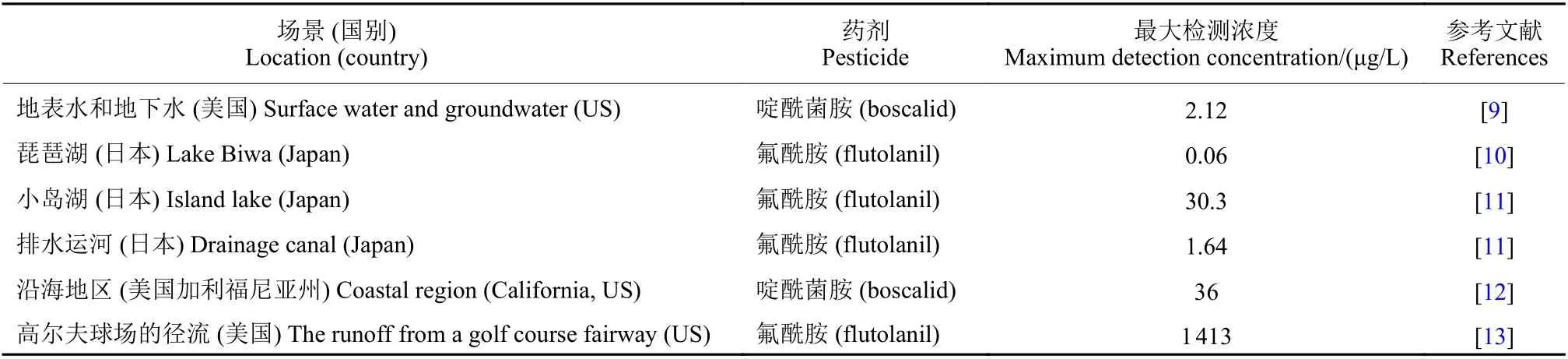
表1 部分SDHIs杀菌剂在不同地区水体中的残留量Table 1 Residues of SDHI fungicides in water bodies of different regions
Moreno-González等[14]调查发现,SDHIs杀菌剂可通过地表水道输入到地中海沿岸潟湖,并且其每年总输入量可占到水道污染物总输入量的70%以上。Gulkowska 等[15]在瑞士格拉特河 (Glatt River) 的地表水和废水中发现了8种SDHIs 杀菌剂:联苯吡菌胺 (bixafen)、啶酰菌胺、氟吡菌酰胺 (fluopyram)、氟酰胺 (flutotanil)、氟唑菌酰胺、吡唑萘菌胺 (isopyrazam)、氟唑菌苯胺及吡噻菌胺(penthiopyrad)。Rice 等[13]研究了氟酰胺在高尔夫球场球道径流中的转移情况,发现在模拟的暴雨径流结束时,转移到球场外径流中的氟酰胺为 37~1 413 μg/L,平均为 (798 ± 84) μg/L。噻呋酰胺(thifluzamide) 目前已广泛应用于中国、日本、墨西哥及巴西等地,并且在中国黑龙江和河南省玉米土壤以及韩国河道等地已被检测到[16]。Wei等[17]在中国江苏省南京稻田施用有效成分为108 g/hm2剂量的噻呋酰胺后,发现其在稻田中的初始沉积量为3 908.8 μg/L,降解半衰期 (DT50) 为28.64 d。Hand等[18]研究发现,吡唑萘菌胺在天然水体中的降解速度相对较慢,DT50值估算为62 d,在黑暗的水沙系统中其半衰期甚至可超过1年。有研究表明,吡唑萘菌胺在实验室有氧土壤环境中的DT50值为40~976 d[19]。氟唑菌酰胺在水和沉积物系统中也具有较高的持久性,其DT50值超过157.6 d[20]。联苯吡菌胺在环境中不易降解,其DT50值在壤土中为105 d,在砂壤土中为316 d,在淤泥壤土中为1 235 d以上,在水中为82 d以上[21-22]。综上可见,SDHIs杀菌剂在水环境中的暴露风险较高,对水生生态系统存在一定威胁。
2 SDHIs杀菌剂对水生生物的毒性效应研究现状
SDHIs杀菌剂大量施用后,易进入到水体环境并对水生生物造成一定的威胁。由于大多数SDHIs杀菌剂对水生生物毒性均较高,因此其对水生生物的毒性评价受到了广泛的关注,相关研究主要集中在对水生生物的急性致死效应、亚致死效应和慢性毒性效应,以及在器官组织、生理生化和基因水平的毒理学作用机制等方面。
2.1 在水生生物体内的富集
农药通过水体环境进入水生生物体内,易在生物体内富集[23]。目前已有大量在施用区域水生生物体内检测到SDHIs杀菌剂残留的报道。Smalling等[24]在试验区域的水、鱼和沙蟹样品中,以及在89%的沉积物样品中均检测到了啶酰菌胺残留。Tsuda等[25]报道,氟酰胺在日本东沿海地带的北部流域琵琶湖 (Lake Biwa) 及亚纳梅讷河 (Yanamune River) 沿岸地区蓝鳃鱼 (bluegill) 和石田螺 (himetanishi)中的残留量均低于2 μg/kg。臧晓霞等[26]研究发现,啶酰菌胺可在成年斑马鱼体内富集,并于28 d时达到峰值,其生物浓缩因子 (BCF) 值接近36,表明啶酰菌胺可能通过食物链对人类健康构成潜在威胁。林琎[27]报道,将斑马鱼分别暴露于0.745、0.149和 0.014 9 mg/L的氟吡菌胺中192 h 后,其BCF值分别为33.65、26.39和193.25,表明农药在水中的暴露浓度对其生物浓缩因子存在一定影响。农药可以通过多种途径在生物体内富集,水生生态系统中的农药可通过浮游植物转移至鱼等生物体内,最终通过食物链转移至人类[28-29],当其富集量达到一定程度后即可能会对人类健康造成威胁。因此,农药在水生生物体内的富集性是其环境安全评价的重要指标[30]。
2.2 对水生生物的急性致死效应
大部分SDHIs杀菌剂对不同水生生物的致死效应均较强,其急性毒性表现为中毒到剧毒 (表2)。Zhou等[31]研究发现,将斑马鱼胚胎暴露于50 μg/L的苯并烯氟菌唑,其死亡率达到75%以上。经1 000 μg/L的吡唑萘菌胺处理后,热带爪蟾胚胎的生存率低于60%[32]。Qian等[33]发现,采用高于1 400 μg/L的啶酰菌胺处理可显著抑制小球藻的产生。Yao等[34]研究发现,10 000 μg/L氟唑环菌胺处理组,斑马鱼受精72 h之后的死亡率高达100%;经5 000 μg/L的氟唑环菌胺处理96 h后,斑马鱼胚胎孵化率为0。
研究表明,虽然SDHIs杀菌剂的作用机理相同,但是其对水生生物的毒性效应却存在一定差异,主要表现在以下几方面:1) 不同品种SDHIs杀菌剂对同一种水生生物的毒性不同。报道显示,啶酰菌胺对斑马鱼胚胎的96 h-LC50值为1 260 μg/L,毒性等级为中毒[35],而吡唑萘菌胺对斑马鱼胚胎的96 h-LC50值为230 μg/L,为高毒[36],二者毒性相差5倍。此外,啶酰菌胺和吡唑萘菌胺对大型溞的48 h-LC50值相差200倍以上[37-38]。2) 同一种SDHIs杀菌剂对不同水生生物的毒性差异较大。如吡唑萘菌胺对鲤鱼Cyprinus carpio的96 h-LC50值为26 μg/L,毒性等级为剧毒[37],但是其对热带爪蟾Xenopus tropicalis的48 h-LC50值为2 870 μg/L,仅为中毒[32]。3) 同一生物不同生命阶段对同种SDHIs杀菌剂的敏感性不同。如噻呋酰胺对斑马鱼胚胎、仔鱼和成鱼的 96 h-LC50值分别为 3 080、3 520和3 970 μg/L,敏感性顺序依次为胚胎>仔鱼>成鱼[39]。吡唑萘菌胺对斑马鱼胚胎和成鱼的96 h-LC50值分别为300和230 μg/L,敏感性顺序为胚胎 > 成鱼[36-37]。啶酰菌胺对斑马鱼胚胎和成鱼的96 h-LC50值分别为 1 260和1840 μg/L,胚胎的敏感性高于成鱼[35]。不同生命阶段斑马鱼对氟酰胺的敏感性依次为成鱼 (LC50值 2 700 μg/L) >孵化 12 h 的仔鱼 (3 910 μg/L) >受精后72 h的仔鱼(4 090 μg/L) >胚胎 (5 470 μg/L)[40]。大量研究表明,同种SDHIs 杀菌剂对不同生命阶段水生生物的毒性存在一定差异,尽管有一些药剂对成鱼的毒性更高,但是大多数情况下均为幼鱼对药剂的敏感性高于成鱼,然而目前尚缺少系统比较分析SDHIs杀菌剂对水生生物毒性效应差异的研究报道,有待进一步研究和探讨。
2.3 SDHIs杀菌剂对水生生物的亚致死效应及慢性毒性
除了SDHIs杀菌剂对水生生物的急性毒性外,研究者就其亚致死效应及慢性毒性方面也进行了大量研究。目前有关其亚致死效应的研究主要集中在影响水生生物的运动行为及诱导产生畸形症状等。Qian等[45-46]研究发现,暴露于2 500~2 900 μg/L啶酰菌胺和吡噻菌胺中的斑马鱼胚胎,受精24 h后其自由运动次数明显高于对照组。目
前有关SDHIs杀菌剂对水生生物致畸作用的报道较多,其畸变类型主要表现为身体变形、小头、眼睛晶状体浑浊、色素减退、尾轴短缩、鳍窄小、心包水肿及卵黄囊水肿等特点。Wu等[32]的研究表明,采用500 μg/L的联苯吡菌胺和吡唑萘菌胺处理热带爪蟾胚胎,畸形率可达100%,畸形表现包括眼睛晶状体浑浊、色素减退、尾轴短缩和鳍窄小 (图1)。Li等[47]研究发现,采用125 和375 μg/L的氟唑环菌胺处理,受精48 h后的斑马鱼胚胎表现出色素减退、尾畸形、脊柱弯曲和卵黄囊水肿等畸形变化。Yao等[34]发现,采用氟唑环菌胺处理斑马鱼胚胎/幼鱼,在2 500、3 000、3 500、4 000和5 000 μg/L质量浓度下,受精5 d后的斑马鱼幼鱼表现出身体变形、鱼鳔充盈被抑制、小头及心包水肿等畸形特征 (图2)。Qian等[45]研究发现,在2 000、2 600和3 200 μg/L的啶酰菌胺处理下,可导致斑马鱼胚胎卵黄囊出现水肿,其面积高达0.5 mm2,比对照组增加了60%,并且在1 700~3 200 μg/L范围内,处理组畸形率显著高于对照组。

表2 SDHIs杀菌剂对不同水生生物的急性和慢性毒性数据Table 2 Acute and chronic toxicity of SDHI fungicides to different aquatic organisms
大部分SDHIs杀菌剂对不同水生生物的慢性毒性效应均较强,其毒性等级为中毒-剧毒 (表2)。已有研究表明,部分SDHIs杀菌剂长期暴露会造成水生生物繁殖力下降、受精率降低、发育异常、内分泌紊乱及神经毒性等慢性毒性效应。Qian等[48]报道,暴露于啶酰菌胺中28 d的斑马鱼,其体重及体长均明显受到抑制。Vu等[12]研究发现:啶酰菌胺可明显抑制雄性和雌性海洋两栖类短吻鳄的体型大小,且在1 μg/L下处理42 d后,对雄性海洋两栖类短吻鳄体长增长有抑制作用,但对雌性无显著影响;与对照组相比,在40 μg/L 啶酰菌胺处理下,雄性海洋两栖类短吻鳄头部的长度降低了6.8%,而雌性头部长度降低了12.6%。该研究表明,相对于雄性而言,啶酰菌胺对雌性两栖类短吻鳄生长发育的影响更为明显。此外,该研究还发现,啶酰菌胺能够明显抑制海洋两栖类短吻鳄的繁殖,在处理28 d之后未见子代产生。Matsumoto 等[49]的研究表明,氟酰胺对大型溞存在一定的生殖毒性,可显著抑制其第一代个体的大小。Aksakal 等[50]发现,采用5 000 和 10 000 μg/L的啶酰菌胺处理大型溞21 d,能够明显抑制其蜕皮频率,并且延迟了第一次繁殖时间,降低了产卵量。Teng等[51]的研究表明,经50和1 000 μg/L的氟酰胺暴露60 d后,雌性斑马鱼的繁殖力显著下降,并且1 000 μg/L 处理组斑马鱼的受精能力显著降低,孵化率及其后代的生存率也受到了明显抑制。此外,Teng等[52]还发现,氟酰胺可干扰斑马鱼胚胎甲状腺相关氨基酸基因的表达,进而引起甲状腺腺素水平改变,最终导致甲状腺内分泌紊乱。姚鸿州[53]的研究表明,苯并烯氟菌唑、吡唑萘菌胺和氟唑环菌胺会破坏雌斑马鱼性类固醇激素的平衡,干扰内分泌系统,从而影响斑马鱼的生殖性能和发育;同时苯并烯氟菌唑、吡唑萘菌胺和氟唑环菌胺还可抑制雌斑马鱼乙酰胆碱酯酶 (AChE) 的活性而产生神经毒性。Wang等[54]研究发现,啶酰菌胺可干扰与斑马鱼胚胎神经发育和传递信号相关基因的表达,从而引起神经毒性。综上可见,较低浓度的SDHIs杀菌剂暴露即可引起水生生物的慢性毒性,并且可能通过多种途径对水生生物产生毒性效应。
3 SDHIs杀菌剂对水生生物的毒性作用机制
3.1 对水生生物组织病理形态的影响
在污染物的环境毒理学评价中,一般通过组织病理学技术研究农药暴露对生物组织的损伤情况。Qian等[45]通过光学显微镜技术研究发现,经600和1 200 μg/L的啶酰菌胺暴露4 d后,斑马鱼幼鱼的鱼鳔未能膨胀,表明其充盈受到了明显抑制。Yang等[55]利用组织切片和透射电镜技术,研究了噻呋酰胺处理28 d对斑马鱼成鱼肝脏组织的影响,组织病理学分析结果显示,1 900 μg/L处理组出现了肝脏脂肪变性或空泡变性;通过透射电镜进一步观察发现,在19、190及1 900 μg/L噻呋酰胺处理下,斑马鱼肝脏超微结构中均出现了不同程度的内质网肿胀及核糖体破坏现象。Yang等[39]研究发现,噻呋酰胺暴露可导致斑马鱼肝脏细胞空泡化、坏死、脂肪变性、中心静脉充血及肝窦淤血,导致肾脏组织出现肾间质坏死;透射电镜下还可观察到肝脏线粒体出现嵴退化、细胞膜破损、线粒体自身溶解、线粒体肿胀及溶酶体吞噬线粒体等毒性效应。姚鸿州[53]通过组织病理学观察,发现吡唑萘菌胺、苯并烯氟菌唑和氟唑环菌胺暴露可对雌性斑马鱼肠道组织形态产生影响,导致肠道内绒毛破损,肠上皮细胞严重溶解脱落以及肠道绒毛和微绒毛结构遭到破坏。
综上所述,SDHIs杀菌剂可对水生生物产生毒性效应,导致水生生物组织表现出不同程度的病理损伤,而药剂对组织损伤情况的研究可作为评价污染物对水生生物毒害程度的指标之一。
3.2 对水生生物酶活性及其他生化指标的影响
当生物体受到外源物质侵害或胁迫时,可能会产生氧化应激[56-58],而生物体内氧化-抗氧化比例失衡则会造成氧化损伤。许多研究发现,SDHIs杀菌剂会改变水生生物抗氧化酶的活性,诱导氧化应激的产生。Yao等[34]的研究表明,氟唑环菌胺可影响斑马鱼的抗氧化酶系统,引起丙二醛(MDA) 含量增加及谷胱甘肽巯基转移酶 (GST) 活性升高,同时抑制过氧化物酶 (POD)、超氧化物歧化酶 (SOD) 和谷胱甘肽 (GSH) 的活性,从而可能对斑马鱼细胞和组织产生破坏作用。Yao等[36]发现,采用吡唑萘菌胺处理斑马鱼仔鱼4 d之后,可诱导其MDA、SOD、GST及GSH的活性明显升高,导致斑马鱼产生氧化损伤。臧晓霞[58]发现,将斑马鱼暴露于啶酰菌胺中,可导致其肝脏和鳃中MDA含量增加,激发机体防御功能,诱发氧化应激,对斑马鱼产生氧化损伤,且随着暴露时间延长及暴露浓度增大,鳃和肝脏中SOD、过氧化氢酶 (CAT )、POD及谷胱甘肽过氧化物酶(GPx) 活性在暴露前期随浓度增大而升高,在暴露后期则随浓度增大而降低。Qian等[33]研究发现,小球藻于啶酰菌胺中暴露96 h后,其活性氧 (ROS)含量水平及SOD活性升高,POD和CAT活性降低,标志着氧化应激和氧化损伤的产生。Qian等[48]研究发现,啶酰菌胺可诱导斑马鱼胚胎的凋亡相关酶caspase 3和caspase 9活性及肝脏中甘油三酸酯 (TG) 和胆固醇 (TC) 含量显著升高,导致细胞凋亡和脂质代谢的发生。
此外,SDHIs杀菌剂还可对水生生物体内其他酶活性或蛋白含量产生影响。臧晓霞[58]研究发现,啶酰菌胺可提高斑马鱼成鱼肝脏中丙酮酸激酶及己糖激酶活性,提高葡萄糖-6-磷酸酶的含量,同时抑制其琥珀酸脱氢酶 (SDH) 和线粒体复合物Ⅱ的活性,并推测这可能是导致糖代谢及能量代谢紊乱的潜在机制。同时Yang等[39]也发现,噻呋酰胺会抑制斑马鱼SDH 和线粒体复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ的活性,造成机体能量供应不足,进而影响斑马鱼体内的循环功能或对其组织器官造成损伤。姚鸿州[53]研究发现,成年雌性斑马鱼暴露于苯并烯氟菌唑、吡唑萘菌胺和氟唑环菌胺后,会对其钙调神经磷酸酶 (CaN)、AChE及肾上腺素等多种神经系统相关标志物造成影响,表明上述3种药剂对成年斑马鱼具有潜在的神经毒性;同时这3种杀菌剂还对成年雌性斑马鱼的甲状腺素 (T4) 和三碘甲状腺原氨酸 (T3) 含量造成了影响,且对 T4 表现出浓度-诱导效应,对T3 表现出浓度-抑制效应,表明这3种杀菌剂对成年斑马鱼还具有潜在的甲状腺干扰效应,可能对其发育产生影响;并且这3种药剂还可导致雌性斑马鱼体内睾酮 (T) 和雌二醇 (E2) 含量下降,破坏雌鱼的性类固醇激素平衡,表明其还具有潜在的内分泌干扰活性,可能影响斑马鱼的生殖性能和发育。Teng等[52]的研究也表明,暴露于氟酰胺的斑马鱼胚胎中T3和T4水平升高导致其甲状腺激素失衡,从而引起发育毒性。
生物体内不同代谢通路之间互相联系并互相影响,如线粒体功能紊乱会直接导致氧化应激和细胞凋亡的产生,氧化应激可进一步导致免疫毒性,而免疫系统与内分泌系统具有密切关系[59-61]。SDHIs杀菌剂可影响水生生物多个代谢通路中的酶活性与蛋白含量,且已有很多研究表明,该类杀菌剂对水生生物的作用靶标可能是线粒体,故其导致的氧化应激和细胞凋亡可能与线粒体损伤有关,但该类杀菌剂对水生生物线粒体的具体作用机制还需进一步研究。
3.3 对水生生物基因表达水平的影响
生物体内相关基因的表达量变化可从核酸水平反映农药对生物体的影响及作用机制,是环境毒理学领域常用的研究方法。已有研究表明,SDHIs杀菌剂可显著影响水生生物不同代谢通路(氧化应激、细胞凋亡、能量代谢、脂质代谢、糖代谢、神经毒性及内分泌干扰等) 相关基因的表达水平。Teng等[52]研究发现,斑马鱼胚胎暴露于1 000和2 000 μg/L的氟酰胺中96 h后,其甲状腺相关基因的转录和促甲状腺激素受体 (TSHR) 蛋白表达水平发生改变,其中TRH(促甲状腺素释放激素)、Dio1(脱碘酶-碘甲状腺素1型)、TRα(促甲状腺素受体)、UGT1ab(尿苷二磷酸葡萄糖酸转移酶) 和TPO(甲状腺过氧化物酶) 基因表达水平下调,但TSHR基因表达水平上调,且TSHR蛋白表达水平也明显升高,与其基因表达水平变化一致,最终导致斑马鱼甲状腺内分泌系统紊乱。Wang等[54]研究发现,采用25 000 μg/L的啶酰菌胺处理斑马鱼胚胎48 h,能够影响其神经发生和神经递质相关基因的表达:下调gfap(胶质纤维酸性蛋白) 和gap43(生长相关蛋白),上调nestin(巢蛋白)、neurogenin1(神经元素)、glula(谷蛋白亚基IA)、gad1b(谷氨酸脱羧酶1b)、dat(多巴胺转运体) 和abat(氨基丁酸转氨酶编码因子) 基因表达水平,最终破坏斑马鱼的神经系统。Qian等[45]研究发现,用300、600和1 200 μg/L的啶酰菌胺处理斑马鱼胚胎96 h,会不同程度影响其细胞凋亡相关基因:上调p53(肿瘤抑制基因)、bax(Bcl-2相关凋亡调蛋白)、bcl-2(B细胞淋巴瘤蛋白2)、puma(p53上调细胞凋亡调节因子)、apaf-1(凋亡蛋白酶活化因子1)、caspase-3(半胱氨酸天冬氨酸蛋白酶3) 和caspase-9(半胱氨酸天冬氨酸蛋白酶9) 基因表达水平,并且该变化主要发生在心脏部位,最终引起斑马鱼胚胎的发育毒性和凋亡;同时其对脂质代谢相关基因也产生了一定的影响:hmgcra(羟甲基戊二酸辅酶为还原酶)、cyp51(14α-脱甲基酶) 和srebf1(甾醇调节元件结合因子) 基因表达水平上调,而pparα1(过氧化物酶体增殖物激活受体)、acca1(乙酰辅酶a羧化酶)和fas(脂肪酸合成酶) 基因表达水平下调,从而引起脂质代谢紊乱,最终影响能量代谢,产生发育毒性;同时对黑色素形成相关基因dct[多巴色素异构酶 (DCT) 重组蛋白]、foxd(转录因子叉头框)、mitfa(小眼转录因子)、tyrp1a(酪氨酸酶相关蛋白1 a)、t y r p 1 b(酪氨酸酶相关蛋白1 b)、slc24a5(可溶性载体家族24,成员5)、pkc-β(蛋白激酶-β) 和myoVa(肌球蛋白-Va) 的表达也有不同程度影响,从而影响黑色素的分布,导致黑色素沉积。
杨阳[62]研究发现,将斑马鱼暴露于噻呋酰胺中处理 28 d之后,对其凋亡相关基因:p53、bax、bcl-2、puma、apaf-1、caspase-3和caspase-9,免疫相关基因:CC-chem(CC型趋化因子)、C1C(趋化因子配体-1)、IL-8(白细胞介素8) 和IFN(干扰素),脂质代谢相关基因:prl(泌乳刺激素)、dgat1b(甘油二酯酰基转移酶)、mgstI(微粒体谷胱甘肽S-转移酶1)、xdh(黄嘌呤脱氢酶)、insr(膜岛素受体) 和ngf(神经生长因子),糖代谢相关基因:prl、ide(胰岛素降解酶)、sirt4(人去乙酰化酶4)、insr、ngf和xdh,线粒体相关基因:18rsrrn(18rs核糖体核糖核酸)、polgI(线粒体DNA聚合酶)、tk2(脱氧核酸激酶)、twinkle(线粒体DNA转旋酶)、polrmt[线粒体DNA (mtDNA)指导的RNA聚合酶]、tfam(线粒体转录因子A)和mt-ndI(NADH泛醌氧化还原酶亚基1),以及抗氧化相关基因:GPX(谷胱甘肽光氧化物酶)、cat(过氧化氢酶)、mn-sod(Mn-过氧化物歧化酶)、Cu/Zn-sod(Cu/Zn-过氧化物歧化酶) 均可产生不同程度的影响,损伤线粒体的结构和功能,引起斑马鱼的氧化损伤、细胞调亡、坏死及免疫应答,并认为这些作用可能是导致对斑马鱼毒性的潜在机制。此外该研究还发现,斑马鱼成鱼暴露于1 900 μg/L的噻呋酰胺中28 d后,通过 “京都基因与基因组百科全书 (KEGG) ” 富集分析得到差异基因富集的通路为144个,其中上调基因富集的通路为85个,下调基因富集的通路为127个,且差异基因主要富集在代谢通路;基因本体富集分析(GO-THERM) 发现,差异基因主要集中在催化活性功能、有机体代谢过程类别及细胞器类别上;这些差异基因及通路可作为噻呋酰胺毒性检测的指标供进一步研究,并为靶基因和靶通路的研究提供参考,同时为噻呋酰胺检测试剂盒的开发提供了科学依据[62]。
上述研究表明,SDHIs杀菌剂可对水生生物氧化应激、脂质代谢、糖代谢、细胞凋亡、内分泌干扰、神经毒性及能量代谢等通路的基因表达产生影响,而基因表达水平变化可导致相关蛋白或者酶产生相应变化,其中部分基因,如抗氧化相关基因表达水平的变化与相应蛋白及酶活性的变化一致,说明该类杀菌剂对水生生物相关通路(酶活性、蛋白及基因等不同层面) 的影响可能是其对水生生物产生毒性的潜在机制。
4 研究展望
目前,已有许多研究报道了SDHIs杀菌剂对水生生物的毒性效应及毒性作用机制,这些工作对其科学合理使用和有效监管具有一定的参考价值,但相关工作仍处于探索阶段。后续针对SDHIs杀菌剂对水生生物的毒理学研究,以下问题还有待进一步明确:
1) SDHIs杀菌剂对水生生物的毒性效应机制有待深入研究。关于SDHIs杀菌剂对不同水生生物的毒性差异,以及同一药剂对同一水生生物不同发育阶段的毒性差异等选择性机制尚无合理解释。目前有关SDHIs杀菌剂对水生生物器官毒性的研究主要集中在肝脏、肾脏、血液、鳃和脑上,但其关键致毒靶器官还有待明确。SDHIs杀菌剂对水生生物线粒体及相关通路的影响机制有待深入研究,尽管已知该类杀菌剂对真菌的作用靶标为线粒体,但是其对水生生物的毒性作用靶标是否为线粒体,以及其对水生生物不同器官及组织线粒体功能的影响程度是否存在差异等还有待明确。
2) 目前有关SDHIs杀菌剂对藻类、溞类、鱼类等单一物种的毒性已有报道,但从生态系统的角度,对处于不同营养级生物的影响如何,以及是否存在级联效应等还需要进一步评估。
3) 有关SDHIs杀菌剂对水生生物慢性发育毒性的研究甚少,未来应进一步评估该类药剂慢性暴露后对水生生物生殖能力以及所产后代的影响。
4) 立足现有品种,开展SDHIs杀菌剂结构、剂型等与选择毒性相关的研究,探索通过结构修饰、剂型改变和使用技术改进等措施降低该类药剂对水生生物毒性的可行性。
