河北保定地区草莓根腐病病原鉴定及室内毒力测定
2021-06-11李青杰朱佳红吴佳佳颜冬冬王秋霞曹坳程
李青杰,朱佳红,吴佳佳,靳 茜,李 园,颜冬冬,王秋霞,曹坳程
(1.中国农业科学院 植物保护研究所,北京 100193;2.保定学院/河北省土传病害绿色防控技术创新中心,河北 保定 071000)
草莓 (Fragaria ananassaDuchense) 是蔷薇科草莓属、多年生宿根性草本植物,具有较高的经济价值,因其营养丰富、酸甜多汁,素有“水果皇后”的美称[1-2]。近年来草莓的种植面积不断扩大,连作导致的土传病害也越来越严重,尤其是草莓根腐病,严重制约了草莓种植业的发展,影响了草莓的产量和收益[3]。
草莓根腐病在冬季和早春发病较为严重,严重影响草莓的生产,主要为害草莓的根系,一般表现为全株系统性为害症状,根据为害症状和病原菌的不同,草莓根腐病可分为炭疽根腐病、红中柱根腐病和黑根腐病[4]。草莓根腐病在世界各地均有不同程度的发生,但不同地区草莓根腐病的病原菌种类不同[5]。我国北京、山东、安徽、河南和江苏等地曾报道过草莓根腐病的致病菌,包括镰刀菌属、丝核菌属、拟盘多毛孢属和疫霉属等,其中镰刀菌属致病菌的报道较多[6-7]。
目前草莓根腐病的防治主要以化学防治为主,可选用代森锰锌和苯醚甲环唑等防治草莓炭疽根腐病,选用甲霜灵和霜脲·锰锌等防治草莓红中柱根腐病,选用多菌灵、百菌清和吡唑醚菌酯等防治草莓黑根腐病[8]。采取生物防治研究发现,枯草芽孢杆菌、多粘芽孢杆菌和乳芽孢杆菌等生防细菌可以防治由尖孢镰刀菌、立枯丝核菌和胶孢炭疽菌引起的草莓根腐病[9-10]。目前,采取无菌苗繁殖培育和对土壤进行消毒也是预防草莓根腐病的有效措施。
河北省保定市是全国重要的草莓种植基地,草莓种植已有多年的时间[11]。然而连作地块草莓根腐病发病严重,危害草莓的生长发育,导致大幅减产,给农民带来了巨大的损失[12]。而目前关于保定地区草莓根腐病的具体致病菌报道较少,为研究该地区草莓根腐病的主要致病菌,将采集到的草莓根腐病株进行病原菌分离纯化和柯赫氏法则验证,并对鉴定的病原真菌进行室内毒力测定,旨在为防治该地区草莓根腐病提供参考。
1 材料与方法
1.1 材料
1.1.1 供试植株 草莓根腐病病样于2020年11至12月采集于河北省保定市满城区南韩村镇段旺村、顺平县蒲阳镇东魏村、顺平县腰山镇才良村等主要草莓种植基地(连续种植草莓20年以上),分为“红颜”和“甜查理”2个品种。
1.1.2 供试培养基 PDA培养基:青岛日水生物技术有限公司。PDA成分:马铃薯浸粉 5.0 g、葡萄糖 20.0 g、琼脂14.0 g,pH为(5.6 ± 0.2)。加入1 000 mL蒸馏水,加热煮沸溶解,分装,121 ℃高温高压灭菌20 min。
1.1.3 供试药剂 10%苯醚甲环唑微乳剂,25%吡唑醚菌酯悬浮剂,3%甲霜·噁霉灵水剂(河北中保绿农作物科技有限公司);50%多菌灵可湿性粉剂(江苏三山农药有限公司);50%克菌丹可湿性粉剂(安道麦马克西姆有限公司);50%福美双可湿性粉剂(河北冠龙农化有限公司);722 g/L霜霉威盐酸盐水剂(深圳诺普信农化股份有限公司);50%异菌脲可湿性粉剂(苏州富美实植物保护剂有限公司)。
1.2 方法
1.2.1 病原菌的分离与纯化 采用常规的组织分离方法[13-14]进行分离:用流动的清水冲洗干净草莓的根部。剖开草莓褐色的根部,切取病健交接处0.5 cm左右的组织块,放入75%的酒精中浸泡30 s,转入无菌水中清洗3次,用灭菌纸吸干水分后用镊子将其置于含有0.1 g/L硫酸链霉素的PDA培养基上, 放入28 ℃培养箱中培养,待长出菌丝, 单孢纯化, 分离得到的菌株保存备用。
1.2.2 形态学鉴定 观察接种到PDA培养基上的病原菌菌丝形态变化、颜色等生长情况。在显微镜下拍照观察,观察记录菌落的分生孢子形态和菌丝形态等。
1.2.3 病原菌分子鉴定 采用CTAB法提取纯化菌株 的DNA。用 真 菌ITS通 用 引 物ITS1 (5′-TCCG TAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTC CGCTTATTGATATGC-3′)对分离菌株DNA进行PCR扩增。PCR体系为20 μL体系:DNA模板2 μL,M5Hiper超光速mix 10 μL,ITS1 0.5 μL,ITS4 0.5 μL,dd H2O补足至20 μL。扩增程序为:95 ℃预变性3 min;94 ℃ 25 s,55 ℃ 25 s,72 ℃ 60 s,共36个循环;72 ℃ 5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后送至北京六合华大基因科技有限公司测序,测序结果采用BLAST进行同源性分析。最后使用软件MEGA 7.0以最大简约法(Maximum Parsimony,MP)构建系统发育树。
1.2.4 致病性测定 根据柯赫氏法则[15],将分离得到的菌株接种到草莓植株上,接种无菌水的草莓植株为对照,观察草莓植株的发病情况。从发病的草莓植株上重新分离、纯化病原菌并进行形态学和分子鉴定。
1.2.5 杀菌剂对供试病原菌的室内毒力测定 用无菌水将供试药剂溶解配制成一定质量浓度的药剂母液,再用无菌水稀释,制成系列浓度梯度药液。将杀菌剂加入PDA培养基中,充分摇匀,制成含药平板(9 cm),以加入等量灭菌水的PDA培养基为对照(见表1)。用灭菌的打孔器在菌落边缘打取5 mm菌饼接种到培养基上,28 ℃黑暗培养。采用菌丝生长速率法[16]测定杀菌剂对供试菌株的毒力作用。应用DPS7.5软件计算出各杀菌剂的毒力回归方程、抑制中浓度EC50值、相关系数r以及EC5095%置信区。

表1 杀菌剂母液及有效浓度梯度Table 1 Fungicide mother liquor and effective concentration gradient
抑制生长率(%)= (对照菌落的直径-处理菌落的直径)/对照菌落的直径×100%
2 结果与分析
2.1 草莓根腐病田间症状
在河北省保定市满城区南韩村镇段旺村、顺平县蒲阳镇东魏村、顺平县腰山镇才良村等主要草莓种植基地,观察到草莓病株比健康植株矮小,下部老叶为褐色逐渐向心叶扩展,最后叶片蜷缩,根部为褐色,切开后根茎的中柱均为红褐色(见图1)。

图1 草莓根腐病的发病症状Fig .1 Symptoms of strawberry root rot
2.2 病原菌形态特征观察
通过观察,采集的草莓病株经过分离纯化菌株特征基本一致。在28 ℃培养条件下,病原菌约14 d长满9 cm培养皿,菌落呈白色棉状,边缘呈波状,菌落正面未见明显的色素产生(图2a),背面为浅黄色,7 d左右出现黑色的颗粒物(图2b)。在显微镜下观察分生孢子呈纺锤形,直径为(26.72~31.89) μm × (6.35~8.46) μm。分生孢子有5 个细胞,4 个隔膜,中间3 个细胞颜色较深为橄榄色,顶端与尾部细胞颜色较淡,多数呈透明状,顶端2~4 根附属丝,尾部1 根附属丝(图2c)。根据菌落形态特征,初步将分离到的菌株鉴定为拟盘多毛孢属真菌。
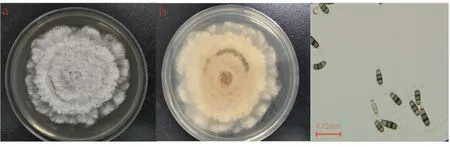
图2 病原菌菌落及分生孢子形态Fig. 2 Pathogen colony and conidia morphology
2.3 病原菌分子鉴定结果
经PCR扩增、1%琼脂凝胶电泳后,病原菌的DNA序列长度在500~750 bp之间。将测序序列进行BLAST比对,菌株的序列和新拟盘多毛孢(Neopestalotiopsis clavispora)的相似性达到98%,且在进化树上最接近(图3)。进一步可确定所采集到的草莓根腐病病株的病原菌为新拟盘多毛孢。

图3 真菌ITS序列遗传进化分析Fig 3 Genetic evolution analysis of fungal ITS sequence
2.4 病原菌的致病性
接种病原菌的草莓植株10 d左右可见草莓叶片边缘变为浅褐色,逐渐向内扩展,草莓根部也变成褐色,切开草莓根系,内部均为褐色,和田间症状相同。根据柯赫氏法则,从接种发病的草莓根部分离病原菌,进行形态学和分子鉴定,结果表明该菌为是新拟盘多毛孢(Neopestalotiopsis clavispora),病菌与从田间草莓病株上分离鉴定的病原菌一致。证明用于接种的病原菌是引起该草莓根腐病的病原菌。
2.5 杀菌剂对病原菌的毒力测定
测定结果显示吡唑醚菌酯和苯醚甲环唑对病原菌的抑制效果最好,EC50值分别为0.004 8和0.013 6 mg/mL,其次是福美双、克菌丹和异菌脲,EC50值分别为0.019 7、0.026和0.060 1 mg/mL,甲霜·噁霉灵和多菌灵的效果较差,EC50值分别为0.950 5和0.95 8 mg/mL,霜霉威的抑制效果较差,EC50高达4.003 5 mg/mL(见表2)。

表2 杀菌剂对新拟盘多毛孢的毒力测定结果Table 2 Toxicity test results of fungicides to Neopestalotiopsis clavispora
3 结论与讨论
草莓的连作导致病原菌和虫卵的积累,极易发生病害,其中草莓根腐病已经成为草莓生产上难以解决的问题,目前主要以化学防治为主[17]。由于草莓根腐病的致病菌较多,首先要明确具体致病菌才能有针对性的防治草莓根腐病[18]。
本研究确定了保定地区草莓主要种植地草莓根腐病的致病菌是新拟盘多毛孢(Neopestalotiopsis clavispora),这也是首次在河北保定报道。国外如西班牙、印度、阿根廷等地已报道新拟盘多毛孢可引起草莓根腐和茎腐病[19-21],我国到目前为止仅在青岛和北京发现新拟盘多毛孢引起的草莓叶斑病和根腐病[22],新拟盘多毛孢还可侵染月季和牛油果等作物[23-24],给农业生产造成巨大的损失。温浩等[22]研究表明双苯菌胺对从草莓叶斑病上分离的新拟盘多毛孢的毒力最强;姚玉荣等[25]发现戊唑醇对胶孢炭疽菌和尖孢镰刀菌引起的草莓根腐病防治效果最好;咸俊男等[26]研究表明,甲基硫菌灵对立枯丝核菌引起的房山区草莓根腐病有较好的抑制作用;姚锦爱[27]研究表明贝莱斯芽胞杆菌(Bacillus velezensis)可有效防治尖孢镰刀菌引起的草莓根腐病。在本研究供试的8种杀菌剂的毒力测定中,结果显示吡唑醚菌酯对新拟盘多毛孢引起的草莓根腐病抑制效果最好,可作为防治草莓根腐病的首选药剂。
本试验通过菌株形态学和分子生物学方法明确了引起保定地区草莓根腐病的病原菌主要为新拟盘多毛孢 (Neopestalotiopsis clavispora) , 病原菌回接草莓又重新分离鉴定到该病原菌,并测定了8种杀菌剂对病原菌的敏感性,研究结果为保定地区草莓根腐病的防治提供了一定的参考依据。但在田间施药时,会受到多种因素如温度、湿度、喷雾器等的影响,可能会与本试验的研究结果有所不同。所以本研究的室内药剂毒力测定结果还需要在田间进一步的验证。
