RTN1-C基于Nogo-A/RhoA/ROCK2信号通路对脑卒中模型大鼠认知功能的干预作用
2021-06-09郭丹高兵栾梅
郭丹 高兵 栾梅
(1锦州医科大学附属第三医院神经外科,辽宁 锦州 121000;2辽宁锦州古塔区医院院办;3锦州医科大学附属第三医院老年科)
脑卒中是由脑血管破裂、局部脑组织区域血液供应障碍导致患者脑组织因缺血、缺氧而发生坏死的一种疾病,具有较高的发病率和死亡率,严重威胁人类生命健康,且脑卒中后会遗留一些严重的并发症〔1,2〕,如言语障碍、认知障碍、记忆力减退,严重影响患者的生存质量。内质网膜相关蛋白(RTN1)称为神经内分泌蛋白,在脑组织中的表达量最多,可减轻脑梗死脑组织的损伤程度,其作用机制与机体内的应激反应和各种通路蛋白相关联〔3〕。髓鞘相关生长抑制因子(Nogo-A)可参与神经细胞迁移和扩散,在阻止轴突再生和脑卒中后轴突重建方面具有非常重要的作用〔4,5〕。有效抑制Rho激酶(Rho)A的水平可促进大鼠神经干细胞神经突的生长与神经元的分化。在小胶质细胞中,活化的Rho相关卷曲蛋白激酶(ROCK)会影响神经炎症和多巴胺能神经变性,因此,抑制ROCK可调节轴突生长水平,保护神经元不受伤害〔6〕。本文分析RTN1-C基于Nogo-A/RhoA/ROCK2信号通路对脑卒中模型大鼠认知功能的干预作用。
1 资料与方法
1.1研究动物 选取清洁级健康雄性大鼠48只,鼠龄2~3个月,平均鼠龄(2.63±0.22)个月,体重250~330 g,平均体重(305.26±8.24)g,大鼠由广东省实验动物监测所提供,许可批号:SCXK 2018-0044。饲养环境:温度27℃,湿度60%,通风10次/h,自由饮食饮水。
1.2脑卒中大鼠模型的建立 从48只雄性大鼠中随机选取12只为正常组,剩余36只参考文献〔7〕建立脑卒中模型,大鼠腹腔注射5% 0.1 g/kg氯胺酮进行麻醉处理,将大鼠仰卧位放置在手术台上,颈部备皮、消毒,在颈部正中切开暴露出左颈总动脉、颈内动脉、颈外动脉,然后分离出颈外动脉、夹闭颈总动脉,尽量不刺激迷走神经,自颈外动脉逆行穿刺插管后注入1 ml/kg栓子盐水混悬液,立刻结扎颈外动脉,开放颈总动脉夹,血液会将栓子冲入颈内动脉,即脑卒中模型建立成功。
1.3干预分组 将36只模型大鼠随机分为模型组、对照组、RTN1-C干预组,各12只,模型组、对照组给予等体积的生理盐水干预,对照组将5 μl的慢病毒以0.5 μl/min的速率注射到大鼠右侧侧脑室中,针头固定5 min,为无意义序列,RTN1-C干预组与对照组方法一样,注射5 μl的慢病毒,其引物序列为5′-CACCGGAGCTTGATCACCCTTTCTTCAAGA GAGAAAGGGTGATATCAAGCTCCTTTTTTG-3′,由上海吉玛制药技术有限公司提供,以磷酸甘油醛脱氢酶(GAPDH)为内参蛋白,其上下游引物为5′-CCCATGGCAAGTTCAAAGGCA-3′,5′-TGGTGAAG-ACGCCAGTAGATT-3′。所有大鼠连续干预3 w。
1.4Morris水迷宫实验、四肢抓握能力、协调能力检测 建模后12 d采用Morris水迷宫检测大鼠的认知功能,Morris水迷宫是一个直径为160 cm、深50 cm的圆形水池,将东、西、南、北4个方向的水池划分为T1、T2、T3、T4 4个象限,在每个象限的池壁中间分别设置一个特殊的标记,以供大鼠记忆,向水池内注水、加入无毒的黑色色素,使平台隐匿,让各组大鼠在水池内游泳,用摄像机跟踪大鼠游泳过程,使用专门的计算机软件完成数据采集和图像分析,然后进行定位航行实验,过程为将大鼠放置在水池中,让其在水池内游泳,将大鼠找到隐匿平台的时间称为潜伏期,每只大鼠限时60 s寻找平台,若不能找到平台,则潜伏期为60 s。潜伏期越短,表明大鼠的认知功能越强。建模2 d后采用网屏测试实验检测大鼠四肢抓握能力,自制40 cm×30 cm的不锈钢网袋,网眼为2 cm×2 cm,将网屏放置在离地面20 cm的位置,将大鼠放置在上面,然后将网屏旋转为垂直状态并保持5 s,观察大鼠是否能够从网屏上跌落下来,评估标准、总分为3分,0分为大鼠的前爪能够握住网屏,且坚持5 s,不会跌落,1分为大鼠能够暂时抓住网屏,下滑一段距离但不会跌落,2分为大鼠在5 s内跌落,3分为网屏转动时大鼠便跌落。建模7 d后采用疲劳转棒实验测试大鼠的协调能力,使用ZB-200疲劳转棒仪(成都泰盟软件有限公司)检测大鼠的协调能力,大鼠的初始转速为10 r/min,5 min后将速度提升至40 r/min,保持5 min,使用计算机软件记录大鼠在转棒上行走的时间,大鼠在转棒上行走的时间越长,表明大鼠的协调能力越强。
1.5超氧化物歧化酶(SOD)、丙二醛(MDA)、活性氧(ROS)水平检测 在大鼠隐静脉处进行采血,待大鼠固定后,将后腿外侧区域剃毛后暴露采血点,将采血针刺入采血点,采集1 ml血液,用酶联免疫吸附试验检测SOD、MDA、ROS水平,先用包被缓冲液将SOD、MDA、ROS稀释至最合适的浓度,在37℃下储存4 h,用洗涤液洗涤3次,每次4 min,加入含有抗原的标本,在特异抗体和抗原结合下形成抗体复合物,再次洗涤后,固相载体上只剩下特定抗体,加入酶标记特异性抗体与复合物中的抗体结合,使抗体被酶标记,洗涤后,载体上的酶量表示特定抗体的量,添加底物来显现颜色,通过颜色深度来分析SOD、MDA、ROS的水平。
1.6病理学观察 腹腔注射10% 0.35 ml/100 kg,将大鼠放置在冰块上,迅速断头处死取脑,为方便切片,将大鼠的脑组织放置在冰盒上,在-25℃下速冻20 min,然后用刀片去除大鼠脑组织的嗅球和小脑部分,从脑前极开始进行冠状切片,片厚2 mm,将切好的脑片浸入预热的三苯基四氮唑溶液中进行染色,每孔一片,在37℃的烘箱中避光孵育25 min,10 min后将脑片翻面,保证两面均染色,正常脑组织为红色,脑梗死组织为白色。
1.7血脑屏障通透性、脑梗死率、脑血流灌流量、大脑皮层完整神经元数目检测 断头处死后,称取200 mg的脑梗死组织离心,取上清液,在酶标仪630 nm处测定吸光度,按照标准曲线计算大鼠的血脑屏障通透性。采用Image图像处理软件,计算脑梗死率=梗死区总面积/全脑总面积×100%。将取出的脑组织放置在4%多聚甲醛中,在4℃下遮光保存48 h,用激光扫描共聚焦显微镜观察,激光波长为488 nm,20×,z轴方向每0.5 μm扫一层,共扫100个层面,将所获得的图像进行三维重建,绿色荧光所占体积为血浆容量,脑血流灌注量=扫描区血浆容量/扫描区总容量×100%。在每张脑组织切面梗死的区域选取2个固定视野进行拍照,用Imagepro Plus软件分析图像,计算每组200倍视野内大脑皮层完整神经元数目。
1.8Nogo-A、RhoA、ROCK2蛋白检测 Western印迹法检测Nogo-A、RhoA、ROCK2、环腺苷酸应答元件结合蛋白(CREB),将取出的脑组织超声粉碎,加入1 ml的RIPA裂解液和10 μl的苯甲基磺酰氟(PMSF),取上清液加入蛋白上样缓冲液,在100℃下变性15 min,然后将样品进行10%聚丙烯酰胺凝胶电泳,每个孔中加入40 μg的总蛋白,电泳结束后将蛋白转移到聚偏氟乙烯(PVDF)膜上,转膜时间为60 min,5%脱脂奶粉封闭60 min,然后加入Nogo-A、RhoA、ROCK2的一抗抗体,在4℃下过夜,第2天取出后在37℃下放置60 min,TBST洗膜3次,每次15 min,加入辣根过氧化物酶标记的二抗,在37℃下孵育1 h,TBST洗膜3次,每次15 min,然后加入电化学发光(ECL)暗室曝光,利用Image J软件扫描条带灰度值,计算Nogo-A、RhoA、ROCK2的量。
1.9统计学方法 采用SPSS20.0软件进行方差分析、t检验。
2 结 果
2.1RTN1-C对脑卒中模型大鼠潜伏期、四肢抓握能力评分、行走时间的影响 与正常组相比,模型组、对照组、RTN1-C干预组潜伏期显著延长,四肢抓握能力评分显著升高,行走时间显著缩短(均P<0.05);与模型组相比,对照组、RTN1-C干预组潜伏期显著缩短,四肢抓握能力评分显著降低,行走时间显著延长(均P<0.05);与对照组相比,RTN1-C干预组潜伏期显著缩短,四肢抓握能力评分显著降低,行走时间显著延长(均P<0.05)。见表1。

组别潜伏期(s)四肢抓握能力评分(分)行走时间(min)血脑屏障通透性(μg/g)脑梗死率(%)脑血流灌流量(%)大脑皮层完整神经元数目(个)正常组9.73±1.640.50±0.03171.42±2.5925.94±2.520.00±0.0029.53±2.8670.54±3.19模型组39.54±2.431)2.99±0.011)42.15±2.611)281.83±6.101)26.42±1.591)8.53±0.761)10.68±1.621)对照组33.99±1.511)2)2.43±0.021)2)94.00±2.791)2)157.69±5.041)2)22.56±0.081)2)19.00±1.411)2)16.98±2.231)2)RTN1-C干预组26.49±3.101)2)3)2.14±0.281)2)3)102.04±5.661)2)3)102.89±2.831)2)3)18.40±2.161)2)3)20.19±2.471)2)3)46.46±2.271)2)3)F/P值393.414/0.001687.715/0.0012 540.314/0.0017 200.710/0.001914.391/0.001209.600/0.0011 608.205/0.001
2.2RTN1-C对脑卒中模型血脑屏障通透性、脑梗死率、脑血流灌流量、大脑皮层完整神经元数目的影响 与正常组相比,模型组、对照组、RTN1-C干预组血脑屏障通透性、脑梗死率显著升高,脑血流灌流量、大脑皮层完整神经元数目显著降低(均P<0.05);与模型组相比,对照组、RTN1-C干预组血脑屏障通透性、脑梗死率显著降低,脑血流灌流量、大脑皮层完整神经元数目显著升高(均P<0.05);与对照组相比,RTN1-C干预组血脑屏障通透性、脑梗死率显著降低,脑血流灌流量、大脑皮层完整神经元数目显著升高(均P<0.05)。见表1。
2.3各组病理学观察 正常组脑组织无明显病理改变,神经细胞排列紧密且整齐;模型组脑组织周围出现明显的水肿和坏死,细胞排列不规则、疏松、细胞间隙大、呈网状结构、神经细胞变形坏死、有大量的炎性细胞浸润;对照组脑组织肿胀减轻,无网状结构、固缩细胞减少;RTN1-C干预组脑组织肿胀减轻、神经元水肿变性减少,炎症细胞浸润减轻,细胞周围的间隙减少。见图1。
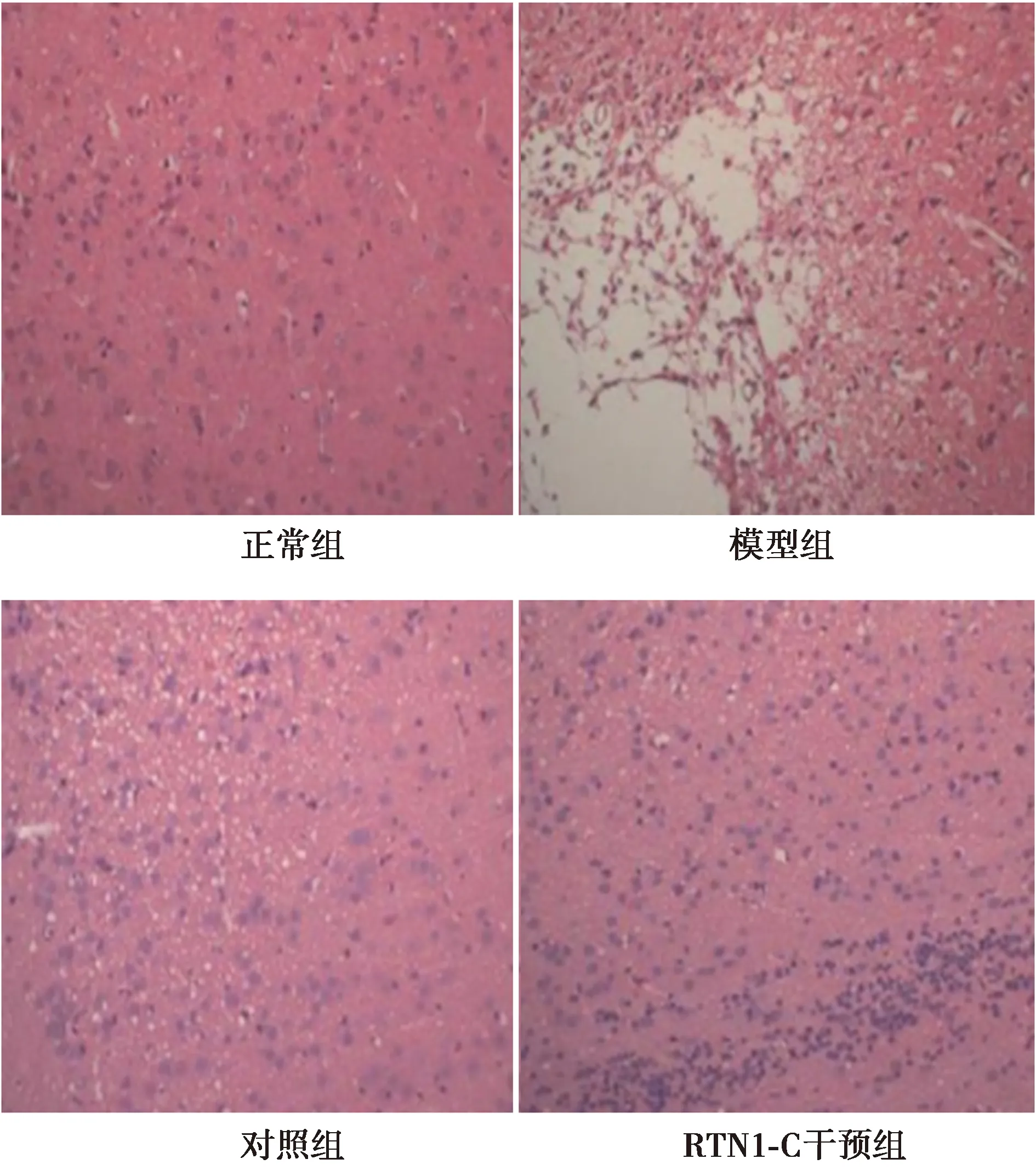
图1 各组脑组织病理学观察(三苯基四氮唑染色,×200)
2.4RTN1-C对脑卒中模型大鼠SOD、MDA、ROS水平的影响 与正常组相比,模型组、对照组、RTN1-C干预组SOD水平显著降低,MDA、ROS水平显著升高(均P<0.05);与模型组相比,对照组、RTN1-C干预组SOD水平显著升高,MDA、ROS水平显著降低(均P<0.05);与对照组相比,RTN1-C干预组SOD水平显著升高,MDA、ROS水平显著降低(均P<0.05)。见表2。

2.5RTN1-C对脑卒中模型大鼠Nogo-A、RhoA、ROCK2通路蛋白的影响 与正常组相比,模型组、对照组、RTN1-C干预组Nogo-A、RhoA、ROCK2水平显著升高(均P<0.05);与模型组相比,对照组与RTN1-C干预组Nogo-A、RhoA、ROCK2水平显著降低(均P<0.05);与对照组相比,RTN1-C干预组Nogo-A、RhoA、ROCK2水平显著降低(均P<0.05)。见表2和图2。
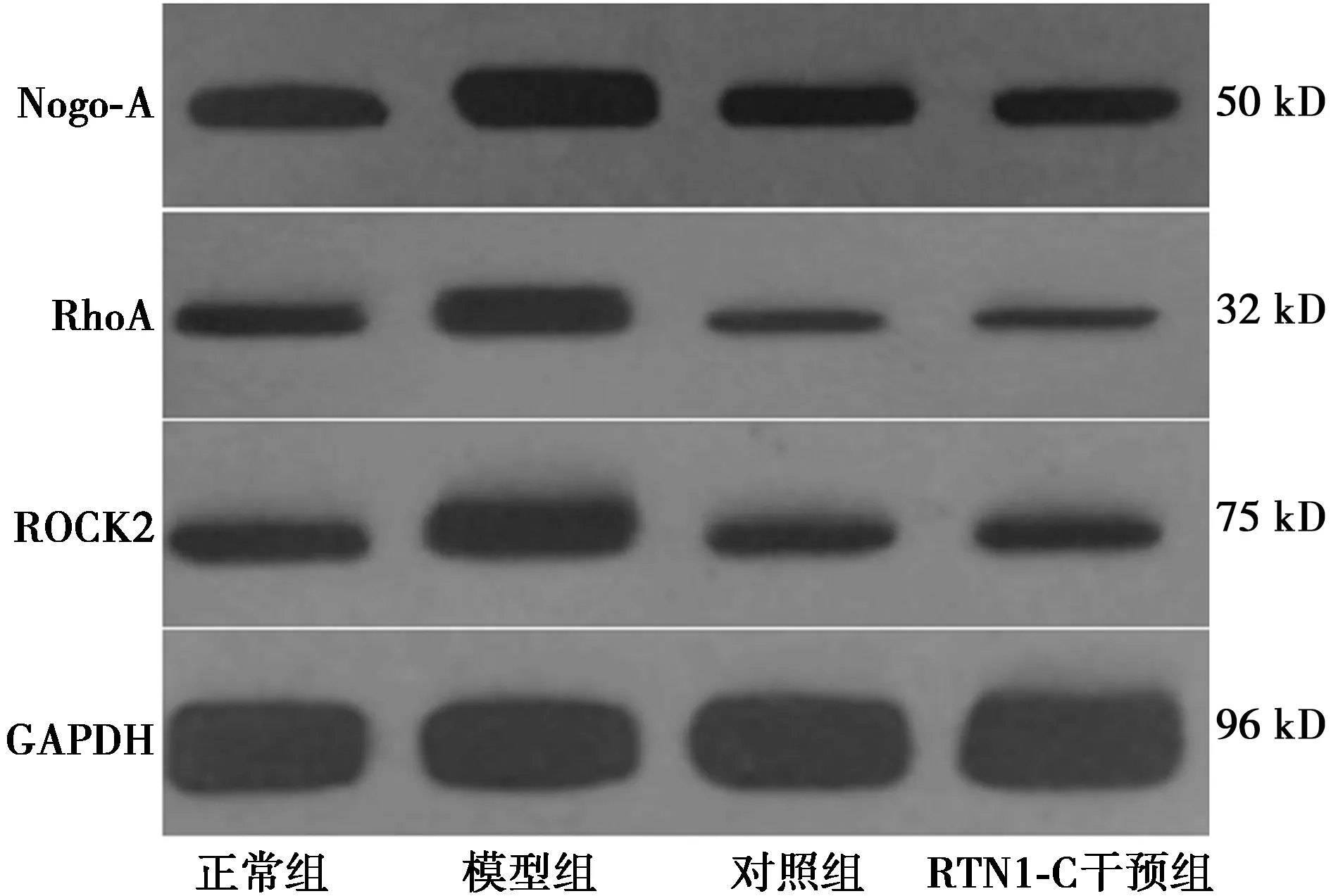
图2 Western印迹法分析各组Nogo-A、RhoA、ROCK2蛋白表达
3 讨 论
脑卒中是由局部脑组织缺血、脑组织水肿、乳酸累积、代谢紊乱等原因引起的,可导致严重认知功能障碍综合征,对患者的生活质量造成了极大的影响〔8,9〕。
RTN1家族共有RTN1-A、RTN1-B、RTN1-C 3个剪接体,RTN1-C主要在神经元和神经内分泌组织中表达,RTN1-C在脑卒中患者中表达下调可减轻脑组织损伤程度〔10,11〕。研究表明〔12〕,抑制RTN1-C表达可减轻脑卒中患者脑组织的损伤程度,并可恢复缺血再灌注中部分受损的神经功能,因此,RTN1-C可能为治疗脑卒中的一个靶点。本研究表明,RTN1-C可增强脑卒中模型大鼠的认知功能、四肢抓握能力和协调能力。
血脑屏障是脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障及血浆和脑脊液之间的屏障,这些屏障可阻止机体中有害的物质通过血液进入到脑组织〔13〕,对维持中枢神经系统的正常生理状态具有重要的意义〔14,15〕。脑梗死率是梗死区总面积与全脑总面积的比例,脑血流量是单位时间内血液通过脑血管某横截面积的流量。本研究提示RTN1-C可有效降低大鼠的血脑屏障通透性、脑梗死率,提高脑血流灌流量,增加大脑皮层完整神经元的数目。
SOD具有催化超氧阴离子自由基歧化生成氧和过氧化氢、维持机体内氧化和抗氧化平衡的作用,是参与体内氧化应激反应的重要因子,SOD水平越低表明机体内的氧化应激反应越强烈〔16,17〕。MDA是机体内脂质氧化终极产物,其含量越高表明机体内脂质氧化反应越强烈,对机体损害越严重。ROS是机体内吞噬细胞发挥其吞噬作用和杀伤作用的重要介质,当ROS水平失去平衡时,就会对机体造成损伤〔18〕。本研究显示,RTN1-C干预可有效缓解脑卒中大鼠脑损伤,表明其作用机制可能是通过改善脑梗死大鼠体内SOD、MDA、ROS水平,抑制脑卒中大鼠体内氧化应激反应的发生有关。
Nogo-A在抑制神经细胞的迁移和扩散、阻止轴突再生和脑卒中后轴突重建方面具有重要作用〔19〕。RhoA是Rho蛋白家族的成员之一,活化的RhoA可导致成纤维细胞肌动蛋白应力纤维的形成,进而导致轴突的回缩和生长锥的塌陷。有研究表明〔20〕,可通过抑制RhoA蛋白的过度活化,改善脑卒中大鼠的认知功能和记忆能力,促进神经突轴的重塑。ROCK2可通过磷酸化肌球蛋白轻链,使突触前和突触后的细胞骨架蛋白解聚,进而抑制中枢神经系统损伤后轴突生长,促进突触的重塑,高水平的Nogo-A、RhoA、ROCK2在脑卒中大鼠中可限制轴突的生长和神经的可塑性〔21〕。本研究结果显示,RTN1-C干预可通过调控Nogo-A、RhoA、ROCK2通路蛋白水平来改善大鼠的认知功能和记忆能力。
综上,RTN1-C干预通过调控Nogo-A、RhoA、ROCK2通路蛋白、SOD、MDA、ROS水平,可改善脑卒中大鼠的认知功能、抑制氧化反应的发生,进而提高大鼠四肢抓握能力和协调能力,降低大鼠的血脑屏障通透性、脑梗死率,提高脑血流灌流量,增加大脑皮层完整神经元的数目。
