茶树尿卟啉原脱羧酶基因CsHEME2的克隆与生物信息学分析
2021-06-09高羲之张晨禹陈建姣易晓芹李云飞陈佳豪沈程文
高羲之,张晨禹,陈建姣,易晓芹,李云飞,陈佳豪,沈程文
湖南农业大学 园艺学院/茶学教育部重点实验室/国家植物功能成分利用工程技术研究中心,湖南 长沙 410128
茶树 [Camellia sinensis (L.) O. Kuntze]是我国重要的经济作物。据中国茶叶流通协会统计,2019年我国18个主要产茶省(自治区、直辖市)茶园面积为306.52万hm2,干毛茶产量为279.34万t,干毛茶总产值达到2396亿元[1]。伴随着近十年工业化的高速发展,我国酸雨问题日益严重,已成为继欧洲和北美之后世界第三大酸雨区,中国降水年均pH值小于5.6的面积约占国土面积的40%,长江中下游以南地区至少50%以上的面积降水年均pH值小于4.5,为酸雨重污染区[2]。尽管2018年酸雨发生面积相比2003年减少97万km2[3],但酸雨仍是不可忽视的严重环境问题。茶树虽属喜酸性木本植物,但强酸性土壤对茶树的生长和茶叶品质仍会造成严重影响[4]。我国茶树种植区大多受到酸雨的污染,探究茶树的抗酸雨胁迫机制具有重要意义。
叶绿素是绿色植物叶绿体内最重要的色素之一,参与光合作用,具有捕获光能及吸收与传递光量子的功能。有研究表明,轻度酸雨胁迫促进茶树叶绿素的合成,而在重度酸雨胁迫下叶绿素含量降低,进而影响光合作用[5]。叶绿素生物合成可分为15步反应,主要包括两大部分:L-谷氨酰-tRNA→原卟啉Ⅸ(proto Ⅸ)和原卟啉Ⅸ(proto Ⅸ)→叶绿素[6]。尿卟啉原脱羧酶参与第一部分的生物合成,由HEME1和HEME2基因编码,是叶绿素生物合成的关键酶。目前国内外对HEME2基因的研究仍十分稀缺,有待进一步的发现。
本试验在模拟酸雨胁迫茶树幼苗成熟叶片转录组测序的基础上,通过分析转录组测序数据,在转录水平上初步探索了茶树对酸雨胁迫的应答机制,筛选出了HEME2基因,通过RTPCR技术克隆其CDS区全长序列并对其进行生物信息学分析,同时采用qRT-PCR技术对酸雨处理叶和正常叶基因表达差异进行分析,旨在为后续抗酸性茶树新品种筛选和培育提供理论依据。
1 材料与方法
1.1 试验材料与处理
试验使用的材料为模拟酸雨胁迫处理的一年生茶树品种湘妃翠幼苗。从湖南省长沙县高桥镇茶苗繁育基地将茶树幼苗移栽至湖南省长沙市湖南农业大学耘园实验基地(北纬28°18′12″,东经 113°07′61″),置于通风遮顶塑料大棚内。采用装有红壤的塑料花盆(底直径18 cm,口直径 23 cm,高 25 cm)以盆栽方式进行培养,培育期间浇灌自来水并补充定量肥料。茶苗长势正常后分为处理组和对照组,设置处理组pH=2.5,对照组pH=6.5,采用浓硫酸与浓硝酸4:1混合配制成酸雨母液,稀释至相应pH值,采用便携式pH计调节pH值,依据长沙地区年平均降水量进行酸雨喷淋,每4 d一次,每盆450 mL,全株喷淋。处理两个月(2018年4月19日至6月19日),于2018年6月采摘成熟叶片作为供试材料,放入-80℃冰箱保存备用。
1.2 叶绿素含量测定
按卢翠报道的方法测定[7]。
1.3 抗氧化酶活性测定
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性,分别使用科铭生物的SOD活性检测试剂盒(SOD-1-Y)、POD活性检测试剂盒(POD-1-Y)、CAT活性检测试剂盒(CAT-1-Y)和APX活性检测试剂盒(APX-1-W)检测。
1.4 总RNA提取和cDNA合成
将供试材料用液氮研磨后取 0.1 ~ 0.2 g,采 用 TIANGEN 的 RNAprep Pure Plant Kit (Polysaccharides & Polyphenolics-rich) 试 剂 盒提取茶树总RNA,RNA完整性通过1%琼脂糖凝胶电泳检测,浓度和纯度使用Nano-Drop 2000超微量分光光度计测定,于-80℃冰箱保存备用。 采用TaKaRa的PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒反转录合成cDNA。
1.5 CsHEME2 基因 CDS 区克隆
根据转录组测序数据(登录号:PRJNA 575691)得到CsHEME2基因CDS区序列,引物设计和合成由湖南擎科生物技术有限公司完成(表1)。50 μL RT-PCR扩增体系为:I-5TM 25High-Fidelity Master Mix 25.0 μL, 上 游 引 物2.0 μL,下游引物 2.0 μL,模板 DNA 1.0 μL,ddH2O 20.0 μL,总体积 50.0 μL。PCR 扩增反应条件:98℃变性 10 s,56℃退火 15 s,72℃延伸 10 s,35 个循环;72℃延伸 5 min。PCR 产物经1%琼脂糖凝胶电泳验证后切胶回收,将回收产物连接至载体 pClone 007 Blunt Vector(擎科生物),转入大肠杆菌Trelief TM 5e感受态细胞(擎科生物),37℃培养箱倒置过夜培养。挑取白色阳性单克隆菌落扩大培养,挑选3个阳性克隆菌液送至湖南擎科生物技术有限公司 测序。

表1 引物序列Table 1 Primer sequences
1.6 CsHEME2 基因生物信息学分析
通过在线分析工具Protparam和Protscale[8]对CsHEME2基因进行理化性质和亲/疏水性分析, 通 过 SignalP[9]、ChloroP[10]和 TargetP[11]进行信号肽、叶绿体转运肽预测和亚细胞定位预测,通过TMHMM和Netphos[12]进行蛋白质跨膜结构和磷酸化位点预测,通过SOPMA[13]和Phyre2[14]模拟CsHEME2基因编码蛋白质二级和三级结构,通过BLAST工具分析CsHEME2基因与其他物种氨基酸序列同源性,并用DNAMAN与其它16种植物进行多重氨基酸序列比对,通过MEGA 7.0采用邻位连接法(Neighbor-joining,NJ)构建系统进化树。
1.7 CsHEME2 基因表达差异分析
根据克隆测序所得的CsHEME2基因CDS区全长序列设计qRT-PCR引物qCsHEME2-F和qCsHEME2-R(表1),引物由湖南擎科生物技术有限公司合成,所使用的内参基因为β-actin(表 1)。使用 TaKaRa 的 TB Green®Premix Ex Taq™(Tli RNaseH Plus)试剂盒检测CsHEME2基因的表达水平。20 μL荧光定量PCR反应体 系 为:TB GreenPremix Ex Taq(Tli RNaseH Plus)(2X)10.0 μL,ROX Reference Dye II (50X)0.4 μL,上游引物 0.4 μL,下游引物 0.4 μL,ddH2O 6.8 μL,模板 DNA 2.0 μL,总体积 20.0 μL。配置完成后在Rotor-Gene Q实时荧光定量PCR分析仪上检测CsHEME2基因表达,反应程序为:95℃ 30 s,60℃ 30 s,72℃ 20 s,45 个循环。使用Excel 2016按照[15]算法进行计算。
2 结果与分析
2.1 CsHEME2基因CDS区的克隆及序列分析
通过RT-PCR技术克隆获得约1200 bp的目的片段(图1),片段大小基本上符合预期,可以确定克隆所得的目的片段为CsHEME2基因CDS区。该序列全长共1182 bp,编码393个氨基酸残基,含有起始密码子ATG和终止密码子TAA(图2)。
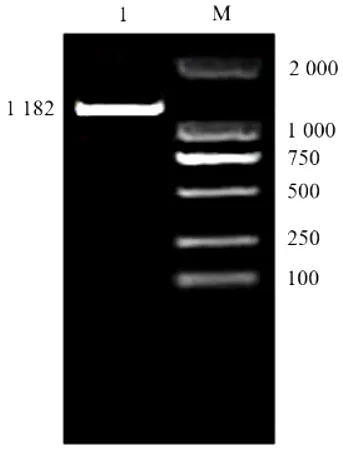
图1 CsHEME2基因电泳图Figure 1 Elctrophoretogram of CsHEME2
2.2 CsHEME2 基因生物信息学分析
2.2.1 理化性质及亲/疏水性
通过在线工具Protparam分析表明,CsHEME2蛋白的原子组成为C1957H3084N516O563S10,分子质量约为43.17 kDa,理论等电点(pI)约为 6.73 < 7,为酸性蛋白。CsHEME2蛋白共含有20种基本氨基酸残基,其中缬氨酸Val(V)的含量最高,占10.7%;半胱氨酸Cys(C)的含量最低,占0.8%。在393个氨基酸残基中,共含有40个负电荷氨基酸(Asp + Glu)和39个正电荷氨基酸(Arg + Lys)(图2)。该蛋白水溶液在280 nm处的消光系数为35535,脂肪族氨基酸指数为96.90,不稳定指数为37.28,为稳定蛋白。在体外哺乳动物网织红细胞中的半衰期为30 h,在酵母体内大于20 h,在大肠杆菌内大于10 h。其亲水性平均系数(GRAVY)为 0.017 > 0,属于疏水蛋白。
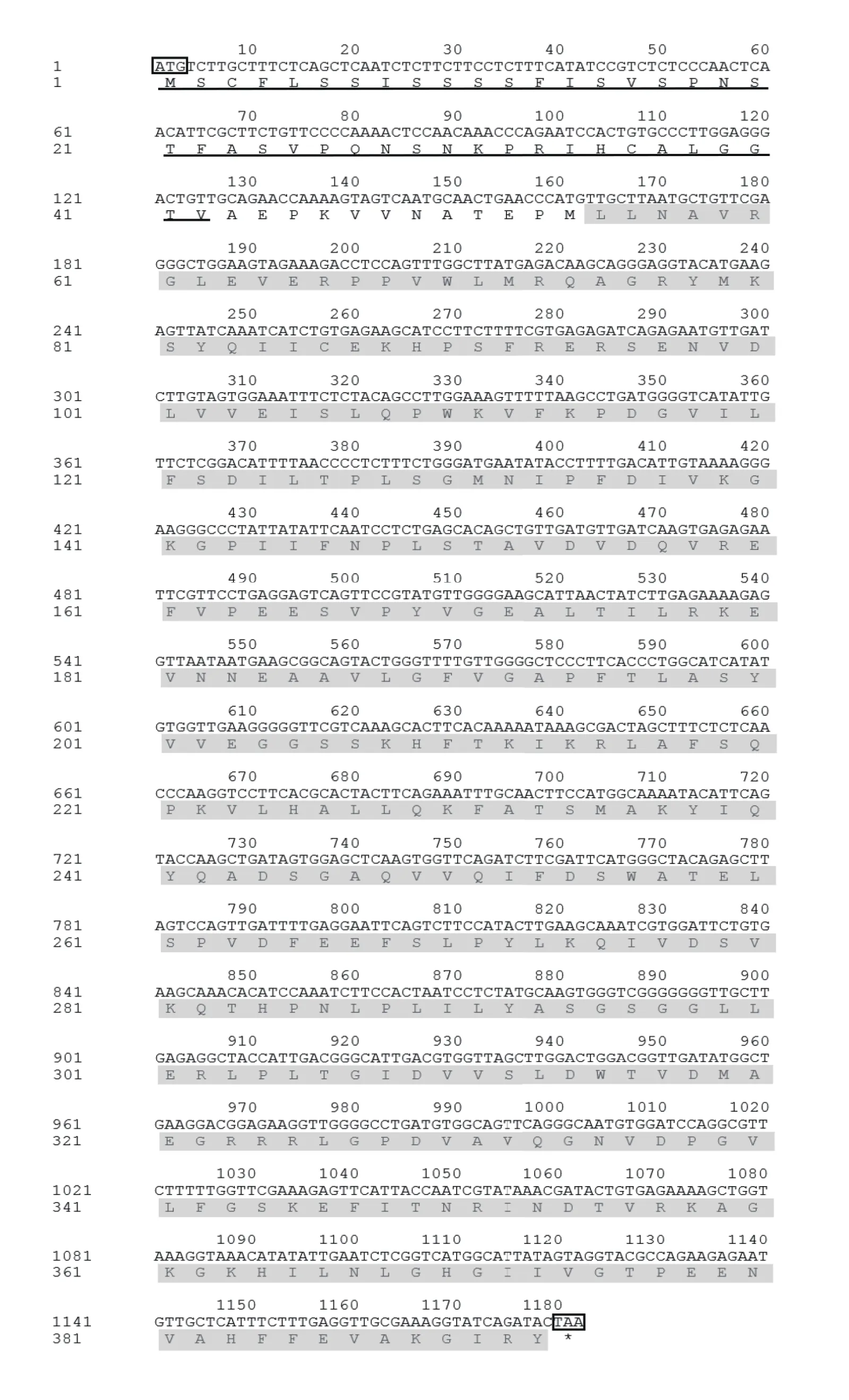
图2 CsHEME2基因CDS区核苷酸序列和推导氨基酸序列Figure 2 Nucleotide sequence and deduced amino acid sequence of CsHEME2 gene CDS region
根据在线软件Protscale预测结果显示,位于CsHEME2蛋白肽链上第91位的色氨酸Ser(S)具有最低的分值-2.522,亲水性最弱;位于第189位的甘氨酸Gly(G)具有最高的分值2.178,疏水性最强(图3)。但从整体上看,CsHEME2蛋白肽链上疏水性氨基酸较亲水性氨基酸多,说明该蛋白为疏水性蛋白。
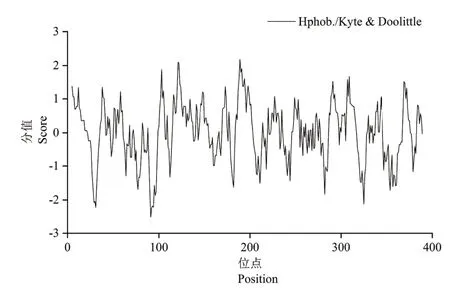
图3 CsHEME2蛋白的亲水性/疏水性预测Figure 3 Hydrophilic / hydrophobic analysis of CsHEME2 protein
2.2.2 信号肽、叶绿体转运肽及亚细胞定位预测
信号肽用于指导蛋白质的跨膜转移,信号肽行使完功能后其自身的序列在信号肽酶的作用下被切除[16]。SignalP预测结果显示,CsHEME2蛋白的多肽链无信号肽属于非分泌蛋白(图4)。ChloroP预测结果显示,CsHEME2蛋白存在叶绿体转运肽剪切位点,位于第43个氨基酸,含有叶绿体转运肽(图2)。TargetP预测结果显示CsHEME2蛋白定位于叶绿体,这与信号肽预测结果一致,可以推测CsHEME2蛋白在游离的核糖体中合成后需要转运到叶绿体上发挥作用。

图4 CsHEME2蛋白信号肽预测Figure 4 Signal peptide prediction of CsHEME2 protein
2.2.3 跨膜结构域及磷酸化位点预测
跨膜结构域是细胞膜中蛋白与膜脂相结合的主要部位,一般由约20个疏水性氨基酸残基组成形成α-螺旋,它固着在细胞膜上起“锚定”作用[17]。根据预测结果,蛋白质可分为跨膜蛋白和非跨膜蛋白。TMHMM预测结果如图5所示,CsHEME2蛋白各氨基酸位点处于膜外的概率极接近1,可信度较高,这表明CsHEME2蛋白整条多肽链位于细胞膜外,不存在跨膜区,说明该蛋白属于非跨膜蛋白。磷酸化是常见的蛋白质翻译后修饰类型,它在调节蛋白质活性、结构和功能等方面发挥着重要作用。Netphos预测结果(图6)显示,该蛋白含有36个可能发生磷酸化的位点,其中包括24个丝氨酸(Ser)位点、9个苏氨酸(Thr)位点以及3个酪氨酸(Tyr)位点。

图5 CsHEME2蛋白的跨膜结构域预测Figure 5 Transmembrane domain prediction of CsHEME2 protein
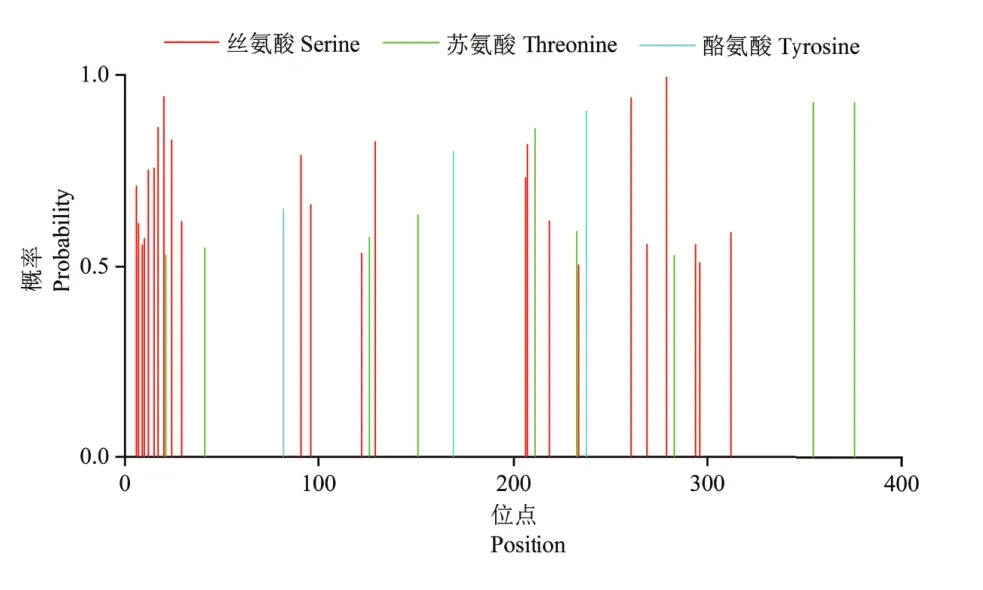
图6 CsHEME2蛋白质磷酸化位点预测Figure 6 Phosphorylation sites prediction of CsHEME2 protein
2.2.4 二、三级结构及蛋白功能域预测
蛋白质二级结构是指多肽链的氨基酸残基借助氢键折叠和盘绕形成的结构,包括α-螺旋、β-折叠、β-转角、延伸链和无规则卷曲等[18]。SOPMA预测结果显示该蛋白包含4种二级结构形式,其中α-螺旋占39.19%,是CsHEME2蛋白最主要的二级结构;其次无规则卷曲、延伸链和β-转角分别占35.62%、18.32%和6.87%,不存在β-折叠(图7-A)。Phyre2预测结果如图7-B所示,CsHEME2蛋白质三级结构多由α-螺旋和无规则卷曲构成,这与二级结构预测的结果相符,并且HEME2蛋白质三级结构模型与其模板d1j93a的相似性高达90%,说明所预测的结构较可靠。
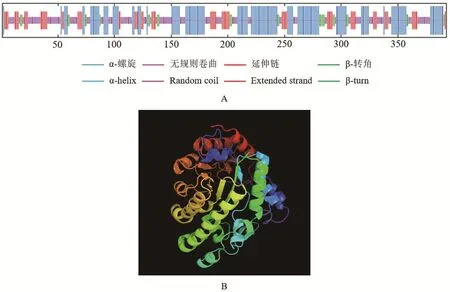
图7 CsHEME2蛋白质的二级和三级结构预测Figure 7 Secondary structure and tertiary structure prediction of CsHEME2 protein
使用NCBI网站中的在线工具CD-Search预测CsHEME2蛋白结构域,结果如图8所示。CsHEME2含有PLN02433保守结构域(图2),属于URO-D_CIMS_like超家族;PLN02433含有6个活性位点(Active site),分别位于CsHEME2蛋白多肽链上第73位(R)、第77位(R)、第123位(D)、第200位(Y)、第255位(S)和第370位(H)氨基酸,另外还含有26个底物结合位点(Substrate binding site)。
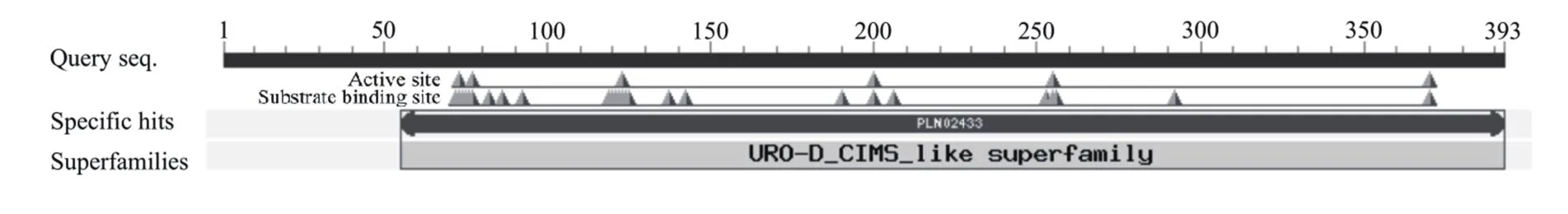
图8 CsHEME2蛋白质功能域预测Figure 8 Functional domains prediction of CsHEME2
2.2.5 多重氨基酸序列比对及进化树分析
利用NCBI网站的Blastp在线分析茶树CsHEME2基因编码蛋白质的氨基酸序列与其它物种的氨基酸同源性,结果显示,中华猕猴桃、葡萄和核桃等7种植物与CsHEME2基因氨基酸序列同源性达到了90%以上,CsHEME2基因氨基酸序列与模式植物拟南芥AtHEME2基因的氨基酸同源性达到79%、与‘舒茶早’茶树CsHEME2基因的氨基酸同源性达到98%。通过DNAMAN对CsHEME2基因氨基酸序列和16个与其氨基酸同源性较高的物种进行多重氨基酸序列比对(图9),可以发现,这16个物种均含有PLN02433保守结构域以及该结构域所含的活性位点和底物结合位点。使用MEGA7.0软件采用内置的邻位连接法构建系统进化树(图10),结果表明整体聚为两大类,各类再分为多个小类;其中茶树和中华猕猴桃聚为一类,亲缘关系最近,这可能与茶树和中华猕猴桃同源性较高有关;木薯和橡胶树聚为一类,属于大戟科植物;胡杨和毛果杨聚为一类,属于杨柳科植物;西葫芦、黄瓜和甜瓜聚为一类,属于葫芦科植物。不同科之间的物种也有较近的亲缘关系,如胡桃科的核桃和木棉科的榴莲,以及茜草科的小果咖啡和茄科的番茄等。
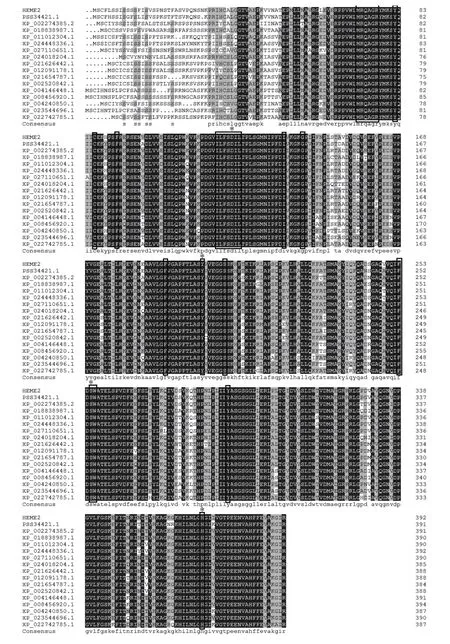
图9 HEME2多序列比对Figure 9 Multiple sequence alignment of HEME2
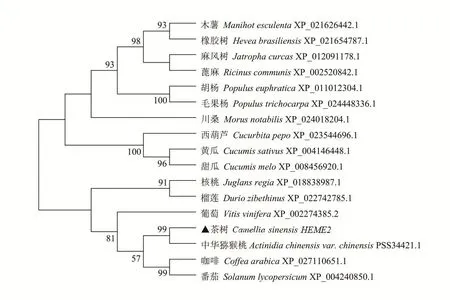
图10 不同植物间HEME2基因系统进化树Figure 10 Polygenetic tree of HEME2 from different plants
2.3 CsHEME2 基因表达差异分析
利用qRT-PCR技术检测了本试验克隆的CsHEME2基因在模拟酸雨胁迫处理叶片和正常叶片中的表达水平(图11),结果显示该基因在模拟酸雨胁迫处理叶片中的相对表达量比在正常叶片中高并存在极显著差异,这与转录组数据相符[19]。叶绿素含量测定的结果显示(表2),酸雨叶片中的叶绿素a、叶绿素b和叶绿素a/b含量均比正常叶片低,且存在极显著差异,结合qRT-PCR结果可推测CsHEME2基因对叶绿素的生物合成是负反馈调节。

图11 CsHEME2在不同叶片中的表达差异分析Figure 11 Analysis of differential expression of CsHEME2 in different leaves

表2 模拟酸雨对茶树幼苗叶片叶绿素含量的影响(平均值±标准差)Table 2 Effects of simulated acid rain on chlorophyll content in leaves of tea seedlings (mean value ± standard deviation)
2.4 抗氧化酶活性分析
SOD、POD、CAT、APX均是植物细胞内具有的重要抗氧化酶,在植物抗逆生理中起着关键作用,当植物处于逆境时,抗氧化酶对维持植物正常生长有着十分密切的关系。如图12所示,四种抗氧化酶活性在pH值2.5的酸雨胁迫下都显著提高,表明酸雨胁迫触发了茶树的防御机制以抵抗胁迫。

图12 模拟酸雨对茶树幼苗叶片抗氧化酶活性的影响Figure 12 Effects of simulated acid rain on antioxidant enzyme activities in leaves of tea seedling
3 讨论
HEME2基因广泛存在于植物、真菌及细菌中,是四吡咯代谢的关键酶基因,与叶绿素合成及血红素的合成有关。但是,近年来国内外对HEME2基因的研究较少。本试验以茶树为材料,克隆了CsHEME2基因,并分别进行了生物信息学分析和表达分析。
试验通过RT-PCR技术克隆了CsHEME2基因CDS区,序列全长共1182 bp,编码393个氨基酸残基,通过生物信息学分析发现其编码的氨基酸具有植物HEME2的PLN02433保守结构域,并含有此结构域特有的活性位点和底物结合位点;多序列比对显示CsHEME2与中华猕猴桃、葡萄和核桃等7种植物HEME2氨基酸序列同源性达到了90%以上,与“舒茶早”茶树品种的CsHEME2基因的氨基酸同源性达到98%,试验所克隆的基因属于植物HEME家族成员。进化树分析结果显示,茶树和中华猕猴桃聚为一类,亲缘关系最近,这可能与茶树和中华猕猴桃同源性较高以及同属于山茶目植物有关,表明HEME2在近似物种中具有较高的保守性,这与王希希[20]和闫菲[21]等的研究结果相似。对蛋白结构的分析结果表明,CsHEME2蛋白属于酸性疏水蛋白,含有叶绿体转运肽,主要在叶绿体中发挥作用,表明四吡咯代谢的部分反应可能在叶绿体中进行。
转录组测序结果显示,在卟啉和叶绿素代谢通路中只有编码尿卟啉原脱羧酶的HEME1和HEME2基因出现差异表达并且表达上调,并通过qRT-PCR验证显示HEME2在酸雨叶片的相对表达量比在正常叶片中高,结合叶绿素含量测定结果可推测HEME2基因的转录表达受酸雨胁迫诱导,表达上调并负反馈调节叶绿素的生物合成,使叶绿素含量下降;同时也有研究表明,质体中增加的四吡咯代谢中间产物可以触发整个细胞的抗氧化反应[22],尿卟啉原脱羧酶在叶绿素合成通路中催化尿卟啉原Ⅲ转化为粪卟啉原Ⅲ,酸雨胁迫下尿卟啉原脱羧酶受到抑制,导致四吡咯中间体尿卟啉原III(Uroporphyrinogen III)的过度积累,尿卟啉原III作为一种强光敏剂很容易被光激发,如果不及时淬灭,可能会导致形成剧毒的自由基和单线态氧[23],使细胞遭受损伤,但同时四吡咯中间体的积累触发了细胞保护和防御机制[22],这与本试验结果一致,四种抗氧化酶活性在模拟酸雨胁迫下都显著提高,推测尿卟啉原III的积累使茶树对模拟酸雨胁迫产生了氧化应激以抵抗胁迫。综上,可以推测HEME2基因在响应酸雨胁迫中发挥一定的作用。
本试验采用RT-PCR方法对茶树HEME2基因CDS区进行克隆,初步探索了茶树中HEME2基因的表达和对酸雨胁迫的响应并进行了生物信息学分析,为进一步研究该基因在茶树酸雨胁迫中的功能奠定基础。有关HEME家族基因的深入分析和功能鉴定,还有待进一步深入研究,可通过亚细胞定位、基因沉默技术和转基因等方法实现。
