侵染青霉菌猕猴桃生理品质与电学特性相关性研究
2021-06-09罗安伟黄天姿
罗安伟 王 丹 梁 锦 黄天姿 张 璐
(西北农林科技大学食品与工程学院,陕西杨凌 712100)
0 引言
我国是猕猴桃生产大国,主要分为美味、中华和软枣猕猴桃三大品系[1]。其中,中华系中的红阳猕猴桃口感独特、风味鲜美,且富含维生素C、蛋白质、氨基酸、糖类、有机酸等多种有机物以及人体所必需的多种矿物质[2-4],具有极高的药用价值和保健功能,深受大众喜爱[5]。但是,由于其多汁浆果的属性,在运输和贮藏过程中极易发生机械损伤,从而引起霉菌侵染[6]。青霉病是猕猴桃贮藏期最常见的微生物病害之一[7],猕猴桃感染扩展青霉菌后会产生有毒且具有致畸、致癌、致突变等毒理作用[8]的次级代谢产物展青霉素,这严重威胁消费者的健康,对猕猴桃品质管控也提出了更高要求。
果实内部是一个由大量带电粒子形成的生物电场[9]。果实采收后,随着组织细胞代谢活动的继续进行,各类化学物质所带电荷量和电荷的空间分布随之发生变化,生物电场的分布和强度也随之改变[10]。因此,在果实贮藏过程中除了发生生化反应,还会引发宏观电学特性的改变,这为利用电学特性对果实品质进行无损检测奠定了理论基础。电学检测由于具有快速、灵敏、无损,且操作简便、费用低等特点,而成为新的研究热点。近年来,国内外已有苹果[11]、芒果[12]、枣类[13]、猕猴桃[14]等生理特性和电学特性的相关性研究。文献[15]研究了梨的介电特性、生理特性以及内部品质的相关性,并建立了数学回归方程,证明介电常数可以反映果实的品质。文献[16]通过测定葡萄贮藏期间的电学参数与质地特性,建立了电学参数与品质特性之间的数学模型,证明了利用电学特性反映果实生理特性的可行性。目前,利用电学特性对果实病害进行无损检测的研究还较少,文献[17]基于电学特性进行了苹果水心病的无损检测,但是关于侵染青霉菌猕猴桃果实的电学特性和品质特性的相关性研究尚未见报道。
本文以陕西省主栽品种红阳猕猴桃为实验材料,研究贮藏期内侵染青霉菌后的猕猴桃生理、品质指标的变化规律及其与电学参数的相关性,建立品质、生理指标与电参数之间的数学模型,以期为基于电学特性的猕猴桃青霉病无损检测提供理论依据。
1 材料与方法
1.1 材料与试剂
实验材料为红阳猕猴桃,于2019年9月10日采收于陕西省眉县猕猴桃基地(北纬34°29′,东经107°76′)。可溶性固形物质量分数(SSC)6.5%~6.8%,果实单果质量为(85±10)g。挑选出600个形状相近、大小均匀、无病虫害和机械损伤的果实。采收后置于阴凉处24 h散去田间热备用。
扩展青霉菌:从感染青霉病的腐烂猕猴桃上分离并且经过分子生物学鉴定得到,于马铃薯琼脂培养基上纯化、扩培,孢子用15 mL无菌水收集后,用血球计数板计数,制成菌体浓度为1×106CFU/mL的孢子悬浮液[18]。
氢氧化钠、偏磷酸、乙二胺四乙酸(EDTA)、L-抗坏血酸、L-苯丙氨酸、三氯乙酸、硫代巴比妥酸(广东省化学试剂工程技术研究开发中心);维生素C标准品(纯度98%以上,上海阿拉丁生化科技股份有限公司)。
1.2 仪器与设备
IM 3536型 LCR仪(日本HIOKI公司)、TA.XT PLUS/50型物性测定仪(英国Stable Micro Systems公司)、LC-20A型高效液相色谱仪(岛津企业管理中国有限公司)、N6000型双光束紫外分光光度计(上海佑科仪器仪表有限公司)、HC-3018R高速冷冻离心机(安徽中佳科学仪器有限公司)、PAL-1型数显糖度计(日本ATAGO公司)。
1.3 方法
1.3.1样品预处理
红阳猕猴桃散去田间热后,用质量分数为1%的次氯酸钠溶液浸泡2 min,用无菌水清洗3次,自然条件下晾干。晾干后的猕猴桃分成对照组和青霉侵染组,每组300个猕猴桃。两组猕猴桃均用直径1 mm的消毒牙签在猕猴桃赤道部位均匀扎4个深度为4 mm的小孔[19]。
对照组在小孔中注射15 μL无菌水;青霉侵染组注射15 μL菌体浓度为1×106CFU/mL的扩展青霉孢子悬浮液,模拟果实受到扩展青霉侵染,注射完成后自然晾干。用厚度为0.03 mm的聚乙烯包装袋装好后放入塑料筐中,于0~1℃、相对湿度90%~95%的冷库中贮藏。贮藏过程中每15 d取样进行测定。
对照组猕猴桃果实贮藏时间为135 d;青霉侵染组猕猴桃由于霉菌侵染加快了果实软化腐烂,贮藏期为75 d。
1.3.2品质指标测定
质量损失率:无菌水对照组和青霉侵染组分别固定20个猕猴桃果实,相同条件下贮藏。每15 d进行称量,计算质量损失率。
硬度:每组随机取5个猕猴桃果实,沿果实赤道部位120°等距离取3点,均匀地削去果皮。采用TA.XT PLUS/50型物性测定仪在TPA模式下,使用P2型探头进行穿刺测试,测试速率为1 mm/s[20],单位为kg/cm2。
可溶性固形物含量(SSC):随机取5个猕猴桃,削皮去芯后榨汁,4层纱布过滤后取汁,用数显糖度计进行测定,每个果实重复测定3次[21]。
可滴定酸(TA)含量:采用酸碱滴定法测定。称取10 g猕猴桃果肉,置于研钵中研磨至匀浆,蒸馏水定容至100 mL,8 000 r/min 转速下离心10 min后,取10 mL上清液用0.1 mol/L的NaOH进行滴定。折算系数以柠檬酸计算[22]。
维生素C含量:采用高效液相色谱法,色谱柱条件:Inertsil/Wondasil C18柱(4.6 mm×150 mm,5 μm);流动相为0.1%偏磷酸溶液与甲醇(体积比96∶4);流速1.0 mL/min;样品体积10 μL;检测波长243 nm[23]。随机挑选9个猕猴桃,任意3个猕猴桃果肉混匀作为一份样品。取20 g混匀的果肉并加入20 mL 0.1%的偏磷酸溶液用匀浆机打成匀浆,在10 000 r/min的条件下离心15 min,取5 mL上清液于25 mL容量瓶中用0.1%的偏磷酸溶液定容,摇匀后用孔径0.22 μm的微孔滤膜过滤至样品瓶中待用。标准溶液的制备:准确称取维生素C标准品0.1 g于烧杯中,用0.1%偏磷酸溶液溶解,转移至100 mL棕色容量瓶中并定容至刻度,得到质量浓度为1 000 μg/mL的标准储备液。测试前再用标准储备液配制质量浓度分别为10、20、50、100、200、400、800 μg/mL的维生素C标准溶液。
1.3.3生理指标测定
酶提取液制备:取3 g猕猴桃果肉置于经过预冷的研钵中,加入3 mL提取缓冲液后研磨至匀浆。将匀浆转移至离心管中,4℃、12 000g离心30 min,离心后的上清液即为酶提取液。
β-1,3-葡聚糖酶(GLU)活性:100 μL酶液加入100 μL昆布多糖溶液,置于37℃恒温水浴锅中保温40 min,保温结束后加入1.8 mL蒸馏水和1.5 mL 3,5-二硝基水杨酸(DNS)试剂,再沸水浴3 min,用蒸馏水稀释至25 mL,测定在540 nm处的吸光度。以同等体积煮沸的酶液作为对照[24]。
过氧化氢酶(CAT)活性:0.1 mL酶提取液混入2.9 mL H2O2溶液,以蒸馏水为参比,在反应15 s时开始记录反应液在240 nm波长处的吸光度作为初始值,每隔30 s记录一次,获取6个点的数据[25]。
苯丙氨酸解氨酶(PAL)活性:0.5 mL酶提取液中加入3 mL 50 mmol/L硼酸缓冲液和0.5 mL 20 mmol/L L-苯丙氨酸溶液。置于37℃水浴锅保温60 min,保温结束后立即加入0.1 mL 6 mol/L的盐酸终止反应,在波长为290 nm处测定吸光度。
丙二醛(MDA)含量:2.0 mL提取液加入2.0 mL 0.67%的硫代巴比妥酸溶液后沸水浴20 min,再分别于450、532、600 nm波长处测定吸光度[26-27]。
每个指标平行测定3个样本,每个样本重复测定3次。各品质、生理指标测定时,均选取果实病斑外1 cm处果肉进行测定。
1.3.4发病率及病情指数测定
发病率:根据十字交叉法,使用游标卡尺测定果实病斑直径,当果实病斑直径大于0.50 mm时判定为发病果实,发病果实个数占果实总个数的百分比即为发病率。
病情指数计算公式为
式中c——染病级数
n——该级病果数
N——接种总果数
C——最高染病级数
对猕猴桃的染病程度进行分级,无发病症状果实的染病级数为0;病斑面积占全果面积的1/3以下果实的染病级数为1;病斑面积占全果面积的1/3~1/2果实的染病级数为3;病斑面积占全果面积的1/2~3/4果实的染病级数为5;病斑面积占全果面积的3/4以上果实的染病级数为7。
1.3.5电学参数测定
采用IM 3536 型LCR仪,在100 Hz~3.98 MHz频率范围内连续测量了193个频率点(193个频率点的选取为LCR仪在设定的频率范围内自动连续测定的频率点)下的阻抗Z、阻抗相位角θ、等效串联电阻Rs、等效串联电容Cs、损耗系数D、电导G、电抗X、等效串联电感Ls、等效并联电感Lp、介电常数ε共10个电学参数。测试前通过开路补偿和短路补偿的方式对测量仪器进行校准,电压为1 V,两个平行电极板间压力为0.5 N,探头采用L2001型4端子探头。对照组和处理组猕猴桃每15 d分别随机取样30个果实,待测猕猴桃果实从冷库中取出后,放置于实验室内平衡至室温(25℃左右)。温度平衡结束后,将猕猴桃果实置于平行电极板间,在果实赤道部位120°等距离测定3次,测试时上下电极板接触果面应避开病斑。
1.4 数据处理
采用Origin 8.5软件制图,并用SPSS 18.0软件进行方差分析、相关性分析和主成分分析,实验结果表示为平均值±标准差。P<0.05表示差异性显著。
2 结果与分析
2.1 贮藏期猕猴桃品质指标、生理指标的变化
图1为猕猴桃贮藏期间各品质、生理指标的变化规律。
如图1所示,猕猴桃的质量损失率随贮藏期的延长呈现逐渐增加的趋势,贮藏末期青霉侵染组果实质量损失率达到了6.90%,而此时对照组质量损失率为4.90%。水分是猕猴桃中最重要的组成成分,占比高达80%以上,果肉组织中的水分通常分为游离水和束缚水两种形态[28],其中游离水主要参与各类生理化学反应而容易消耗,也是影响电学参数变化的主要因素之一。青霉侵染组的失水速率明显高于无菌水对照组,主要是由于青霉菌的侵染和繁殖加快了果实内部的营养物质消耗和蒸腾作用等代谢活动[29],也可能是由于青霉菌破坏了细胞结构,导致细胞内部胶体微粒周围的束缚水变成游离水而丧失。
贮藏期内,猕猴桃果实硬度均呈逐渐下降的趋势,60 d以后趋于稳定,且青霉侵染组的硬度明显低于无菌水对照组,在30 d时差异显著(P<0.05)。果实硬度是衡量果实新鲜度的重要指标之一,主要与细胞壁构成成分、细胞内组成、细胞间结合度等多种因素密切相关。猕猴桃侵染扩展青霉菌后硬度下降加快主要是由于细胞壁酶引起的细胞壁和中胶层果胶水解加快[30],细胞内各组分和结构发生显著变化,从而导致生物电场的变化,最终表现为宏观电学特性的改变。
果实的SSC呈现先逐渐上升后稍有下降的趋势。侵染青霉菌的猕猴桃果实变化速率较快,在60 d时SSC达到最高值15.92%后稍有下降,而对照组果实在60 d时SSC为14.73%。SSC能直接地反映果实的成熟状态和品质。果实采后,淀粉酶等糖转化酶活性增强,不断地将淀粉转化为可溶性糖[31],因此SSC逐渐升高。但是伴随着这种转化的发生,果实后熟加快,后期转化的可溶性糖不足以补充呼吸消耗,从而导致SSC在贮藏末期呈降低的趋势。
猕猴桃果实中TA含量均呈现逐渐下降的趋势。在75 d时,无菌水对照组和青霉侵染组分别降低了0.35%和0.39%,青霉侵染组TA含量明显低于对照组。果实的糖酸比是衡量果实风味的重要指标,因此可滴定酸含量可以反映果实品质。有机酸作为呼吸代谢的底物之一[32],随着果实的成熟衰老,有机酸逐渐被消耗。
在猕猴桃贮藏期间维生素C含量呈现出不断下降的趋势。在75 d时,无菌水对照组果实维生素C含量在贮藏期内从质量比85.65 mg/(100g)降低至59.63 mg/(100g),而青霉侵染组果实维生素C含量在贮藏末期降低至质量比41.21 mg/(100g)。维生素C是猕猴桃最重要的营养物质之一,因此是衡量其品质的主要指标。维生素C含量降低主要是由于酶的分解以及自然条件下的氧化分解作用[33]。猕猴桃侵染青霉菌后,各种代谢反应的加剧导致维生素C损失速率更快。
无菌水对照组和青霉侵染组果实的CAT活性均呈现出先逐渐上升后下降的趋势,且同时在45 d时达到峰值,分别为231.60 U/g和266.97 U/g。整个贮藏期间,侵染青霉菌的猕猴桃果实CAT活性明显高于未发病果实(P<0.05)。CAT是属于一种可以催化植物体内过氧化氢分解为水和分子氧的血红蛋白酶[34],所以其活性高低也会引起内部组织成分的变化从而引起果实电学特性的变化。
贮藏期内无菌水对照组和青霉侵染组猕猴桃果实的GLU活性逐渐上升后稍有下降,分别在90 d和60 d达到峰值,分别为209.7 U/g和211.9 U/g。30 d以后,青霉侵染组的GLU活性显著高于对照组(P<0.05)。GLU能破坏真菌的细胞壁,从而增强果实的抗病性,因此在被真菌侵染以后其含量会显著提高。
贮藏期内无菌水对照组和青霉侵染组猕猴桃果实的PAL活性变化趋势一致,同时在15 d和60 d时达到两个峰值,其中侵染青霉果实的PAL活性最高,达342.01 U/g,但是只在60 d时有显著差异(P<0.05)。PAL是苯丙烷代谢的关键酶,与植物的抗病性密切相关,因此在发病严重时显著升高。
无菌水对照组和青霉侵染组的MDA含量在贮藏期内都呈现逐渐上升后稍有下降的趋势,分别在120 d和60 d达到峰值。贮藏后期,感染青霉菌的猕猴桃丙二醛含量显著高于对照组(P<0.05)。丙二醛是在果实成熟衰老过程中膜脂过氧化的主要产物[35],影响细胞膜的通透性,所以也是可以间接反映果实品质的指标。
2.2 贮藏期发病率及病情指数的变化
如图2所示,随着贮藏期的延长,无菌水对照组和青霉侵染组果实均在15 d时开始发病,且发病率呈逐渐升高的趋势,青霉侵染组的发病率显著高于无菌水对照组(P<0.05)。无菌水对照组在15 d时发病率仅为10%,在90 d时全部发病;青霉侵染组在15 d时发病率为30%,在30 d时全部发病。无菌水对照组和青霉侵染组果实病情指数也随着贮藏期延长而逐渐增大,且青霉侵染组的病情指数显著高于无菌水对照组(P<0.05)。青霉侵染组猕猴桃果实在75 d时病情指数达到最大,最大值为74.29,发病程度较重,此时无菌水对照组病情指数为13.81。
2.3 猕猴桃品质指标、生理指标和电参数的相关性
如图3所示,随着频率的增大,无菌水对照组果实的Z与质量损失率、SSC、GLU活性、PAL活性、MDA质量摩尔浓度呈现出由正相关变为负相关的变化趋势,与硬度、TA质量分数、维生素C质量比则相反,与CAT活性则一直呈正相关。Lp、X、Ls与质量损失率、SSC、GLU活性、PAL活性、MDA质量摩尔浓度呈现出先负相关后正相关的变化趋势,与硬度、TA质量分数、维生素C质量比则相反,与CAT活性一直呈负相关。Cs与质量损失率、PAL活性、MDA质量摩尔浓度先呈负相关后变为正相关,与TA质量分数、维生素C质量比则呈现先正相关后负相关的趋势,与硬度一直呈正相关,和SSC、CAT活性、GLU活性则相反。Rs、ε、θ、G、D与硬度、TA质量分数、维生素C质量比一直呈正相关,与质量损失率、SSC、GLU活性、PAL活性、MDA质量摩尔浓度呈现出负相关。综合分析,Rs与TA质量分数、GLU活性在频率3 956.5 kHz处呈极显著相关(P<0.01),绝对值最大的相关系数分别为0.762 3和-0.802。
如图4所示,随着频率的增大,青霉侵染组果实的Z与质量损失率、CAT活性一直呈正相关关系,与硬度、TA质量分数、维生素C质量比的相关性呈现出先负后正的变化趋势,与SSC、GLU活性、PAL活性、MDA质量摩尔浓度的相关性则呈现出先正后负的变化趋势。Ls、Lp、X与硬度、维生素C质量比先呈正相关后变为负相关,与SSC、CAT活性、GLU活性、MDA质量摩尔浓度先呈负相关后呈正相关,与PAL活性一直呈正相关。D、ε、G与硬度呈先负后正的相关性,和SSC、PAL活性则相反。θ、Rs与质量损失率、SSC、GLU活性、MDA质量摩尔浓度一直呈负相关,与硬度、维生素C质量比则一直呈正相关。Cs与质量损失率、CAT活性、GLU活性、PAL活性、MDA质量摩尔浓度呈现先正后负的相关性,与维生素C质量比则相反,与硬度、TA质量分数则一直呈负相关,与SSC一直呈正相关。综合比较,GLU活性、PAL活性、MDA质量摩尔浓度、维生素C质量比在251 Hz处与Cs呈显著相关(P<0.05),TA质量分数在251 Hz处与Cs呈极显著相关(P<0.01),绝对值最大的相关系数为-0.925 1。
2.4 特征频率的筛选
采用主成分分析法,将无菌水对照组和青霉侵染组猕猴桃在100 Hz~3.98 MHz所有频率点下电参数与品质及生理指标构成的相关系数矩阵进行综合分析,筛选出特征频率。结果发现,无菌水对照组猕猴桃质量损失率、SSC与电参数相关性指数最大的频率点均在3 980 kHz处,TA含量、CAT活性与电参数相关指数最大的频率点为100 Hz,GLU活性、MDA含量与电参数相关指数最大的频率点为3 956.5 kHz,硬度、维生素C含量、PAL活性与电参数相关指数最大均出现在频率点158 Hz处。青霉侵染组猕猴桃质量损失率、CAT活性与电参数相关性最强的频率点为3 932.9 kHz,硬度、TA含量与电参数相关性最强的频率点为3 250 kHz,GLU活性、PAL活性、MDA含量与电参数相关性最强的频率点均为251 Hz,SSC、维生素C含量与电参数相关性最强的频率点分别为398 Hz、141.4 kHz。主成分分析的结果表明,各品质、生理指标与电参数相关性最好的点已经找到,但是最佳测试频率并未统一。因此,将各品质和生理参数与电参数形成的相关指数矩阵进一步进行主成分分析,根据主成分因子得分,并计算其综合相关指数(ICI)。如表1和表2所示,无菌水对照组猕猴桃在3 956.5 kHz处综合相关指数排名第一,而青霉侵染组猕猴桃在251 Hz处综合相关指数最高,所以其特征频率分别为3 956.5 kHz和251 Hz。
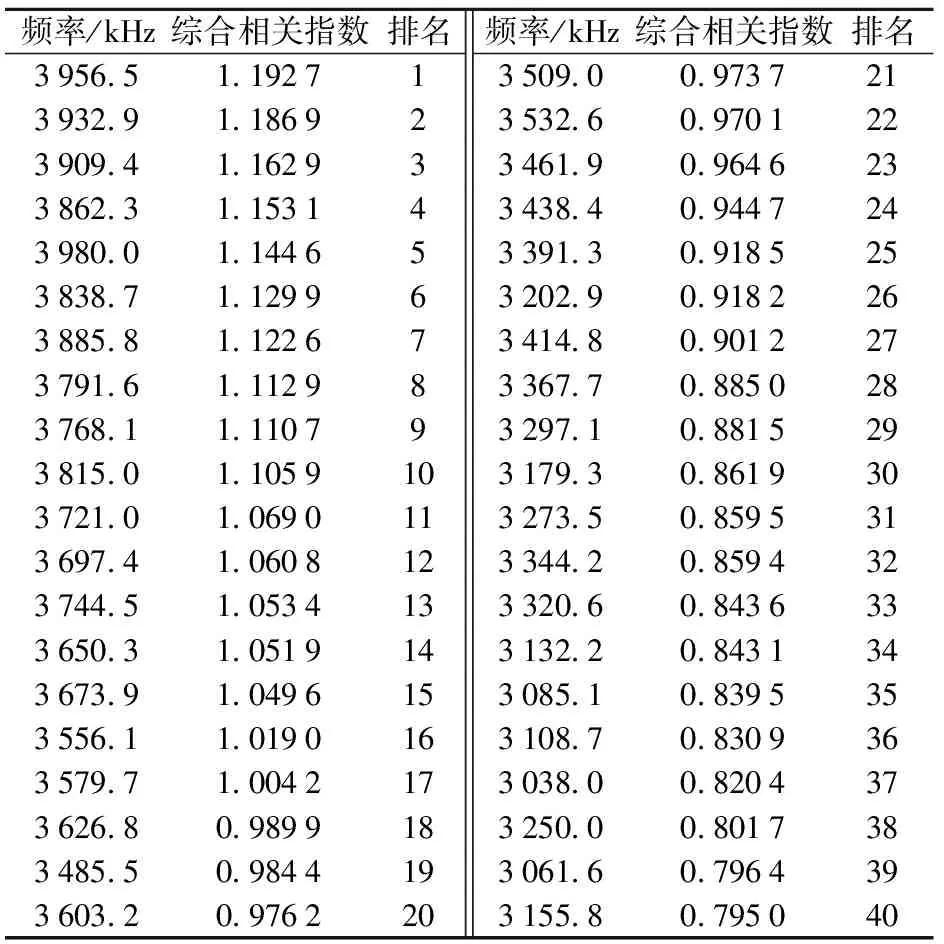
表1 无菌水对照组猕猴桃在不同频率下电参数与品质、生理指标综合相关指数排名
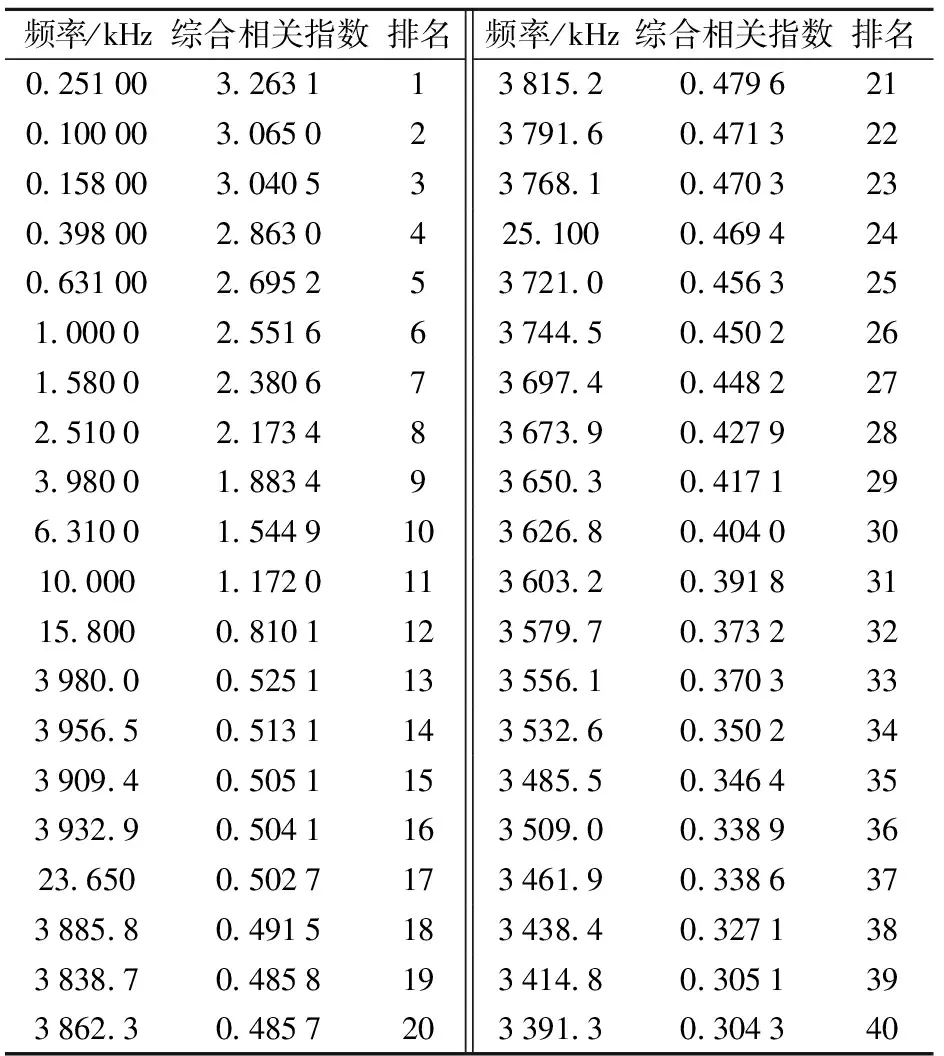
表2 青霉侵染组猕猴桃在不同频率下电参数与品质、生理指标综合相关指数排名
2.5 敏感电参数的筛选
敏感电参数是指在筛选出的特征频率下,将各品质、生理指标与电参数进行相关分析,进一步筛选出两者间相关性最强的电学参数,即可作为无损检测猕猴桃青霉病的电学指标。
如表3所示,在特征频率3 956.5 kHz下,无菌水对照组猕猴桃的θ与SSC、TA质量分数、GLU活性分别呈显著相关;D与硬度、SSC、TA质量分数、GLU活性呈显著相关;ε与硬度、SSC、GLU活性、PAL活性呈显著相关;Rs与质量损失率、硬度、SSC呈显著相关,与TA质量分数、GLU活性呈极显著相关(P<0.01),绝对值最大的相关系数为-0.802 0,综合分析比较,选取Rs作为其敏感电参数,将GLU活性与特征频率下的Rs进行多元回归,回归方程为
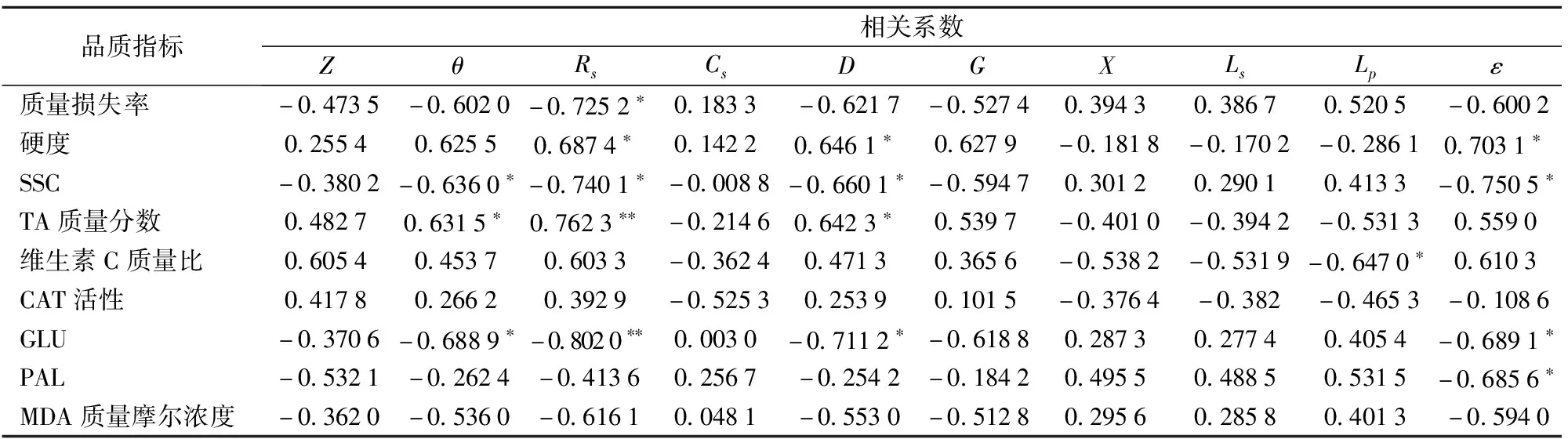
表3 无菌水对照组猕猴桃在特征频率下品质、生理指标与电参数的相关性
YGLU=-3.287 4Rs+250.32 (R2=0.820 3)
如表4所示,在特征频率251 Hz下,青霉侵染组猕猴桃θ与质量损失率呈极显著相关(P<0.01),相关系数为-0.904 4;ε分别与TA质量分数、GLU活性呈显著相关;D、X、Ls、Lp均与质量损失率呈显著相关,Cs分别与维生素C质量比、GLU活性、PAL活性和MDA质量摩尔浓度呈显著相关,与TA质量分数呈极显著相关,绝对值最大的相关系数为-0.925 1,综合分析,选取Cs作为其敏感电参数,将TA质量分数与特征频率下的Cs进行多元回归,回归方程为
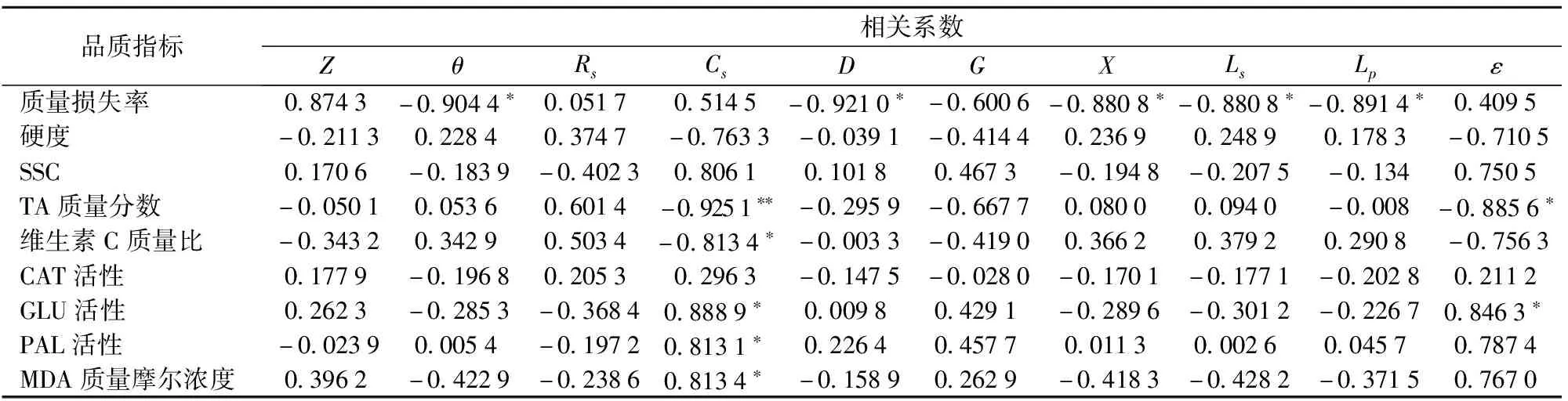
表4 青霉侵染组猕猴桃在特征频率下品质与电参数的相关性
YTA=-5×107Cs+1.264 3 (R2=0.855 8)
通过标准化残差分析,残差值均在(-2,2)之间,说明可以用Cs预测红阳猕猴桃采后贮藏期青霉病果实的TA含量,从而预测其果实品质。根据实际测得的TA含量,贮藏期在15~45 d的果实,无菌水对照组TA质量分数范围为1.27%~1.14%,对应的Cs为1.66×10-9~2.49×10-9F,青霉侵染组TA质量分数范围为0.99%~1.27%,对应的Cs为5.15×10-9~5.49×10-9F;贮藏期在45~75 d的果实,无菌水对照组TA质量分数范围为0.92%~1.14%,对应的Cs为2.49×10-9~6.80×10-9F。青霉侵染组TA质量分数范围为0.89%~0.99%,对应的Cs为5.49×10-9~7.55×10-9F。由此可知,可将其分为2个检测基准,贮藏期为0~45 d时,Cs大于5.15×10-9F时判定为青霉病果实,选取30个正常果实和30个发病果实进行验证实验,在特征频率下测定其Cs,结果显示识别率达83%;贮藏期为45~75 d时,无菌水对照组和青霉侵染组的Cs范围出现部分重叠,差异不够显著,若界定Cs大于6.80×10-9F时判定为青霉病果实,选取30个正常果实和30个发病果实进行验证实验,结果显示识别率只有72%。
3 讨论
果实作为植物的器官之一,采后仍然是一个生命体,其本身属于电介质。猕猴桃果实的电学特性与其内部组分以及结构两方面紧密相关[36],但是由于果实中大部分是自由水,而水又在果实成熟衰老过程中参与绝大部分生化反应,因此也与果实中自由水含量和亚细胞结构息息相关。随着贮藏期延长,一方面由于果实的呼吸和蒸腾作用导致自由水渐渐减少,另一方面,细胞自溶作用的发生会导致内部细胞结构逐渐解体,以及不溶性物质比如淀粉等逐渐转化为可溶性糖,也会明显引起果实结构和电学特性的变化。由于感染青霉病果实的TA含量和SSC降低明显较多,电解质虽然会减少,但是由于抗性相关酶活性显著增强,标志细胞膜降解、膜透性增大的MDA含量快速上升,电解质会大量向细胞外渗透,使得组织内部疏松程度比正常果实更高,而且细胞衰亡的速度也快于正常果实,结果表现为电导性反而增强,这与文献[37]的研究结论一致。正常果实和侵染青霉菌果实的电特性的差异,也证明了可以利用电学特性对侵染青霉菌猕猴桃果实进行无损检测的可行性。
结合果实生理变化的过程,揭示了果实物理变化的内在机理,这对猕猴桃采后生理的研究以及病害防控都具有重要理论意义。但是,本研究只是对侵染青霉菌猕猴桃生理、品质特性与电学特性相关性进行初步理论研究,只是为实现电学特性的猕猴桃青霉病无损检测提供前期的理论依据,也为其他果实的病害电学无损检测研究打开了新思路。在此贮藏期间,猕猴桃果实虽已表现出发病症状,但是由于本实验中是采用人为刺伤接种的方式,所以发病程度会表现得比果实在自然情况下发病更为严重,自然情况下发病时间会相对较晚,所以该方法仍然具有区分发病果实和健康果果实的潜在应用价值。但是,在45 d后识别效果不佳,并且也有研究结果表示使用电学参数表征单一的相关品质或者生理指标不具有普遍性[17],若能同时找到与电参数相关性较强的多个品质或生理指标,才能更好地实现基于电学检测猕猴桃青霉病果实的实际应用。因此,建立准确性更高的一元多次线性方程,是未来研究的方向,在生产中具有广阔的应用前景。
4 结论
(1)猕猴桃果实在贮藏期间的质量损失率、SSC呈逐渐上升的趋势,硬度、TA含量、维生素C含量呈逐渐下降的趋势,抗性相关酶活性也呈逐渐上升后稍有下降的趋势。与无菌水对照组相比,青霉侵染组猕猴桃品质指标的下降速度明显高于对照组,果实内抗性相关酶活性也明显高于对照组。
(2)通过分析品质、生理指标和电参数之间的相关性,筛选出对照组和青霉菌侵染组猕猴桃果实的特征频率分别为3 956.5 kHz和251 Hz,敏感电参数分别为Rs和Cs,数学回归方程分别为YGLU=-3.287 4Rs+250.32、YTA=-5×107Cs+1.264 3,完善了可用于表征猕猴桃果实品质以及病害检测的特征频率和敏感电参数体系。所得数学模型在贮藏期为15~45 d时准确度较高,验证试验显示识别率可达83%,45 d后的识别率只有72%。
