肾母细胞瘤治疗研究进展
2021-06-09综述审校
洪 博 综述 董 瑞 审校
肾母细胞瘤又名Wilms肿瘤,占小儿肾脏恶性肿瘤的90%以上[1]。目前肾母细胞瘤的病因尚不明确,可能与调节泌尿生殖道正常胚胎发育的基因突变有关[2]。大多数患者以可触及的腹部肿块为首发症状[3],部分患者出现血尿、发热、尿路感染、精索静脉曲张、高血压或低血压、贫血等症状[2]。目前,肾母细胞瘤的治疗方式是多学科联合治疗,包括手术治疗、化学治疗、放射治疗、靶向治疗等,整体治愈率约90%[1-3]。本文检索国内外肾母细胞瘤治疗相关文献,对现有的以及潜在的治疗方法进行综述。
一、手术治疗
手术切除是肾母细胞瘤最主要的治疗方法,目前手术方式主要有常规的肾切除手术、肾单位保留手术(nephron-sparing surgery,NSS)以及腹腔镜手术(laparoscopic surgery,LS)。
肾切除手术是针对单侧肾母细胞瘤(unilateral Wilms tumor,UWT)的标准外科手术,若肿瘤周围浸润,还需切除肾上腺[4]。NSS是治疗肾母细胞瘤易感综合征、双侧肾母细胞瘤(bilateral Wilms tumor,BWT)或孤立性肾单位肾母细胞瘤的标准手术方法,未来可能是优化肿瘤控制和保持肾功能的最佳选择[4-6]。NSS还适用于极少数UWT患者,欧洲国际儿科肿瘤学会(International Society for Pediatric Oncology,SIOP)最新指南严格定义了UWT患者的NSS适应证:单灶性肿瘤局限于肾脏的一极,肿瘤体积<300 mL;术前肿瘤无破裂,无沿静脉扩散或其他局部扩散;有足够的健康肾组织残余,能保证手术后肾脏维持正常功能[3]。NSS需要在术前对肾母细胞瘤进行计算机断层扫描(computed tomography,CT)精准确定肿瘤位置,以在完全切除肿瘤组织的同时最大限度保留肾组织;在术中可以用缝合线缝合肾实质切面上的特定出血点、用氩气束凝固肾实质表面进行止血,必要时还可以短暂封闭血管止血[6]。这些都要凭借医生的经验进行,目前还没有NSS临床治疗指南。
常规手术创伤大、恢复慢、并发症多,而LS具有创伤较小、疼痛轻等优势。一项针对肾母细胞瘤的回顾性研究表明,LS与开放式手术的生存率差别无统计学意义,但采用LS治疗的患者住院时间较短,表明LS可能是一种更加安全有效的肿瘤切除方法[7]。LS主要用于肾切除术,但越来越多的研究开始转向LS在NSS中的应用。目前LS已经成功应用于BWT患者的肾单位保留手术[8]。LS最先进方式——机器人辅助技术也已成功应用于BWT患者的肾单位保留手术[9]。
但LS仍有一些问题需要解决,如手术适应证、术前是否化疗等。SIOP已经计划对肾母细胞瘤中LS的应用进行前瞻性研究[10,11]。
二、化疗
化疗方式主要包括术前化疗和术后化疗。目前,肾切除术前是否应该进行化疗仍存在争议。美国儿童肿瘤学组(Children’s Oncology Group,COG)主张直接手术切除,理由是可以提前准确评估肿瘤分期,利于后续治疗;SIOP主张术前进行新辅助化疗,理由是可以降低手术过程中肿瘤破裂的风险,从而降低复发的可能性,COG、SIOP正在进行大型临床试验以确定两种方案的适应证[12]。从现有研究结果来看,对于Ⅰ期、Ⅱ期肾母细胞瘤患者可直接手术,Ⅲ期、Ⅳ期、Ⅴ期患者在术前进行化疗可取得更好的临床结局[13]。目前NSS术前进行辅助化疗被大家公认,争议在于术前化疗方案的选择,术前化疗方案包括SIOP-93指南和AREN0534研究两种[5]。两种方案的区别在于化疗的频率和持续时间。目前研究发现,AREN0534研究比SIOP-93指南能更有效地缩小肿瘤体积,从而提高NSS的成功率,然而该研究样本量较少,说服力有限[14]。
目前推荐的术后化疗方案主要有6个,分别为方案EE-4A、方案I[15]、方案DD-4A、方案M、方案UH-1、方案UH-2(6个方案化疗强度按此排列顺序依次增高)[16]。依据COG临床实验结果、中国抗癌协会小儿肿瘤专业委员会2016年发布的儿童Wilms肿瘤诊断治疗建议(CCCG-WT-2016)[17],各化疗方案适应人群及是否联合术后放疗见表1。
表1中治疗方案的内容及适应人群主要来自美国国家肾母细胞瘤研究组(National Wilms Tumor Study Group,NWTSG)合并成为COG前的5次临床试验及其合并后的临床试验,属于经验规律。上述治疗方案的内容及其适应人群可能会随着新的临床试验而发生变化。例如在NWTS-1临床试验之前长春新碱和放线菌素会被单独用于治疗肾母细胞瘤,但NWTS-1证实两药组合使用更有效,之后在此基础上形成了方案EE-4A[12]。类似这种变化还有很多,最新改变如下:CCCG-WT-2016总结Ⅱ期预后良好组织类型肾母细胞瘤(favorable histology Wilms tumor,FHWT)、Ⅲ期FHWT 5年无瘤生存率均为78%,因此建议Ⅱ期FHWT患者治疗方案由EE-4A改为DD-4A,Ⅲ期FHWT患者经6周化疗反应不佳时采用方案M;CCCG-WT-2016发现我国双侧肾母细胞瘤预后差,因此应尽量进行NSS,化疗方案强度也应增加至足够保证肿瘤消退程度以满足外科进行NSS的条件[17]。
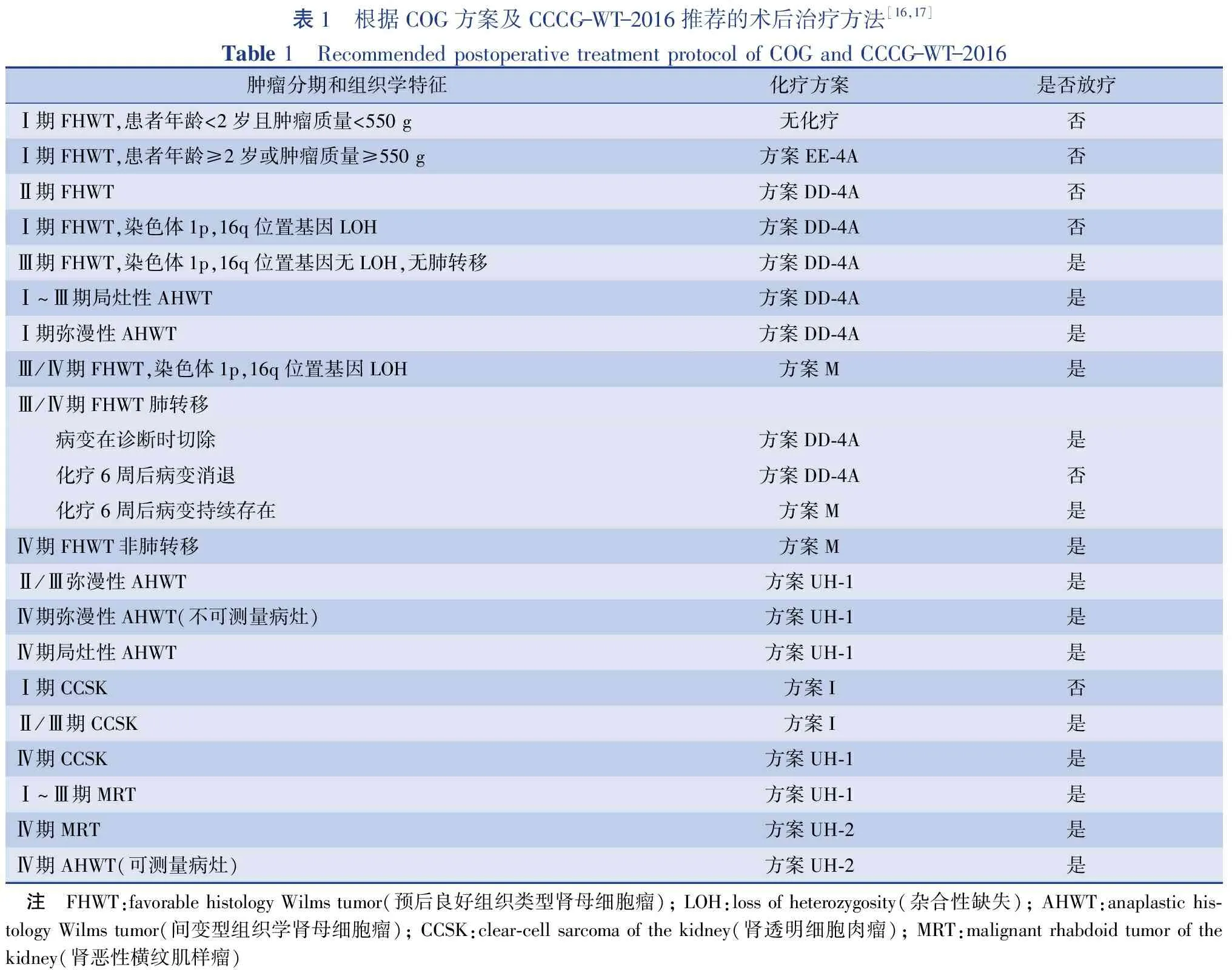
表1 根据COG方案及CCCG-WT-2016推荐的术后治疗方法[16,17]Table 1 Recommended postoperative treatment protocol of COG and CCCG-WT-2016肿瘤分期和组织学特征化疗方案是否放疗Ⅰ期FHWT,患者年龄<2岁且肿瘤质量<550 g无化疗否Ⅰ期FHWT,患者年龄≥2岁或肿瘤质量≥550 g方案EE-4A否Ⅱ期FHWT方案DD-4A否Ⅰ期FHWT,染色体1p,16q位置基因LOH方案DD-4A否Ⅲ期FHWT,染色体1p,16q位置基因无LOH,无肺转移方案DD-4A是Ⅰ~Ⅲ期局灶性AHWT方案DD-4A是Ⅰ期弥漫性AHWT方案DD-4A是Ⅲ/Ⅳ期FHWT,染色体1p,16q位置基因LOH方案M是Ⅲ/Ⅳ期FHWT肺转移 病变在诊断时切除方案DD-4A是 化疗6周后病变消退方案DD-4A否 化疗6周后病变持续存在方案M是Ⅳ期FHWT非肺转移方案M是Ⅱ/Ⅲ弥漫性AHWT方案UH-1是Ⅳ期弥漫性AHWT(不可测量病灶)方案UH-1是Ⅳ期局灶性AHWT方案UH-1是Ⅰ期CCSK方案I否Ⅱ/Ⅲ期CCSK方案I是Ⅳ期CCSK方案UH-1是Ⅰ~Ⅲ期MRT方案UH-1是Ⅳ期MRT方案UH-2是Ⅳ期AHWT(可测量病灶)方案UH-2是 注 FHWT:favorable histology Wilms tumor(预后良好组织类型肾母细胞瘤); LOH:loss of heterozygosity(杂合性缺失); AHWT:anaplastic his-tology Wilms tumor(间变型组织学肾母细胞瘤); CCSK:clear-cell sarcoma of the kidney(肾透明细胞肉瘤); MRT:malignant rhabdoid tumor of the kidney(肾恶性横纹肌样瘤)
许多临床研究表明化学药物治疗与其他治疗方式联合使用,可以改善肾母细胞瘤的治疗效果(表2)。这样一方面可通过降低化疗药物的使用剂量而减轻其副作用,另一方面化学药物治疗与其他治疗方式联合使用可能成为未来治疗肾母细胞瘤的新型化疗方式。

表2 常规化疗和其他治疗方式联合使用治疗肾母细胞瘤的效果Table 2 Efficacies of conventional chemotherapeutics plus other therapies for wilms tumor化学药物治疗其他治疗方式联合使用效果长春新碱、放线菌素D1,3-顺式维甲酸2例BWT患者分别治疗结束后的46个月和81个月内,均状态良好,无复发迹象[18]。长春新碱、伊立替康贝伐单抗该药物组合在所有治疗伴有弥漫性变形的复发肾母细胞瘤患者的药物组合中,副作用最小,效果最好[19]。长春新碱穿心莲内酯穿心莲内酯可通过PI3K-AKT-p53信号通路促进长春新碱诱导的肾母细胞瘤SK-NEP-1细胞死亡,改善长春新碱的化疗效果[20]。CDDPPar-4Par4过表达和顺铂可通过协同作用抑制肾母细胞瘤SK-NEP-1细胞生长,诱导细胞凋亡[21]。CDDP静磁场、极低频磁场二者具有协同作用,静磁场、极低频磁场可增强顺铂的抗肿瘤效力,降低其副作用,而体内短期MF暴露所引起的副作用可忽略不计[22]。CDDPSTAT3STAT3和CDDP组合可显著抑制体内肾母细胞瘤肿瘤细胞的生长,作用机制可能是STAT3通过GRP78上调BAX蛋白表达,进而增强肾母细胞瘤细胞对CDDP的敏感性[23]。 注 Par-4:prostate apoptosis response 4(前列腺细胞凋亡反应4); STAT3:signal transducer and activator of transcription 3(信号转导和转录激活因子3); MF:static and extremely low frequency magnetic fields(静磁场、极低频磁场); CDDP:cisplatin(顺铂); GRP78:glucose-regulated protein 78(葡萄糖调节蛋白78); BAX:BCL2-associated X protein(BCL2相关的X蛋白)
三、放疗
现代精准放疗技术在肾母细胞瘤治疗中应用很少,主要是由于儿童处于生长发育期,将较大体积的正常组织持续暴露于低剂量放射线,易发生病变[24];不过流行病学研究尚未发现放疗诱发第二恶性肿瘤的证据[25]。随着精准放疗技术的更新,肿瘤周围器官放射剂量持续降低,相信放疗在肾母细胞瘤治疗中的使用会有所增加。
目前,在铅笔束扫描质子治疗中,质子传递系统和治疗目标的运动为放射剂量分布增加了不确定因素,易对肿瘤周围正常组织造成不利影响;利用自由呼吸CT和4D-CT双重成像,可解决运动对放射剂量分布产生的不良影响[26]。另外,结合CT与旋转容积调强放疗,可降低心脏放射剂量,可能解决放疗期间心脏放射剂量过量的问题;现有病例结果显示在20个月的随访期内未发现心脏病变[25],也预示这一方法可能是安全有效的。而利用磁共振成像引导调强放疗与锥形束CT引导的旋转容积调强放疗相比,可在保持放疗目标覆盖率的基础上再次降低肿瘤周围正常组织的剂量[27]。
四、靶向治疗
靶向治疗是指针对癌细胞的特定特征的治疗,与化疗及放疗相比,其副作用较少[28]。目前靶向药物的研究从作用机制来看,主要分为以下几类:
1. 抑制胰岛素样生长因子(insulin-like growth factor 2,IGF-2)信号途径:IGF2信号途径与肾母细胞瘤发展密切相关,IGF2受体IGF1R是目前认为最可行的治疗靶点,通过使用与翻译起始位点互补的反义寡核苷酸靶向IGF1R mRNA阻止IGF1R表达、小分子抑制剂或单克隆抗体阻断IGF1R与其配体之间的相互作用,可以抑制肾母细胞瘤肿瘤细胞系生长。目前处于临床研发阶段的药物有IGF1R抑制剂BMS-754807、NVP-AEW541等。BMS-754807是一种ATP竞争性小分子,在肾母细胞瘤小鼠异种移植模型中使用,可显著抑制肿瘤生长;NVP-AEW541应用于肾母细胞瘤,可同时抑制IGF2下游MAPK信号途径以及细胞周期控制基因CCNA2和CCNB1表达,抑制肿瘤生长。最新研究显示,IGF1R不需要其他物质激活,即可直接作为酪氨酸激酶在IGF通路中发挥作用,这表明同时使用针对IGF1R的单克隆抗体和小分子抑制剂进行联合靶向治疗可能更有效[29]。
2. 抗血管生成治疗:肿瘤的快速生长发育需要血管生成迅速,非肿瘤部位则血管生长缓慢甚至不增殖。因此,血管生成在肿瘤的发展转移过程中起到重要作用,抑制这一过程可显著阻止肿瘤组织的发展、扩散和转移。
血管内皮生长因子(vascular endothelial growth factor,VEGF)/血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)是抗血管生成治疗中最常用的靶点。VEGF是一种已知的诱导血管生成的因子,以VEGFR为靶点的抗血管生成治疗被广泛用于癌症治疗。其中,VEGF-A是诱导内皮细胞增殖和血管生成的研究最为透彻的因子[30]。肾母细胞瘤血清和组织中VEGF-A的表达与预后不良相关,这为抗血管生成治疗奠定了理论基础[31];VEGF-A通过激活两种受体VEGFR-1和VEGFR-2来调节血管生成和血管通透性[32]。Apatinib是一种小分子抗血管生成剂,它可以选择性结合并抑制VEGFR-2的激酶活性,从而减少VEGF介导的肿瘤内皮细胞迁移、增殖,进而降低肿瘤微血管密度,抑制肾母细胞瘤生长。目前已经上市或者在临床试验阶段的VEGF/VEGFR途径抑制剂有贝伐单抗、AZD2171等[31]。
抗血管生成治疗还可能存在其他靶向途径。VEGF在肾母细胞瘤中过表达,但是表达的VEGF亚型由VEGF前体的剪切方式决定。在肿瘤血管内皮细胞中, Wilms肿瘤抑制因子1(wilms tumor suppressor 1,WT1)可激活丝氨酸/富含精氨酸的蛋白特异性剪接因子激酶1(serine/arginine-rich protein-specific splicing factor kinase 1,SRPK1)和丝氨酸/富含精氨酸的剪接因子1(serine-threonine kinase,mechanistic target of rapamycin,SRSF1)活性,进而诱导VEGF的促血管生成亚型的表达;而敲除WT1基因可降低内皮细胞中WT1、SRPK1和SRSF1的表达,进而诱导VEGF的抗血管生成的亚型VEGF120表达[30]。因此WT1基因可以作为抗血管生成治疗的一个潜在靶向位点。
3. 抑制磷脂酰肌醇3-激酶(phosphatidylinositol-3 kinase,PI3K)/丝氨酸苏氨酸激酶(serine-threonine kinase,AKT)/哺乳动物雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)信号通路:目前已经开发出多种针对PI3K及其亚型、蛋白激酶B/AKT、mTOR等通路蛋白的抑制剂,其中Buparlisib是最先进的靶向PI3K及其亚型的抑制剂,应用于PI3K途径改变的人肿瘤细胞系,可抑制肿瘤细胞增殖,促进肿瘤细胞凋亡;在PIK3CA基因突变的人肿瘤小鼠异种移植模型中使用,可显著抑制肿瘤生长甚至使肿瘤消退;然而Buparlisib毒性较强,因此针对它的研究主要集中在如何减轻其毒性作用。目前靶向通路蛋白的抑制剂,只有mTORC1的变构抑制剂如依维莫司和坦西莫司被批准用于临床[33]。
靶向治疗不仅可以直接靶向抑制该途径中的通路蛋白,还可以靶向抑制通路蛋白的调控因子、通路的上游激活基因以及miRNA。已有研究表明磷酸酶和张力蛋白同源物(PTEN)/PTEN假基因(PTENP1)、KRAS和miR-8916,可分别成为潜在的调控因子、激活基因和miRNA靶向位点。PTEN是PI3K的负性调控因子,通过在肌醇环的d3位将磷脂酰肌醇3,4,5-三磷酸去磷酸化,形成磷脂酰肌醇4,5-二磷酸,直接拮抗PI3K的作用;PTEN的丧失或失活将导致RTK/PI3K/Akt信号传导的过度激活,从而导致肿瘤发生;PTENP1的转录产物可以竞争性结合与PTEN转录产物RNA结合以阻碍其表达的miRNA,实验证明,抑制PTENP1转录可降低PTEN的表达[34]。KRAS是一类原癌基因,在肾母细胞瘤肿瘤细胞中,RAS基因突变后可以与β-连环蛋白共同激活PI3K/AKT信号通路,进而促进肾母细胞瘤肿瘤细胞的增殖、迁移和侵袭,以及肿瘤生长和肺转移[35]。遗憾的是,目前还没有发现可以靶向上述位点的分子,不过已经有研究发现红景天甙可通过下调miR-891b抑制核因子κB和PI3K/AKT/mTOR信号通路,进而抑制肾母细胞瘤细胞的生长和转移,一些研究也在试图解释红景天苷药理作用的潜在机制[36]。未来红景天苷可能会成为抑制PI3K/AKT/mTOR信号通路的药物研发上的一个突破。
除上述已经应用于药物研发的靶向位点外,还有一些潜在的靶向位点,如KCNQ1OT1基因[37]、神经细胞粘附分子[38]、缺氧诱导因子-1α[39]等。这些潜在的靶向位点为后续的药物研发提供了新的方向。
五、免疫治疗
肿瘤免疫治疗是指通过重新启动和维持肿瘤免疫周期,恢复甚至增强机体正常的抗肿瘤免疫反应来控制和消除肿瘤的一种治疗方法。肾母细胞瘤免疫治疗研究主要有两类:环氧合酶-2( cyclooxygenase-2,COX-2)途径[40]和自体淋巴细胞移植[41]。.
1. 抑制COX-2途径:COX-2是前列腺素的两种同工酶之一,在人肾母细胞瘤的炎症微环境中高表达。通过敲除WT1基因和上调IGF2基因表达在小鼠模型中模拟人肿瘤微环境,观察COX-2通路组分在小鼠模型中的表达,结果显示COX-2通路组分在小鼠模型中高表达;肿瘤中免疫抑制细胞如调节性树突状细胞和调节性T细胞的浸润增加,诱导浸润的趋化因子高表达;免疫抑制细胞因子如白细胞介素-10和转化生长因子-β在小鼠模型中上调。以上证据表明COX-2途径在免疫抑制细胞的浸润、免疫抑制因子表达上调过程中发挥重要作用。因此,靶向COX-2可以抑制肿瘤免疫逃逸,发挥抗肿瘤作用[40]。
2. 自体淋巴细胞移植:自体淋巴细胞移植在肾母细胞瘤中的应用尚处于动物实验阶段。通过皮下植入肾母细胞瘤组织建立小鼠模型,然后通过尾静脉注射不同剂量扩增激活的自体淋巴细胞,观察肿瘤生长和生存状况。结果表明自体淋巴细胞治疗可以抑制小鼠移植瘤生长,在一定浓度范围内剂量越高,对肿瘤的抑制作用越明显[41]。
肿瘤免疫治疗尚未应用于肾母细胞瘤,目前仍处于动物实验阶段。但最新研究表明肾母细胞瘤肿瘤微环境中存在活化的CD4+和CD8+T细胞以及较高水平的自然杀伤细胞,这意味着肾母细胞瘤可能对免疫治疗敏感[42];相信将来会有更多的研究集中于肾母细胞瘤免疫治疗。
六、展望
肾母细胞瘤仍然以手术切除为主,但手术方式可能会发生改变,其中NSS对于保留肾母细胞瘤患者的肾功能具有明显的优势,而LS具有创口小等一系列优势,因此联合两者在肾母细胞瘤手术治疗中的应用可能会成为未来的一个研究热点。
化疗在肾母细胞瘤的治疗中应用广泛,但是它副作用较强,而放疗应用较少,随着精准治疗的发展,其对肿瘤周围健康组织的危害在降低,其使用会有所增加。目前,新型靶向治疗选择性高、副作用小、优势明显,有望成为肾母细胞瘤一线治疗方式。
