4例婴儿心脏移植的单中心经验总结
2021-06-09董念国孙永丰
张 菁 董念国 孙永丰 周 诚
儿童心脏移植历经半个多世纪的发展,在外科手术技术、供心保存、免疫抑制治疗、围术期处理、多学科合作模式等多方面取得了长足的进步,已成为儿童终末期心脏病的标准治疗方法。到目前为止,全球儿童心脏移植总手术量超过14 000台,呈逐年增加趋势,<1岁婴儿约占12.8%[1];术后中远期生存率令人满意,年龄越小的患者接受心脏移植的术后生存时间越长[2]。儿童心脏移植的主要病因是心肌病及先天性心脏病,并表现出明显的年龄差异。<1岁的患者以先天性心脏病为主,但随着复杂先天性心脏病手术成功率的提高,近年婴儿先天性心脏病病特别是左心室发育不良综合征的比例有所下降,而心肌病受者比例接近40%[3,4]。虽然1995年我国就有成功施行婴儿心脏移植的报道[5],但因手术难度大、供体来源少、受体等待期病死率高、围术期处理困难等导致婴儿心脏移植发展缓慢,总体数量少,经验有限。华中科技大学同济医学院附属协和医院近10年完成儿童心脏移植100余例,其中婴儿心脏移植4例。现将4例婴儿心脏移植患者的临床资料进行回顾性分析,总结如下。
材料与方法
一、临床资料
1. 受者资料:收集2008年1月到2020年12月由华中科技大学同济医学院附属协和医院心血管外科完成的4例婴儿心脏移植患者的临床资料(表1)。4例受者中,女2例,男2例,年龄(4.75±2.75)个月,体重(5.18±1.98)kg,血型O型2例,A型及B型各1例,群体反应性抗体均为阴性,3例术前需要血管活性药物持续泵入,1例曾行机械通气。术前左室射血分数(left ventricular ejection fraction,LVEF)为(31.75±25.71)%。心肌病2例,复杂先天性心脏病2例。病例1术前诊断扩张型心肌病、心肌致密化不全、二尖瓣重度关闭不全,B超检查提示:左球形扩张,左心室横径4.5 cm,射血分数(ejection fraction,EF)15%,符合致密化不全心肌病改变,二尖瓣脱垂并重度关闭不全,卵圆孔未闭。患者自4个月起体重不增,发育滞后,反复发生肺部感染、心力衰竭,予积极抗心力衰竭治疗效果不佳。病例2因爆发性心肌炎,心源性休克,由外院行气管插管转入,给予甲基强的松龙、人免疫球蛋白冲击治疗,心功能无明显好转,仍需大剂量血管活性药物维持,无法脱离呼吸机,B超检查提示:左心球形扩张、二尖瓣重度关闭不全、左心室心内膜增厚、左室心肌致密化不全、左室壁运动弥漫性减弱、LVEF为23%、卵圆孔未闭。病例3原发病为右室发育不良综合征、肺动脉闭锁伴室间隔完整(动脉导管供应肺血)、三尖瓣发育不良、三尖瓣下移畸形、三尖瓣狭窄并轻度关闭不全、右室依赖型冠状动脉供血。患者缺氧不严重,但体循环淤血等心力衰竭症状进行性加重,无法耐受冠状动脉CT血管造影检查。病例4原发病为心肌严重致密化不全、主动脉缩窄、室间隔缺损、卵圆孔未闭、三尖瓣重度关闭不全、肺动脉高压、左主支气管狭窄(外压型)。患者反复出现左心衰,经内科积极治疗症状改善不佳,呼吸困难进行性加重,伴心率增快、血压下降、四肢湿冷。移植前等待时间平均为(46.00±12.19)d。
2. 供体资料:4例供者均为脑死亡器官捐献者,女3例,男1例,年龄(3.75±0.50)岁,体重(15.88±2.95)kg,供体受体体重比(3.60±2.05),冷缺血时间(383.25±16.74)min,见表2。
二、供心获取、手术方法、围术期管理及随访
(一)供心的获取与灌注保存
胸骨正中切口开胸,剪开心包,剪开右上肺静脉及右心耳或下腔静脉行左、右心引流,阻断升主动脉,主动脉根部灌注(20 mL/kg)Thomas Ⅱ冷晶体液使其快速停搏,依次切断肺静脉、上下腔静脉、主肺动脉、主动脉,然后将供心置于空灭菌袋中,连灭菌袋一起放入装有碎冰屑的外层灭菌袋中,8 min内经升主动脉根部再次灌注40~50 mL/kg的4℃组氨酸-色氨酸-酮戊二酸盐液 (HTK液)。通过冠状静脉窦HTK液回流判断心肌保护液灌注效果,后置于1 000~15 00 mL HTK液中贮存运输。注意梯度隔温保存,避免心脏直接与冰接触。若冷缺血>4 h,返回手术室修剪供心时再经主动脉灌注HTK液20~30 mL/kg。

表1 4例婴儿心脏移植受者的一般资料Table 1 General profiles of 4 infantile heart transplant recipients病例年龄(月)性别体重(kg)术前诊断术前超声LVEF(%)群体反应性抗体血管活性药物持续使用移植前等待时间(d)18男7.5扩张型心肌病15阴性否5226女6.0爆发心肌炎、心肌病23阴性是5933男4.2复杂性先天性心脏病70阴性是4242女3.0复杂性先天性心脏病、心肌严重致密化不全19阴性是31

表2 4例婴儿心脏移植供者的一般资料Table 2 General profiles of 4 infantile heart transplant donors病例供体性别供体年龄(岁)供体体重(kg)供受体体重比供体死亡原因淋巴毒试验(%)供受体血型冷缺血时间(min)1女3131.73脑肿瘤6O-O3792男4172.83缺血缺氧性脑病4O-O4033女4143.33缺血缺氧性脑病4A-A3884女419.56.5脑外伤-O-B363
(二)心脏移植手术方法
前3例心脏移植手术均于全身麻醉、中低温体外循环下进行,病例4在摘除受体心脏后,深低温停循环11 min,同期行主动脉缩窄矫治术。1例行房房经典吻合术,3例行腔腔吻合术。于膈神经前1 cm敞开受体双侧胸膜,扩大心包腔,剪除供心时尽可能剪除固有左心房使供心向后纵膈偏移,若婴儿左心房与供心严重不匹配,于左下肺静脉与右下肺静脉之间及左上肺静脉与右上肺静脉之间剪开左房壁,扩大左心房吻合口,并使供心心尖指向左下方。供体与受体的主动脉及肺动脉直径存在较大差异时,术中“V”形切开受体动脉行端端吻合术。所有吻合口前半部用6-0可吸收缝线,后半部用6-0 prolene线行连续外翻缝合,吻合口重建尽量使用供者或受者自身组织,不用人工血管材料。对循环欠稳定、出血严重、机械辅助及供体心脏偏大无法一期关胸的患者予延迟关胸。
(三)围术期管理及随访
1. 围术期管理:调整血管活性药物、血容量,以维持血流动力学及内环境的稳定;发生严重移植物功能衰竭时,采用ECMO进行循环辅助。肺动脉高压的患者持续吸入NO以预防右心衰。加强液体管理,早期尽量维持负平衡,肾功能不全时使用腹膜透析。加强气道管理,注意湿化及痰液引流,必要时采用纤维支气管镜辅助吸痰。注意无菌操作,加强感染的预防,使用三代头孢菌素+更昔洛韦预防细菌及病毒感染,ECMO辅助支持患者预防性使用抗真菌药物,结合临床体征及影像、病原学检查及时调整抗生素。待循环稳定后早期启动肠内营养。
2. 免疫抑制方案:采用注射用巴利昔单抗+甲泼尼龙琥珀酸钠诱导,他克莫司+吗替考酚酯胶囊+泼尼松的经典三联方案维持的免疫抑制方案。体外循环转流前及移植术后第4天静脉运用巴利昔单抗,剂量为体表面积×12 mg/m2,体外膜肺预冲液中及主动脉开放前分别给予甲基强的松龙10 mg/kg,术后予序贯治疗,每8 h使用静脉甲基强的松龙一剂,剂量分别为2.0、2.0、2.0、2.0、1.5、1.0、1.0、0.5 mg/kg,后过渡到口服强的松(每天1 mg/kg),逐渐减量至0.2 mg/kg维持。病例1及病例3于术后2年停用激素,病例2及病例4术后1月余停用激素。一般于术后第3天或肾功能恢复后加用他克莫司及吗替麦考酚酯。他克莫司的目标浓度设为1个月内8 ng/mL,1~6月6~8 ng/mL,6个月以后5~6 ng/mL。吗替麦考酚酯20~50 mg·kg-1·d-1,分2次口服,监测白细胞及中性粒细胞数,必要时可行吗替麦考酚酯药代动力学监测。
3. 随访:术后3个月每2周随访1次,4~6月每月1次,7~12个月每2个月1次,12月以后每3个月1次。随访内容包括:患者生长发育、心功能情况、血常规、肝肾功能、血脂血糖、他克莫司药物浓度、巨细胞病毒载量、EB病毒载量、心肌酶水平、心房利钠肽水平、群体反应性抗体、心电图及心脏超声。1年后每年行冠脉CTA检查。
结 果
4例患者围术期全部存活。体外循环时间(122.50±32.60) min,主动脉阻断时间(47.00±25.86)min。4例全部延迟关胸,关胸时间3~23 d,无伤口感染发生。2例因术后移植物功能衰竭行ECMO辅助,辅助时间分别为115 h和253 h,均顺利脱机。3例发生急性肾功能不全行腹膜透析治疗5~27 d。总呼吸机辅助时间92~2 054 h,所有患者发生了肺部感染。ICU停留时间15~117 d,术后住院时间70~129 d。无临床排斥反应发生。4例患者早期均出现高血压,需要积极降压处理。病例1返回ICU 1 h后血压进行性下降,心率增快至190~200次/分,循环无法维持,开胸探查发现移植心脏左心室收缩良好,右心室收缩差,静脉压高,加大扩肺血管药物用量效果不佳。紧急行床边体外循环,辅助循环170 min后尝试脱离,停机困难,遂ECMO辅助,115 h后顺利脱机并完成关胸。病例3术后早期血压升高明显,球结膜水肿,苏醒延迟,加强利尿并控制入量,同时交替使用硝普钠、硝酸甘油、卡托普利等扩血管药物。移植心脏每搏输出量逐渐适应受体机体需要,第5天后停用静脉降压药物。围术期患者神志恢复可,无抽搐发作,未见明显脑损伤。病例4恢复艰难,手术当晚出现心率减慢、血压下降、低心排表现,急行心肺复苏后予ECMO辅助,辅助253 h,循环逐步稳定,术后11 d撤除ECMO。病例4术前即有左主支气管受压,肺动脉高压,术后合并肺不张及重症肺部感染(肺炎克雷伯菌+阿萨丝孢酵母菌),反复出现肺高压危象,给予积极抗感染、俯卧位通气及纤维支气管镜检查治疗,机械通气87 d,2次再次插管后成功脱离呼吸机。因心功能不全,重症感染,出现一过性肾功能不全,腹膜透析27 d后肾功能恢复。23 d 逐步完成关胸,未发生伤口及纵隔感染,具体见表3。
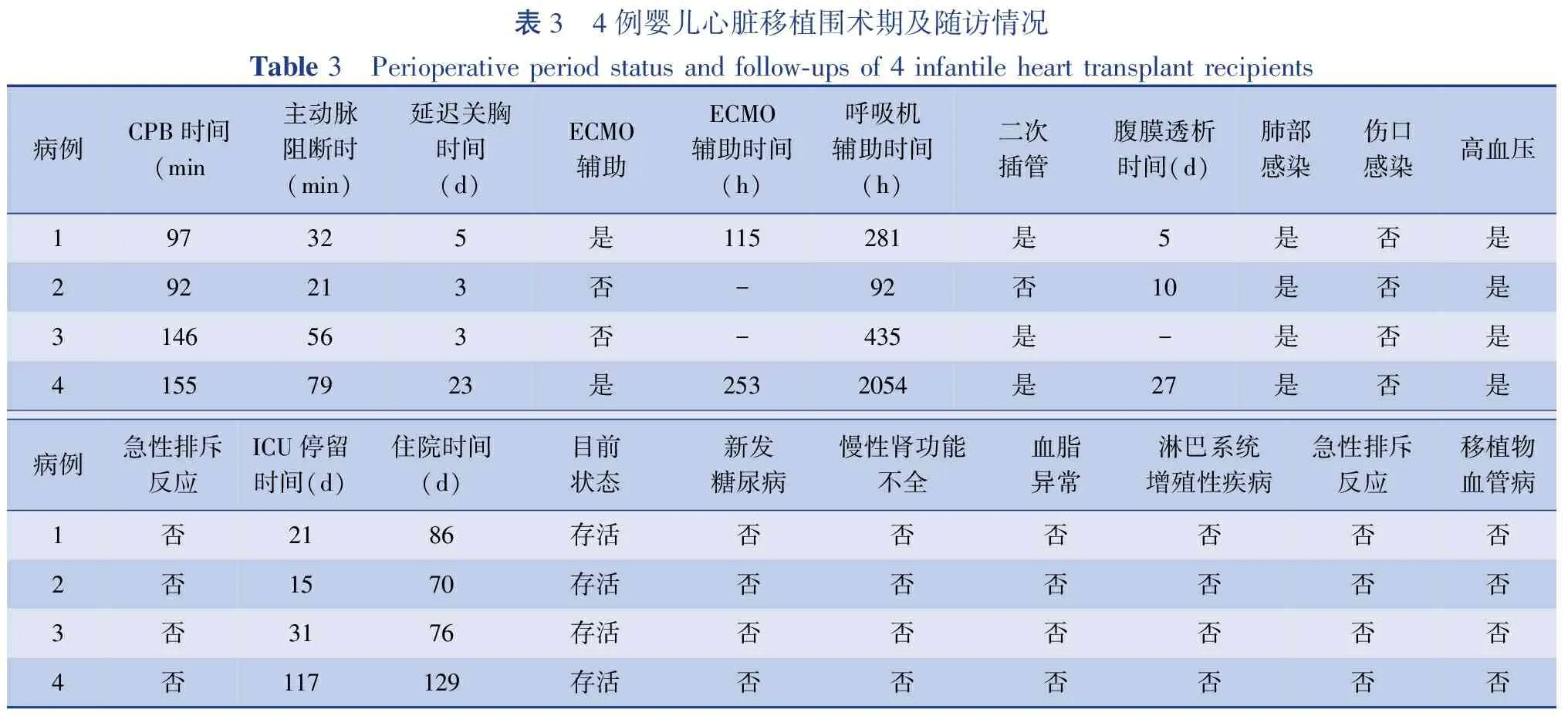
表3 4例婴儿心脏移植围术期及随访情况Table 3 Perioperative period status and follow-ups of 4 infantile heart transplant recipients病例CPB时间(min主动脉阻断时(min)延迟关胸时间(d)ECMO辅助ECMO辅助时间(h)呼吸机辅助时间(h)二次插管腹膜透析时间(d)肺部感染伤口感染高血压197325是115281是5是否是292213否-92否10是否是3146563否-435是-是否是41557923是2532054是27是否是病例急性排斥反应ICU停留时间(d)住院时间(d)目前状态新发糖尿病慢性肾功能不全血脂异常淋巴系统增殖性疾病急性排斥反应移植物血管病1否2186存活否否否否否否2否1570存活否否否否否否3否3176存活否否否否否否4否117129存活否否否否否否
4例患者随访1~6.5 年,心功能Ⅰ~Ⅱ级,心脏超声提示心脏结构及瓣膜活动正常,LVEF为60%~70%。心电图提示窦性心律。病例2术后3个月后发生癫痫,调整他克莫司为环孢素效果欠佳,予左乙拉西坦开浦兰口服后基本控制。病例1和病例3均随访超过6年,生长发育基本同同龄儿童,病例2和病例4仍较同龄儿落后。2例发生过CMV感染,未发生肝肾功能异常、新发糖尿病、血脂异常、皮肤病变、肿瘤、淋巴系统增生性疾病等免疫抑制剂相关并发症。未发生急慢性排斥反应。
讨 论
儿童心脏移植的病种主要为先天性心脏病和心肌病,<1岁的婴儿以先天性心脏病为主,相对于心肌病,复杂先天性心脏病由于其心脏解剖的特异性,丰富的侧支循环,给移植手术设计、实施及术后管理带来更大挑战,需要根据肺静脉、腔静脉回流与心房、肺动脉及主动脉等解剖关系和形态,设计心脏移植术式。据文献报道复杂先天性心脏病患者移植术后早期生存率低于心肌病患者[3,6]。在本组病例中,受者为先天性心脏病及心肌病的各有2例,但因样本量偏小,并未观察到病因对生存期的影响。既往指南中提出需要持续静脉使用正性肌力药物、机械通气或者机械循环辅助,无法常规手术的心功能衰竭D期(终末期)心力衰竭患者需行心脏移植,现更新为C期(现在或过去有心力衰竭)心力衰竭患者存在活动耐量严重受限、生长发育严重障碍,潜在猝死风险,肺血管阻力持续性升高和有可能发展为心脏移植手术禁忌的不可逆性肺动脉高压也可以考虑心脏移植[2,7]。本组婴儿受者的平均等待期为(46.00±12.19)d,4例均需要血管活性药物持续泵入,生长发育停滞,反复出现心力衰竭转入ICU病房抢救。因国内尚无有效的儿童长期机械辅助手段,鉴于婴儿心脏移植其独特的年龄特点,排斥反应较轻且具有良好的临床疗效,供体短缺,等待时间长等原因,建议由儿科、心外科尽早评估病情,综合患者家庭心理及社会经济情况,将其纳入移植等待名单,并根据疾病进展情况及时调整或移除。
根据统计数据,儿童心脏移植等待名单上的病死率为17%~30%,而约40%的供心未得到利用,如何提高供心利用率,解决供体短缺是婴儿心脏移植亟待解决的问题[3,8,9]。本研究的体会是扩大供心来源:放宽供体与受体体重比。一般认为供体与受体体重比为0.8~2.0是比较安全的[10,11]。本组病例中全部使用大供心,供受体体重比最高6.50,最低1.73,发生移植物功能衰竭2例,围术期存活率100%。采用大心脏植入小受体,有可能发生“大心脏综合征”,如高血压,脑水肿致昏迷或抽搐,反应性肺血管痉挛等,加重移植心脏负荷[12]。心率较慢时在心房置入起搏线可实现房室序贯起搏。若停机困难,可用ECMO辅助。大供体的另一个潜在问题是供心能否顺利置入受体胸腔。本研究的体会是通过受者胸片或者CT测量心影径线长度及胸廓宽度与厚度,比对供心取出后心脏后壁至心尖的长度与供心左右径的大小,可以基本预测供心置入情况。手术操作同前文所述。本组年龄最小的一例66日龄先天性心脏病患者,罹患主动脉缩窄、室间隔大缺损(14 mm)、卵圆孔未闭、重度三尖瓣关闭不全、重度肺动脉高压、左右心室严重心肌致密化不全,伴全心增大、左右室收缩功能严重减低、左支气管狭窄(外压型),因顽固性心衰无法继续等待,采用4岁供心,供体与受体体重比高达6.50,创新性提出分阶段性关胸,待心脏逐渐适应,23 d后逐步完成关胸,目前术后1年余,患者恢复良好。虽然有文献报道扩大标准可能会增加早期移植物衰竭的风险,可亦有学者提出使用“大供心”仅仅只是增加了延迟关胸发生率,而不会显著增加右心衰的发生率、呼吸机辅助时间和住院时间。移植心脏会随时间的推移而发生生长和重塑(包括大小及心肌质量)[12,13]。因此,本研究认为小婴儿可接受的供体与受体体重比上限是可以增加的。
婴儿心脏移植的良好疗效取决于重症监护医生、外科医生、儿科医生、移植科医生、超声影像科医生、护士等之间的团队配合,需要精细的围术期及随访管理。移植术后早期最为危险,是原发性移植物衰竭、感染、排斥反应等并发症发生率和病死率最高的时期。由于体重的限制和国内儿童左心室辅助装置(left ventricular assist device,LVAD)的匮乏,ECMO是终末期心力衰竭患者移植前桥接进行循环支持的主要方法。国际心肺移植协会(International Society for Heart and Lung Transplantation,ISHLT)也推荐,ECMO作为儿童移植患者原发性移植物衰竭的首选治疗[14]。研究指出,儿童心脏移植术后ECMO辅助率为7.9%,其中<1岁者占47.3%[15]。本研究中术后2例因肺动脉高压,右心功能衰竭在ICU床旁开展ECMO辅助,均顺利脱机痊愈出院。ECMO能快速改善心输出量以维持充足的组织灌注,逆转多器官功能障碍,降低心室充盈压,通过增加冠脉流量和减少氧气消耗来促进心肌保护,为顿抑心肌心功能恢复提供时间,使移植心脏通过休息、锻炼逐步适应受体血流动力学。除了需要在控制出血、气道管理、血流动力学支持、预防感染和免疫抑制等方面加强管理外,ECMO启动时机的选择亦十分重要,应该在多器官功能障碍发生之前或心脏骤停之前安装。文献报告儿童心脏移植术后ECMO支持的持续时间与院内死亡风险密切相关,90%的患者在7 d内撤除ECMO。对于需要长期进行ECMO支持的患者,寻找替代的支持策略可能受益[16]。婴儿心脏移植术后的随访对于其长期存活亦十分重要。心内膜心肌活检(endomyocardial biopsy,EMB)是监测排斥反应的金指标,但婴儿心肌娇嫩,反复使用这种有创检查容易引发心肌穿孔或室间隔损伤等并发症。因此,综合应用临床表现、心脏超声、心电图、他克莫司血药浓度、淋巴细胞计数来评估婴儿是否发生排斥反应[14,17]。4例患者术后未发生临床排斥反应。本组有2例术后1年内发生巨细胞病毒感染。巨细胞病毒感染的临床表现多样,常在移植术后2~6 个月出现,以肝功能损伤为主,伴有发热、腹泻、纳差等不典型症状,可能因研究样本量总体偏少,暂未在感染者中发现巨细胞病毒肺炎。
虽然婴儿心脏移植仍面临着很多挑战,但该方法仍是治疗婴儿终末期心脏病的一种有效方法。有效的供心保护、细致的手术操作、精细的围术期及随访管理,能扩大供心来源,提高供心利用率,取得满意的总体疗效。
