甘葛护肝胶囊质量标准研究
2021-06-08彭霜陈凌云李江
彭霜 陈凌云 李江
【摘 要】 目的:建立甘葛护肝胶囊的薄层鉴别和含量测定方法,用于控制其质量。方法:采用薄层色谱法分别对甘葛护肝胶囊中的干姜、木香、砂仁、白豆蔻、陈皮、青皮、泽泻进行鉴别;并采用高效液相色谱法测定其中葛根素的含量。结果:7味药的薄层特征斑点明显,阴性无干扰,重复性良好。葛根素在0.106~1.06μg范围内,峰面积与进样量呈良好的线性关系(r=1),平均加样回收率为99.49%,RSD=1.11%。结论:建立的薄层鉴别方法斑点清晰,专属性好,含量测定方法阴性无干扰,结果准确、稳定,可用于控制该制剂标准。
【关键词】 甘葛护肝胶囊;葛根素;薄层鉴别;高效液相色谱法
Abstract:Objective Establish a thin-layer chromatography(TLC) identification and content determination method for Gange Hugan Capsules to control its quality.Methods TLC was used to identify dry Zingiberis rhizoma,Aucklandae radix,Amomum fructus,Amom fructus rotundus,Citri reticulatae pericarpium ,atae pericarpium viride and Alismatis rhizoma respectively in Gange Hugan capsule.Puerarin content was determined by HPLC.Results 7 medicines dispcayed obvious characteristic spots in TLC with non-interfering and good repeatability.In negate samples of puerarin from 0.106 to 1.06μg,the peak area has a good linear relationship with the injection volume (r=1).The average sample recollectron is 99.49%,and the RSD = 1.11%.Conclusion The established TLC identification method showed clear spots,good specificity,and non-interfemgin negative samples interference.The results were accurate and stable,suggesting that this method be used to control the preparation standards.
Keywords:Gange Hugan Capsules; Puerarin; TLC; HPLC
酒精性肝病(Alcoholic Live Disease,ALD)是由于长期大量饮酒或者短时间内摄入大量酒精引起的疾病。酒精在代谢过程中的氧化应急作用及炎症反应是引起酒精肝的主要因素[1]。肝脏是机体代谢酒精的主要器官,代谢量达到90%以上,酒精对肝脏的损伤在所有器官中最为明显[1]。有研究表明,酒精性肝病发病与线粒体损伤、代谢过程中的氧化应激、细胞因子的释放和细胞凋亡等有密切关系[1-2]。也有研究[3]表明,某些中药成分对酒精性肝损伤具有保护作用,在改善肝脏功能[4]、调节乙醇代谢[5-6]、减轻氧化应激损伤[7]、抗炎护肝[8]和细胞凋亡[9]等方面,有明显的优势。
甘葛护肝胶囊处方来源于云南中医药大学第三附属医院(昆明市中医医院)的经验方,由青皮、木香、茯苓、人参、三七、橘皮、炒神曲、猪苓、干姜、白术、泽泻、葛花、砂仁、白豆蔻、牡蛎、枸杞子、葛根、余甘子共18味药组成,具有良好的解酒保肝功效[10]。处方中的君药是葛花,主要含有黄酮类化合物,是处方中解酒的有效成分之一,方中人参、茯苓等药材也有相应的保肝护肝作用[11]。处方以传统汤剂的形式应用于临床,不便于患者携带,服用等,为了促进处方的应用与推广,规范用药剂量,保证疗效,将其制成甘葛护肝胶囊。
为了更好地控制其质量,保证用药安全,对所制甘葛护肝胶囊中的干姜、木香、砂仁、泽泻、陈皮、青皮、白豆蔻进行TLC鉴别,并对其主要成分葛根素进行含量测定。
1 仪器与试药
1.1 仪器 高效液相色谱仪(AgiLent);色谱柱C18(4.6mm×250mm,5μm,迪马科技公司);超声仪(上海科导超声仪器有限公司);电子天平(奥豪斯仪器有限公司);分析天平(上海精密仪器仪表有限公司);电热鼓风干燥箱(天津市泰斯特仪器有限公司);数显恒温水浴锅(北京永光明医疗仪器厂);摇摆式高速中药粉碎机(温岭市林大机械有限公司);循环水式真空泵(巩义市英峪予华仪器厂);净水器:超纯水系统(上海倍捷Biogen科技有限公司)。
1.2 试药 甲醇、石油醚、二氯甲烷、甲酸乙酯、乙酸乙酯、乙醇均为分析纯(天津市大茂化学试剂厂);环己烷、正丁醇、甲酸均为分析纯(天津市风船化学试剂科技有限公司);甲苯(AR,云南杨林工业开发区汕滇药业有限公司);水为哇哈哈纯净水。干姜对照药材(批号:120942-201510)、木香对照药材(批号:120921-201309)、砂仁对照药材(批號:120985-201406)、泽泻对照药材(批号:121081-201406)、橙皮对照药材(批号:121137-201606)、陈皮对照药材(批号:120969-201510)、青皮对照药材(批号:121155-201103),白豆蔻对照药材(批号:120926-201608)(中国食品药品检定研究院),甘葛护肝胶囊(批号分别为:20171123,20171124,20171125),均由昆明市中医医院提供。
2 方法与结果
2.1 TLC鉴别
2.1.1 干姜TLC鉴别 取本品粉末1g,加乙酸乙酯20mL,超声处理10min,滤过,滤液作为供试品溶液。另取干姜对照药材1g,同法制成对照药材溶液。再取缺干姜的阴性粉末1g,同法制成阴性对照溶液。按薄层色谱法试验,吸取对照药材溶液1μL,阴性对照溶液和供试品溶液各6μL,分别点于同一硅胶G薄层板上,以石油醚(60~90℃)-三氯甲烷-乙酸乙酯(3∶[KG-*3/5]2∶[KG-*3/5]1)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸试液,在105℃下加热至斑点显色清晰[12]。供试品色谱中,在与对照药材色谱相应的位置上显相同颜色的斑点,阴性供试品无干扰。如图1所示。
2.1.2 木香TLC鉴别 称取粉末0.5g,加甲醇10mL,超声30min,滤过,滤液作为供试品溶液。另取木香对照药材0.5g,同法制成对照溶液。再取缺木香的阴性粉末0.5g,同法制成阴性对照溶液。按薄层色谱法试验,吸取药材对照品溶液4μL,供试品溶液和阴性对照溶液20μL,分别点于同一硅胶G薄层板上,以环己烷-甲酸乙酯-甲酸(15∶[KG-*3/5]8∶[KG-*3/5]1)的上层溶液为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,加热至斑点显色清晰[13]。供试品色谱中,在与对照药材色谱相应的位置上显相同颜色的斑点,阴性无干扰。结果如图2所示。
2.1.3 砂仁TLC鉴别 取砂仁药材,去壳,取种子团粉末(通过三号筛)1g,用70%乙醇润湿粉末,加石油醚(60~90℃)5mL,超声处理30min,滤过,滤液作为对照药材溶液。另取本品粉末和缺砂仁的阴性粉末各1g,同法制成供试品溶液和阴性对照溶液。按薄层色谱法试验,吸取对照药材溶液3μL,供试品溶液和阴性对照溶液各6μL,分别点于同一硅胶G薄层板上,以环己烷-醋酸乙酯(11∶[KG-*3/5]1)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,加热至105 ℃斑点显色清晰[14]。供试品色谱中,在与对照药材色谱相应的位置上显相同颜色的斑点,阴性无干扰。结果如图3所示。
2.1.4 泽泻TLC鉴别 取本品粉末2g,加乙酸乙酯20mL,超声处理30min,滤过,滤液加于氧化招柱(200~300目,5g,内径为1cm,干法装柱)上,用乙酸乙酯10mL洗脱,收集洗脱液,蒸干,残渣加乙酸乙酯lmL使溶解,作为供试品溶液。另取本品粉末和缺泽泻的阴性粉末各2g,同法制成供试品溶液和阴性对照溶液[15]。按薄层色谱法试验,吸取对照药材溶液1μL,供试品溶液和阴性对照溶液各3μL,分别点于同一硅胶G薄层板上,以环己烷-乙酸乙酯(2∶[KG-*3/5]3)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液 ,在105℃下加热至斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上显相同颜色的斑点,阴性无干扰。结果如图4所示。
2.1.5 陈皮、青皮TLC鉴别 甘葛护肝方由葛根、余甘子、人参等十八味药组成,本品质量标准研究对处方中所有药味的TLC鉴别均进行了研究。且依据所查文献,每味药至少采用了两种鉴别方法。结果表明,除了干姜、木香、砂仁、泽泻、陈皮、青皮、白豆蔻外,其他几味药均未找到合适的鉴别方法。试验发现,本品中可鉴别出陈皮、青皮的特征斑点,但该斑点存在阴性干扰。最终采用双阴性的方法去除鉴别过程中的阴性干扰。
取本品粉末0.3g,加甲醇10mL加热回流20min,滤过,取续滤液5mL,浓缩至lmL,作为供试品溶液。取缺陈皮和青皮的阴性粉末、陈皮和青皮药材粉末各0.3g同法制成阴性对照溶液。另取橙皮苷对照品,加甲醇制成饱和溶液,作为对照品溶液。按薄层色谱法试验,吸取供试品和阴性对照溶液各6μL,对照药材溶液和对照品溶液各3μL,分别点于同一用硅胶G薄层板上,以乙酸乙酯-甲醇-水(100∶[KG-*3/5]17∶[KG-*3/5]13)为展开剂,展至约3cm,取出,晾干,再以甲苯-乙酸乙酯- 甲酸-水(20∶[KG-*3/5]10∶[KG-*3/5]1∶[KG-*3/5]1) 的上层溶液为展开剂,展至约8cm,取出,晾干,喷以1%三氯化铝甲醇试液,置紫外光灯(365nm)下检视[16]。供试品色谱中,在与对照药材色谱相应的位置上显相同颜色的斑点,阴性无干扰。结果如图5所示。
2.1.6 白豆蔻TLC鉴别 取豆蔻仁粉末约5g,置圆底烧瓶中,加水200mL,连接挥发油测定器,自测定器上端加水至刻度3mL,再加正已烷2~3mL连接回流冷凝管,加热至微沸并保持2h,放冷,分取正己烷液,通过铺有无水硫酸钠约1g的漏斗滤过,滤液置5mL量瓶中,挥发油测定器内壁用正己烷少量洗涤,洗液加入同一量瓶中,用正己烷稀释至刻度,摇匀,滤过,取续滤液,滤液作为对照药材溶液。再取缺白豆蔻的阴性粉末和本品粉末同法制成阴性对照溶液和供试品溶液。按薄层色谱法试验,吸取供试品溶液和阴性对照溶液各3μL、对照药材溶液1μL,分别点于同一硅胶G薄层板上,以环己烷-二氯甲烷-乙酸乙酯(15∶[KG-*3/5]5∶[KG-*3/5]0.5)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105℃加热至斑点显色清晰,立即检视[17]。供试品色谱中,在与对照药材色谱相应的位置上显相同颜色的斑点,阴性无干扰。结果如图6所示。
2.2 葛根素含量测定 葛根作为中国传统医学中最具代表性的解酒药物之一,有解酒防醉、改善心脑血管循环[18-20]、镇痛[21]、降低血糖[22]、抗肝脏毒性[23]、防止高血压及动脉硬化[24]、提高机体免疫力及抗菌、抗病毒等多種药理作用[25]。现代研究发现异黄酮类化合物是葛根的主要成分,其中葛根素是葛根的特有成分,也是中药葛根中的指标性成分,葛根素可通过抑制β2内啡肽的释放来改善抗自由基和脑功能,降低脂质过氧化对细胞的损害,对急性酒精中毒有保护作用[26]。有实验证实葛根具有解酒作用,能降低乙醇在大鼠体内的血药浓度,酒前服用比酒后服用效果更佳[27-28]。本实验主要对甘葛护肝胶囊中的葛根素进行含量测定,为提高其质量标准提供参考。
2.2.1 对照品溶液制备 取葛根素对照品适量,精密称定,加30%乙醇制成0.035mg/mL的葛根素对照品溶液。
2.2.2 供试品溶液制备 取本品甘葛护肝胶囊内容物约5g,精密称定,置具塞锥形瓶中,精密加入30%乙醇50mL,密塞,称定重量,超声30min,放冷,再称定重量,用30%乙醇补足减失的重量摇匀,离心5min,滤过,精密移取25mL滤液挥干,残渣加30%乙醇5mL溶解,离心5min,取上清液,滤过,取续滤液,即得[29]。
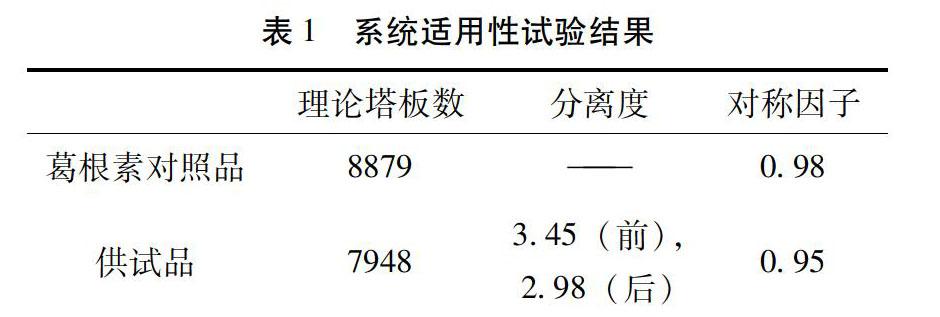
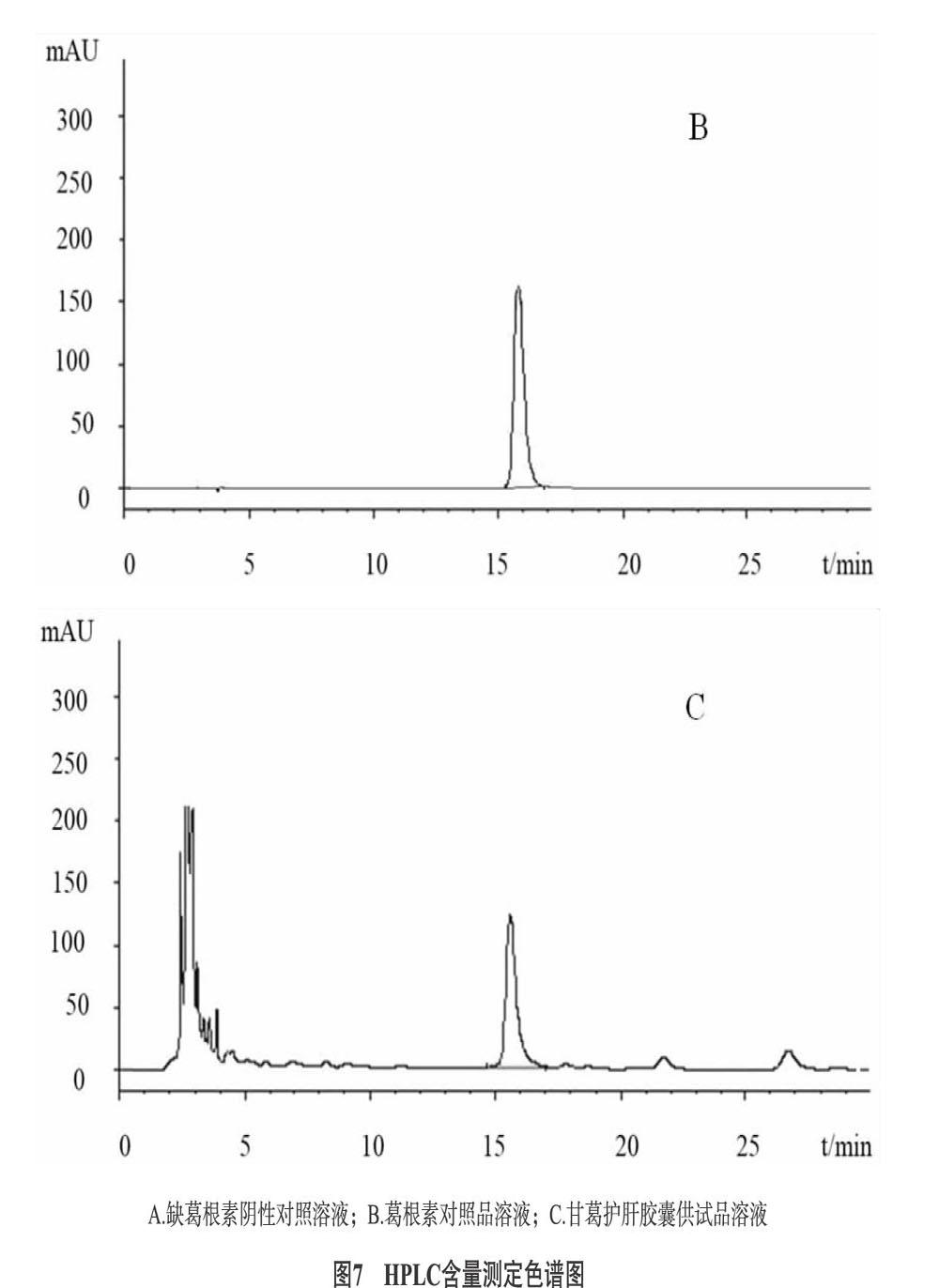
2.2.3 色谱条件与系统适用性 试验Diamonsil C18柱(250mm×4.6mm,5μm);流动相:甲醇-水(23∶[KG-*3/5]77);检测波长:250nm;柱温:30℃;流速:1mL/min;进样量:10μL;上述色谱条件下,葛根素对照品与其他组分色谱峰分离度良好。色谱图如图7所示。
结果表明:供试品中葛根素的分离度、拖尾因子均能满足《中国药典》2015年版四部通则0512高效液相色谱法项下规定,理论板数按葛根素峰计算均大于4000。
2.2.4 专属性试验 精密称取处方中除葛根外其他味药的混合粉末约5g,按供试品溶液制备方法制成阴性对照溶液。精密吸取阴性对照溶液10μL注入液相色谱仪,进行测定,即得。结果显示:阴性样品的色谱图中在与对照品相同保留时间位置上没有吸收峰,说明用本法测定其含量专属性较强、灵敏度高。
2.2.5 线性关系考察 精密吸取葛根素对照品溶液(0.106mg/mL) 1、2、3、4、5、10μL,注入液相色谱仪照上述色谱条件测定峰面积,以峰面积为纵坐标Y,进样量为横坐标X,绘制标准曲线,葛根素的回归方程Y=398.64X-1.0279,r=1,结果表明,葛根素在0.106~1.06μg之间,峰面积与进样量呈良好线性关系。
2.2.6 精密度试验 精密吸取同一葛根素对照品溶液进行测定,进样量10μL,连续进样6次,测得葛根素峰面积RSD值为0.21%(n=6)。结果表明仪器精密度良好。
2.2.7 对照品溶液稳定性试验 精密称取葛根素对照品,加30%乙醇制成0.035mg/mL葛根素对照品溶液。精密吸取葛根素对照品溶液,分别在0、4、8、12、16、24h进样检测,进样量10μL,测得葛根素峰面积RSD值为0.25%(n=6),结果表明葛根素对照品溶液在24h内稳定。
2.2.8 供试品溶液稳定性试验 精密称取甘葛护肝胶囊粉末约5g,按“2.2.2”项下供试品制备方法,制成供试品溶液,分别在0、4、8、12、16、24h进样检测,进样量10 μL,测得甘葛护肝胶囊供试品RSD值为1.54%(n=6),结果表明甘葛护肝胶囊供试品溶液在24h内稳定。
2.2.9 重复性试验精密 称取20171123批次的甘葛护肝胶囊粉末6份,每份约5g,按“2.2.2”项下供试品溶液制备方法制备6份甘葛护肝胶囊供试品溶液,进行测定,进样量10μL,6份供试品溶液葛根素含量RSD为0.63%(n=6),结果表明本方法重现性较好。
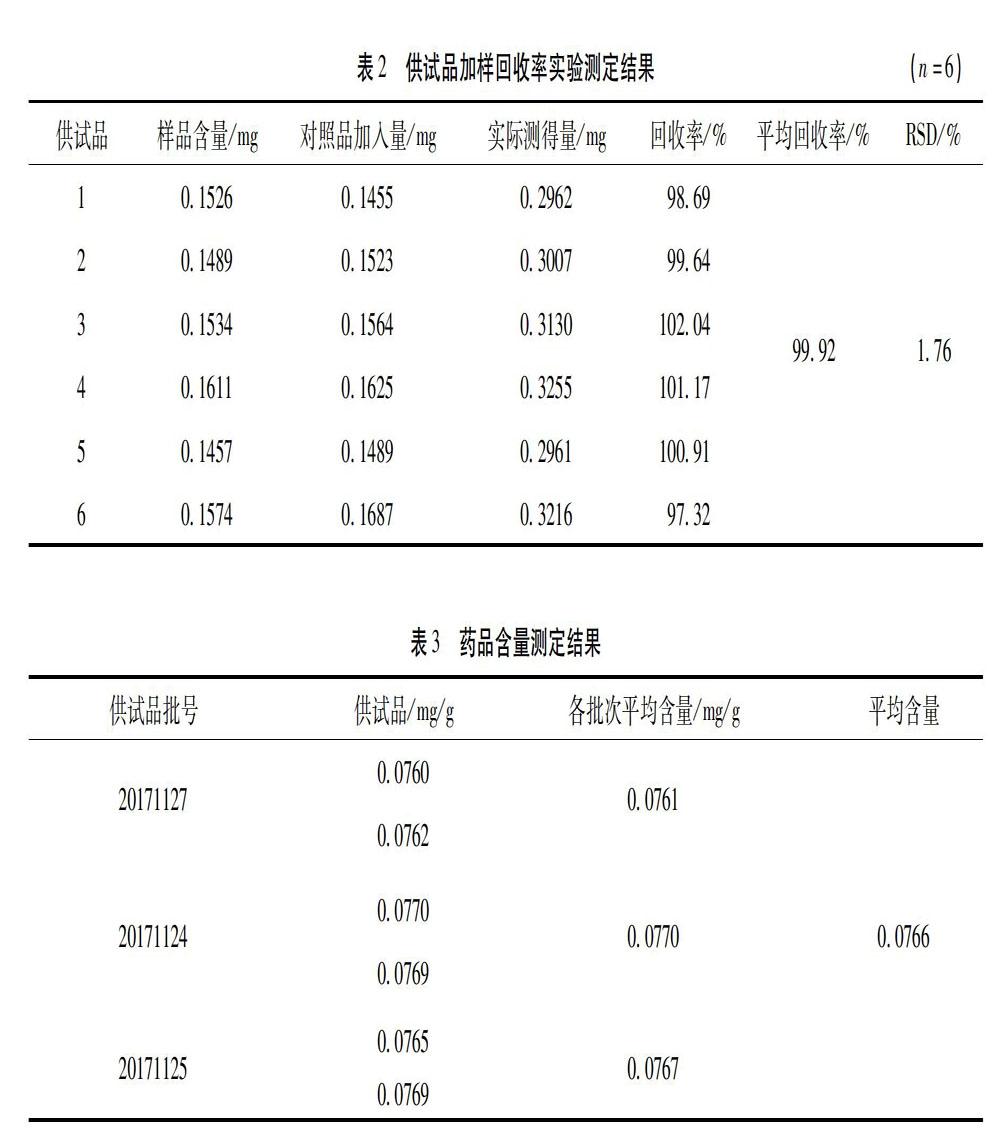
2.2.10 准确度试验取 20171123批次的肝葛护肝胶囊粉末6份,每份约2.0g,精密称定,置锥形瓶中,按供试品制备方法制供试品溶液,精密加入葛根素对照品,制成供试品,取10μL注入液相色谱仪测定含量,用公式:加样回收率(%)=(实际测得量-样品含量)/加入量×100%。计算加样回收率,结果见表7。结果平均加样回收率为99.92%,RSD 为1.76% 。见表2。
2.2.11 样品含量测定 分别称取3个批次的甘葛护肝胶囊粉末,每个样品取3份,按“2.2.2”项下方法制备供试品溶液,分别进样,进样量为10μL,测得甘葛护肝胶囊中葛根素的平均含量为0.0766mg/g,每粒以0.5g计,每粒含葛根素0.0383mg。测定结果见表3。
3 讨论
甘葛护肝方由葛根、余甘子、人参等十八味药组成,本研究采用醇水双提分组方案进行提取。其中,葛花、木香等四味药采用醇提,醇提的药渣与葛根、茯苓、枸杞子等10味药材合并后再进行水提,合并提取液制成稠浸膏。由于处方含有效成分在高温下不稳定的药味,本试验将方中人参、三七、白豆蔻、炒神曲以生药粉的形式加入稠浸膏中混匀、干燥、粉碎,制成胶囊。因所用生药粉为极细粉,再进行显微鉴别时生药粉中的特征性结构已被破坏,故本试验并未进行相关研究。
本研究对处方中所有药味的TLC鑒别均进行了研究。其中三七和人参所含有效成分相近,在鉴别中干扰较多,分离较难,所以未能建立此二药的薄层鉴别方法。经查阅文献,对剩余药味至少采用了两种方法进行鉴别,结果表明,除干姜、木香、砂仁、泽泻、陈皮、青皮、白豆蔻外,其余味药均未找到合适的鉴别方法。本品中可鉴别出陈皮、青皮的特征斑点,但该斑点在二药鉴别中均存在阴性干扰,分析可能是此二味药均含橙皮苷引起,后采用双阴性的方法去除干扰,结果表明,此法可行。此法阳性结果仅可表明本品中含陈皮或青皮或者同时含陈皮和青皮,但亦可使处方的鉴别药物数量达到处方药量的1/3。
葛根素含量测定实验中,笔者首先对色谱条件进行了优化,在甲醇-水(25∶[KG-*3/5]75)的基础上,对流动相比例进行了考察,结果显示以甲醇-水(23∶[KG-*3/5]77)为流动相时所得供试品色谱图峰形良好。笔者也对供试品溶液的制备方法进行了优化,考察了供试品溶液制备中甘葛护肝胶囊内容物的取样量,分别取样2.5g,5.0g,7.5g,结果显示,当取样量为5.0g时,所得色谱图中峰形较好。在此基础上,也分别考察了当超声时间为20min,30min,40min时对供试品溶液的影响,结果显示,超声时间30min,所测得的含量与超声40min所测含量相近,确定超声时间为30min。本实验结果显示所建立含量测定方法重现性、准确度、精密度等均符合药典规定,故将此方法用于甘葛护肝胶囊中葛根素的含量测定。
参考文献
[1]王政,葛冰洁,王萌,等.中药对酒精性肝损伤的保护作用研究进展[J].延边大学农学学报,2019,17(3):102-108
[2]孙艳秋,刘珂,王守愚,等.槲寄生的研究进展[J].中草药,2000(6):73-76.
[3]叶文斌,樊亮,王昱,等.黄果槲寄生果实多糖对急性酒精肝损伤小鼠的保护作用[J].安徽农业大学学报,2017(2):218-223
[4]蔡天娇,王瑞珍,魏君慧,等.白桦脂酸与红枣总三萜酸 对小鼠酒精肝损伤的保护作用[J].食品科学,2018,39 (11):191-19.
[5]张志毕,张媛,于浩飞,等.余甘子提取物对小鼠急性酒精肝损伤的保护作用研究[J].食品工业科技,2017,38(5):350-356.
[6]史亚夫,李雪溦,文乐,等.短穗兔耳草和短管兔耳草抗急性酒精肝损伤小鼠作用机制的研究[J].中药新药与临床药理,2017(5):49-54.
[7]刘群.五味子藤茎木脂素和多糖的提取及对实验性肝损伤保护作用研究[D].长春:吉林农业大学,2013.
[8]岳斌,徐丽,李影娜.刺五加皂苷抗小鼠酒精性肝氧化损伤作用及机制研究[J].中南药学,2018,16(9):43-46.
[9]郭永月.黑牛肝菌多糖对小鼠酒精性肝损伤的保护作用研究[D].南京:南京师范大学,2013.
[10]李江,付鹏,彭霜,等.Box-Behnken设计优化甘葛护肝胶囊醇水双提工艺[J].现代中药研究与实践,2020,34(2):54-60.
[11]胡芳.葛甘保肝胶囊保健食品的研究[D].长春:长春工业大学,2016.
[12]陈旭.干姜芩连人参煎膏剂的制备工艺与质量标准研究[D].哈尔滨:黑龙江中医药大学,2011.
[13]陈莹.木香槟榔丸的质量标准研究[D].锦州:辽宁医学院,2011.
[14]陈惠斌.香砂六君制剂质量标准提高研究[D].兰州:兰州大学,2014.
[15]马娟.荷泽颗粒医院制剂的药学研究[D].武汉:湖北中医药大学,2016.
[16]王芳,王四旺,姚敏娜,苗乃周,刘玉林.乳消康胶囊的制备工艺及质量标准研究[J].西北药学杂志,2018,33(1):14-18.
[17]张谦.银蔻感冒颗粒制备工艺及质量标准研究[D].杭州:浙江工业大学,2016.
[18]李军,黄可欣,王元春,等.葛根素对心肌缺血再灌注损伤大鼠心肌酶的影响[J].中国实验诊断学,2013,17(2):244-246.
[19]巩红岩,秦元旭,王更富,等.葛根素对大鼠体外循环后心肌缺血再灌注损伤的保护作用及抗氧化应激机制的探讨[J].中国实验方剂学杂志,2012,18 (1):165-168.
[20]侯永春,严孜.葛根素对慢性脑缺血大鼠海马CA1区NGF表达的影响[J].中国实验方剂学杂志,2012,18(3):184-186.
[21]罗敬华,曾晓艳,范桂香,等.葛根素对神经病理性痛模型小鼠的镇痛作用[J].西北药学杂志,2013,28(1):48-50.
[22]裴高升,王萌,张慧杰,等.葛根素在水溶液中的降解动力学研究[J].中国现代中药,2017,19(3):377-380.
[23]高學清,汪何雅,钱和,等.葛花和葛根对急性酒精中毒小鼠的解酒作用[J].食品与生物技术学报,2012,31(6):621-627.
[24]翁卫东,复方中药,葛花解酲汤对酒精性脂肪肝大鼠模型的影响[J].中国中西医结合消化杂志,2008,16(3):162-164.
[25]潘玲玲,任江剑,江建铭.野葛葛根素积累动态的研究[J].中国现代中药,2011,13(9):15-17.
[26]陆齐天,丛晓凤,朱修乐,等.古籍记载的单味解酒中药现代研究进展[J].中华中医药学刊,2017,35(1):100-103.
[27]尹秋霞,陈英剑,孙晓明,等.葛根、枳椇子对大鼠血中乙醇浓度变化的影响[J].山东中医药大学学报,2003,27(4):310-311.
[28]刘高仁,注射用葛根素治疗重度急性酒精中毒30例[J].中医研究,2012,25(12):26-28.
[29]季婷婷.葛根配方颗粒质量标准研究[D].合肥:安徽中医药大学,2018.
