睾丸胚胎型横纹肌肉瘤的MRI表现
2021-06-08王斐斐王岸飞王晓娟程敬亮
王斐斐,张 焱,王岸飞,孟 云,王晓娟,程敬亮
郑州大学第一附属医院磁共振科 郑州 450052
横纹肌肉瘤(rhabdomyosarcoma,RMS)是起源于肌祖细胞的高度恶性肿瘤[1]。2013年WHO软组织肿瘤分类将RMS分为4个亚型,即胚胎型、腺泡型、多形型、梭形细胞或硬化型[2]。胚胎型RMS好发于儿童及青少年,发生在睾丸的RMS极为罕见[3]。目前,RMS国内外相关文献均为散发个例报道,影像学表现尚未统一,临床易误诊;作者回顾性分析了5例睾丸胚胎型RMS的MRI表现特点,现总结报道如下。
1 临床资料
1.1一般资料收集2016年3月至2019年11月在郑州大学第一附属医院就诊的具有完整临床、MRI和病理资料的5例睾丸胚胎型RSM患者,均为男性,年龄16~21岁,均经病理及免疫组化检查证实。临床病程2个月~1 a,表现为无明显诱因增大的睾丸肿物,2例伴疼痛,1例有腰部不适。专科检查:睾丸体积大,触及肿物,无明显压痛,质地硬,活动度差;4例睾丸、附睾及精索未探及,1例肾区叩击痛,1例继发于鼻腔鼻窦RMS切除术后。5例超声检查均提示睾丸体积增大,形态失常,内回声不均,见多个片状低回声区,可见少量血流信号。CT检查提示阴囊内不规则团块状软组织肿块,呈高低混杂密度,强化密度不均匀;4例见患侧精索增粗。胸腹部超声及CT检查提示1例左侧输尿管上段扩张及左肾积水;4例腹股沟及盆腔内多发肿大淋巴结,其中3例合并腹膜后多发肿大淋巴结,1例合并脊柱、肋骨及骨盆多发骨转移。
1.2检查方法5例均行3.0 T MRI常规平扫、扩散加权成像(diffusion weighted imaging,DWI)和动态增强扫描。常规平扫包括矢状位T2WI、冠状位 T2WI、横轴位脂肪抑制T2WI和T1WI序列(层厚5 mm,层数25);DWI扫描为横轴位(b值为0和800 s/mm2);动态增强扫描为横轴位3D T1WI(层厚3 mm,层数80),延迟增强分别行横轴位、矢状位和冠状位T1WI(层厚3 mm)。
1.3MRI图像处理与分析
1.3.1 DWI图像处理 所得DWI原始图像输入后处理工作站,获得表观扩散系数(apparent diffusion coefficient,ADC)图,结合T2WI和T1WI图像,在ADC图上选择肿瘤实性低信号区,手动勾勒圆形感兴趣区域(region of interest,ROI),获得ADC值,测量3次,取平均值。
1.3.2 动态增强T1WI图像处理 在后处理工作站对动态增强T1WI原始图像进行时间-信号强度曲线(time intensity curve,TIC)的处理,ROI放置在早期明显强化的肿瘤实性区,避开血管结构,获得TIC类型,同时记录并计算肿瘤增强前信号强度(SIpre)、动态增强过程中最大信号强度(SIpeak)、达峰时间(Tpeak)、最大对比增强率(maximum contrast enhancement ratio,MCER)。Tpeak为SIpeak出现的时间,Tpeak反映肿瘤微观情况,血管越丰富,Tpeak值越小;MCER=(SIpeak-SIpre)/SIpre×100%;MCER小于100%为轻度强化,大于100%小于200%为中度强化,大于200%为明显强化。TIC类型分为3型[4]:Ⅰ型[流入型(Tpeak>120 s)]、Ⅱ型[平台型(Tpeak≤120 s,下降值小于15%)]和Ⅲ型[流出型(Tpeak≤120 s,下降值大于15%)]。
1.3.3 图像分析 所有图像和数据由2名副主任及以上职称的医师共同观察并处理,MRI图像评估内容包括肿瘤部位、侧别、形态、边界、最大径线、T1和T2信号强度及均匀度、病灶内有无囊变、坏死、出血、分隔、病灶周围结构情况、有无其他结构受累、转移、肿大淋巴结、DWI信号、ADC图表现、动态增强及延迟增强表现特点。结果由2名副主任及以上职称的医师讨论后达成一致性意见。
1.4结果
1.4.1 MRI平扫表现 5例RMS均位于睾丸内,为单发,其中2例位于左侧,3例位于右侧。肿瘤体积大,形态不规则,长径5.2~15.0 cm;与对侧正常睾丸相比,病变侧睾丸结构消失,代之以混杂囊实性信号肿块,肿块内囊变坏死呈长T1、长T2信号,肿块实质部分呈等T1、稍短T2信号,内见多发条状及网格状短T2分隔。有2例合并出血,出血区呈片状稍短T1、长/短T2信号(图1A~C),病变边界欠清晰,向上累及同侧附睾及精索。4例可见盆腔内、腹股沟多发肿大淋巴结,其中1例行胸腹MRI检查见腹膜后多发肿大淋巴结及脊柱、肋骨和骨盆多发骨转移。
1.4.2 DWI表现 5例患者的DWI和ADC图均呈不均匀高/低混杂信号,且ADC图高信号区为肿瘤囊变坏死,低信号区为肿瘤实性部分(图1D~E)。肿瘤实质区ADC值范围为(0.649~1.072)×10-3mm2/s,平均ADC值为(0.848±0.187)×10-3mm2/s;对侧正常睾丸ADC值范围为(0.873~1.239)×10-3mm2/s,平均ADC值为(1.054±0.159)×10-3mm2/s,肿瘤平均ADC值低于正常睾丸。
1.4.3 动态增强表现 5例患者的动态增强TIC类型:Ⅰ型4例(图1F),Ⅲ型1例。Tpeak87~320(158.4±95.9) s;MCER 81.7%~154.6%(120.5%±35.5%)。延迟期增强T1WI显示肿瘤呈轻中度不均匀条状及网格样强化,囊变坏死区不强化,呈“丝瓜瓤”样改变(图1G),其中有1例合并骨转移的患者肿瘤呈不均匀强化(图1H)。
1.4.4 病理表现 5例均为胚胎型RMS。肿瘤大体观呈灰白灰黄色,切面质软到中,呈囊实性;合并出血者囊性部分含红棕色液体;实性部分切面较硬;1例可见不完整包膜。镜下见肿块中心典型的横纹肌母细胞,细胞核偏位,椭圆形,有中心核仁和嗜酸性胞浆,周围可见疏松黏液样区和坏死区(图1I,HE染色);免疫组化染色:Desmin、Myo D1(图1J)、Myogenin均为(+),细胞增殖指数(Ki-67)30%~100%,4例CD56为(+),1例抑癌基因整合酶相互作用分子1(INI-1)为(+)。
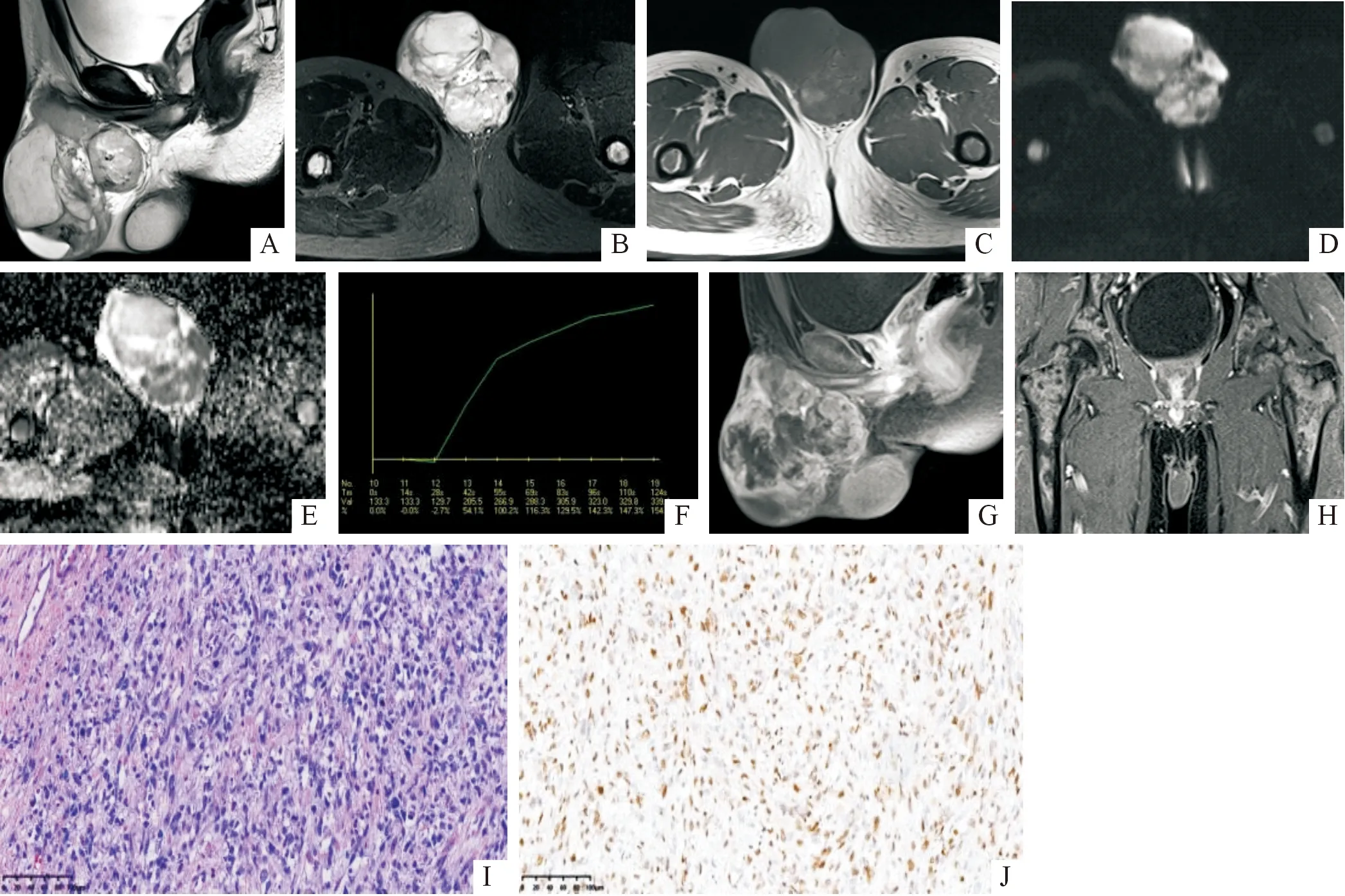
患者,男,20岁。A:矢状位T2WI,示左侧睾丸内不规则团块状、大小约6.8 cm×9.7 cm×8.9 cm的囊实性肿块,与右侧正常睾丸相比,囊变坏死区呈高信号,实质区呈稍低信号,内见斑片状低信号出血灶,同侧附睾显示不清;B:横轴位脂肪抑制T2WI,示病灶呈不均匀混杂高及稍低信号,内见多发条状及网状低信号分隔影;C:横轴位T1WI,示病灶囊变坏死区呈低信号,实质区呈等信号,内斑片状稍高信号为出血灶;D、E:DWI和ADC图,示病灶呈不均匀高/低混杂信号,ADC图上,囊变坏死区呈高信号,实质区呈明显低信号,实质区ADC值为0.649×10-3 mm2/s;F:动态增强TIC,呈Ⅰ型,Tpeak为124 s,MCER为154.6%;G:矢状位脂肪抑制增强T1WI,病灶实质呈中度不均匀条状及网格样强化,囊变坏死区未见强化,呈“丝瓜瓤”样改变;H:冠状位脂肪抑制增强T1WI,示骨盆多骨不均匀强化;I:胚胎型RMS的病理结果显示中心典型的横纹肌母细胞,周围见疏松黏液样区和坏死区(HE染色);J:Myo D1蛋白阳性表达(免疫组化)
2 讨论
睾丸RMS非常罕见[5],胚胎型RMS是其较为常见的病理亚型,好发于20岁以下的儿童和青少年,好发年龄呈双峰分布,为5岁和16岁[6],偶见于成人。本组病例最小年龄16岁,最大年龄21岁,中位年龄为18岁。睾丸RMS早期多无症状,表现为单侧睾丸内无痛性肿块,临床易忽略、漏诊及误诊;RMS恶性程度高,短期内可迅速增大,随着肿物的增大,会侵犯、破坏正常睾丸结构。术前影像学检查给予RMS较为明确的定位定性诊断非常重要。
正常睾丸在T2WI上表现为均匀一致的高信号。以正常睾丸作为对照,5例均表现为病灶侧正常睾丸结构消失,代之以形态不规则的较大体积肿块。肿瘤信号混杂,呈囊实性:在T1WI上,囊变坏死呈低信号,实质区呈等信号;在T2WI上,囊变坏死呈高信号,实质区呈稍低信号,内见条网状低信号分隔;出血区呈T1WI高信号、T2WI高或低信号。肿瘤边界欠清晰,可向上累及同侧附睾及精索,合并淋巴结和(或)骨转移。
本文以MRI常规平扫为基础,同时行DWI和多期动态增强扫描。DWI是一种无创检测活体组织内水分子扩散运动的MR功能成像技术,能够定量评估组织内水分子扩散运动,对肿瘤的诊断及鉴别具有极高的准确性[7]。恶性肿瘤组织中,肿瘤细胞排列紧密,细胞密度高,水分子扩散明显受限,ADC值偏小。Algebally等[8]得出的睾丸正常组织和恶性肿瘤的ADC值分别为(1.12±0.01)和(0.79±0.16),且差异有统计学意义。本组5例RMS的ADC值为[(0.848±0.187)×10-3mm2/s],低于正常睾丸的ADC值[(1.054±0.159)×10-3mm2/s],与文献报道一致。MRI动态增强扫描是一种利用顺磁性对比剂在血管及组织内进出及其分布状态,从而评价肿瘤内微血管情况的检查方法,一定程度上反映肿瘤组织血流动力学信息,对良恶性病变的鉴别有一定的帮助[9]。文献[10]报道,Ⅰ型TIC提示良性,Ⅱ型提示良恶性部分重叠,Ⅲ型提示恶性。目前国内外未见关于睾丸RMS动态增强扫描的TIC的相关研究报道,本组肿瘤TIC以Ⅰ型(良性)为主,但并不完全符合Ⅰ型曲线特征。临床数据提示肿瘤血供不丰富,且呈渐进性强化,其主要原因可能为血-睾屏障能够轻度阻碍血液循环中的某些物质渗透到曲细精管内,最终导致信号偏低。延迟期增强显示肿瘤呈轻中度不均匀条状及网格样强化,囊变坏死及出血区不强化,呈“丝瓜瓤”样改变,具有明显特征性。
影像学上,RMS需与睾丸最常见的精原细胞瘤进行鉴别,后者好发于中青年,年龄较前者偏大,MRI以短T2信号为主(与睾丸对比),边界清晰,信号均匀,出血、坏死较少见[11]。睾丸畸胎瘤瘤内多伴有钙化、脂肪信号及多囊性病灶,恶性畸胎瘤增强后实性成分明显强化。间质细胞瘤、绒癌、类癌体积较小,呈中度以上明显均匀强化。胚胎性癌多见于20~40岁男性,增强后实性成分明显强化,AFP和β-HCG升高,有助于鉴别。睾丸淋巴瘤多由全身性淋巴瘤累及,好发于中老年男性,双侧、多发多见,信号均匀,中等强化,囊变、钙化及出血极少见。
睾丸胚胎型RMS的最终确诊需要依靠病理学诊断,其组织学特点主要为束状交错排列的梭形瘤细胞,其间夹杂着的小圆形幼稚的胚胎型瘤细胞,细胞核深染,有明显的病理性核分裂;在生物学上,这种细胞越多,肿瘤的恶性程度越高。细胞排列紧密的致密区和疏松的黏液样组织交替分布,不同病例疏松区和致密区含量不同,可见灶性坏死和出血,病理学基础决定了MRI影像学表现。本组5例睾丸胚胎型RMS病理均符合上述特征,且免疫组化染色检查中作为RMS较敏感的Desmin、Myogenin以及Myo D1蛋白均为阳性[12],MRI表现与病理学表现一致。
超声以往常是睾丸首选的影像检查方法[13]。目前,随着新技术的推广应用,MRI软组织分辨率高,无电离辐射,可多方位多参数成像,能够提供直观清晰的解剖信息和丰富的功能信息,有助于评估病变的部位、范围、成分、血供、与周围结构的关系、腹盆腔淋巴结和其他器官有无转移等情况,从而获得较为明确的诊断和鉴别诊断,因此对于睾丸病变,推荐术前常规首选MRI检查[14]。
综上所述,睾丸胚胎型RMS的临床和MRI诊断要点主要包括:儿童和青少年单侧睾丸内无痛性肿块,MRI平扫见睾丸内巨大不规则团块状囊实性肿块,呈混杂长/等T1、长/稍短T2信号,DWI呈混杂高/低信号,肿块实质区ADC值多低于正常睾丸,囊变坏死区在ADC图上呈明显高信号,增强后肿块血供不丰富,呈轻中度渐进性不均匀“丝瓜瓤”样强化,TIC曲线以Ⅰ型曲线为主。由于胚胎型RMS恶性程度高,早期可发生转移,术前应常规行胸腹部检查排除转移。根治性手术及化疗是RMS的首选治疗方法,术前对睾丸RMS进行明确的定位诊断以及评估邻近结构及转移情况,有助于临床手术方案的制定。
