矽肺大鼠肺组织差异蛋白筛选与质谱分析
2021-06-08刘素娜郝长付赵德华王丽雯
刘素娜,郝长付,暴 磊,赵德华,王丽雯,姚 武
1)郑州大学第三附属医院新生儿疾病筛查科 郑州 450052 2)郑州大学公共卫生学院劳动卫生与职业病学教研室 郑州 450001 3)河北医科大学公共卫生学院劳动卫生与环境卫生学教研室 石家庄 050017
矽肺是由于长期低浓度吸入游离二氧化硅(SiO2)粉尘引起的以肺间质炎症和弥漫性纤维化为主的全身性疾病[1]。目前矽肺的发病机制尚不完全清楚,没有早期诊断的特异性生物标志物,也没有逆转肺纤维化的治疗药物和方法,因而矽肺仍未得到有效控制,其防控形势依然严峻[2]。有研究[3]证实,矽肺纤维化过程中有许多生长因子、炎症细胞因子等蛋白质和活性氧(reactive oxygen species,ROS)的参与。SiO2暴露会引起机体内环境稳态的变化,也必然会引起肺组织中多种蛋白质或小分子物质表达水平的改变,这是矽肺肺组织差异蛋白质组学研究的理论基础。以往对蛋白质的研究检测方法有Western blot、免疫组化、ELISA等,常常只能知道一种或几种蛋白质的表达情况,而应用差异蛋白质组学则可以得到两种样品中所有蛋白质表达情况的差别,可以整体、综合、全面地反映在特定情形、特定时段样品蛋白质组的情况。
课题组前期研究[4]发现,在3周内细胞性结节形成的炎性反应期,大鼠肺组织中细胞因子IFN-γ和IL-18表达均显著增高。本研究拟采用差异蛋白质组学中经典的双向电泳技术,再联合基质辅助激光解吸电离飞行时间串联质谱(MALDI-TOF-MS)进行质谱鉴定,筛选SiO2暴露3周大鼠矽肺早期炎症反应期肺组织中的差异蛋白,建立矽肺差异蛋白图谱,并利用Western blot技术挑选差异蛋白进行鉴定,为寻找早期矽肺炎症可能的干预生物标志物、探索矽肺发病机制提供理论基础。
1 材料与方法
1.1实验动物SPF 级 SD 大鼠20只,雄性,180~220 g,6~8 周龄,购自河南省实验动物中心[许可证号SCXK(豫)2010-0002]。采用随机数字表法将20只大鼠随机分为对照组和模型组(每组10只)。
1.2主要实验试剂与仪器游离SiO2标准品(粒径在1~5 μm的>80%)购自美国Sigma公司,24 cm pH 3~10线形IPG胶条、Bio-lyte3/10两性电解质均购自GE Healthcare公司,抗组蛋白H2B1型(H2B1)抗体、钙网蛋白(calreticulin,CRT)抗体和GAPDH 抗体购自美国Abcam公司,免疫组化试剂盒、辣根过氧化物酶标记的抗兔或抗小鼠IgG抗体购自北京中杉金桥生物技术有限公司,PVDF膜购自美国Millipore公司,RIPA组织蛋白裂解液、ECL化学发光试剂、SDS-PAGE配制试剂盒购自武汉碧云天生物技术研究所,DYY-6C型垂直电泳仪购自北京六一仪器厂,IPGphor等电聚焦仪、Ettan DALT Ⅱ垂直电泳仪购自Amersham Biosciences公司,5800 MALDI TOF/TOF基质辅助激光解吸电离飞行时间串联质谱仪购自美国AB公司,凝胶图像扫描仪、Image Master 2D Platinum 6.0购自GE Healthcare公司,Centrifuge 5424 R离心机购自Eppendorf公司。
1.3大鼠矽肺模型的建立采用吸入式气管滴注法建立大鼠矽肺模型[5-6]。将游离SiO2标准品研磨,180 ℃干燥4 h,恒重,用灭菌生理盐水配成100 g/L的SiO2悬液。高压蒸汽灭菌后4 ℃冰箱保存,染尘前加2 000 U/mL青霉素。采用异氟烷大鼠自主吸入麻醉法麻醉大鼠,之后大鼠牙齿勾住细绳悬挂于造模染尘架上,用强光手电筒照射颈部气管,从空腔看到一张一合的气管口时用中号无头圆钝灌胃针进行气管内插管。插管成功后快速将1 mL的SiO2悬液推入气管,再向气管内推入2 mL空气,迅速拔管,以尽快解除窒息。对照组以含等量青霉素的无菌生理盐水1 mL代替SiO2悬液,以同样方法向大鼠气管内滴注。1次/d,共染尘3次。于染尘 3 周后处死大鼠。
1.4肺组织HE染色处死大鼠后,取左肺中部约1 cm×1 cm大小的肺组织块,生理盐水冲洗2遍后立即置于体积分数10%的中性甲醛中固定;经常规石蜡包埋后进行切片(片厚3 μm)、HE染色,剩余肺组织-80 ℃保存备用。
1.5肺组织蛋白的提取取肺组织100 mg,用眼科剪剪碎后放进研磨匀浆器中,加1 mL蛋白裂解液置冰上研磨,使蛋白充分裂解;将组织匀浆液转移入新的EP管中,冰浴超声(400 W,工作时间10 s;间隔10 s,共20次)进一步破碎组织细胞,然后4 ℃离心,12 000×g,30 min;吸取上清,4 ℃离心,12 000×g,20 min;吸取上清,4 ℃离心,12 000×g,10 min,取上清液,用Bradford法测定蛋白质浓度后分装,-80 ℃保存备用。
1.6双向电泳将同组大鼠的蛋白质样品等量混匀,取700 μg,加水化上样缓冲液使总体积至450 μL,加入2.5 μg Bio-lyte3/10两性电解质和4 mg DTT混匀,置IPGphor等电聚焦仪进行等电聚焦。等电聚焦程序:30 V,12 h;100 V,1 h;1 000 V,1 h;8 000 V,2 h;8 000 V,55 000 Vh;500 V,5 h。等电聚焦工作温度为20 ℃,每根胶条电流50 μA。等电聚焦结束取出胶条平衡后,移至120 g/L分离胶中进行垂直电泳。每组3次。
1.7二维凝胶电泳(two-dimensionalgelelectrophoresis,2-DE)凝胶图像扫描与质谱分析双向电泳结束后,用考马斯亮蓝染色液对凝胶进行染色,然后用凝胶图像扫描仪采用800 ppi分辨率对染色后的凝胶进行扫描,应用Image Master 2D Platinum 6.0对双向电泳图谱进行分析。标记、挖取差异蛋白点,送生工生物工程(上海)股份有限公司,采用5800 MALDI TOF/TOF基质辅助激光解吸电离飞行时间串联质谱仪进行串联质谱分析,得到每个样品各个肽段的质荷比(M/Z)测定数据,使用Mascot软件,在NCBInr数据库中搜索理论上能与肽段相匹配的蛋白。综合分析蛋白数据库搜索结果、相对分子质量、实际等电点(actual isoelectric point,PI)和得分等因素,对蛋白进行最终鉴定。
1.8肺组织中差异蛋白的Westernblot分析本实验参考文献[7],应用Western blot检测筛选的评分最高和评分最低的差异蛋白在大鼠肺组织中的表达情况。Bradford法测定蛋白质浓度后,调节蛋白浓度,用100 g/L SDS-PAGE分离蛋白,PVDF转膜。50 g/L脱脂奶粉液室温封闭1 h,加一抗4 ℃孵育过夜。TBST洗3遍,辣根过氧化物酶标记的二抗37 ℃孵育30 min,化学发光法显影。采用Image J图像分析软件测定条带灰度值。
1.9统计学处理采用SPSS 21.0对实验数据进行分析,应用两独立样本t检验比较对照组和模型组大鼠肺组织中CRT和H2B1蛋白表达的差异。检验水准α=0.05。
2 结果
2.1大鼠矽肺模型的鉴定染尘3周后,肉眼观察对照组大鼠肺组织粉红色,质软,表面光滑;模型组大鼠双肺体积增大,局部充血、肿胀,表面均匀分布直径1 mm 左右的灰白色小结节,灰白色结节不规则状突出于肺表面(图1)。HE染色显示对照组肺组织结构正常,肺泡结构清晰;模型组大鼠肺组织出现典型的细胞性结节改变,矽结节数量增多且体积增大,肺组织结构有破坏(图2)。

图1 2组大鼠肺组织标本肉眼观

黑色箭头指示细胞性结节
2.2双向电泳与图像分析结果双向电泳图谱见图3。分别对染色后的蛋白点进行匹配,染色匹配率为77%,效果均较好。
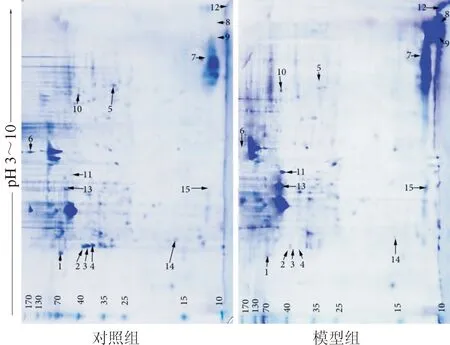
图3 2组大鼠肺组织总蛋白双向电泳图谱
2.3差异蛋白点MALDI-TOF-MS肽质量指纹图谱鉴定与分析结果对双向电泳图谱进行分析,共获得274组蛋白点信息,经过综合对比分析,筛选出15个差异蛋白点。采用一级和二级质谱相结合的方法对15个差异蛋白点进行鉴定,14个蛋白点获得14张良好的肽质量指纹图谱,碰撞碎裂后的母离子肽段均获得了较为丰富的碎片信息,指纹图谱峰信号强,质量高。第10号蛋白肽指纹图谱片段峰主要位于1 000~2 500 M/Z区间(图4)。经与NCBInr蛋白数据库查询比对,其中6个差异蛋白点在数据库中匹配到有意义的蛋白,这6种蛋白分别为原肌球蛋白2(tropomyosin-2,TMP2)、CRT、碳酸酐酶3(carbonic anhydrase 3,CAH3)、H2B1、肌酸激酶M(creatine kinase M chain,CRM)、肌球蛋白调节性轻链(myosin regulatory light chain 2,MLC2),其中TPM2、CRT和CAH3在矽肺大鼠肺组织中表达下调;H2B1、CRM和MLC2表达上调。结果见表1。

图4 2组大鼠肺组织双向电泳图谱中10号蛋白肽指纹图谱
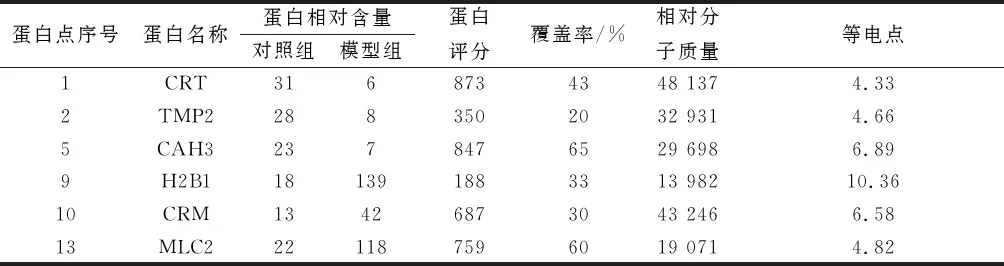
表1 差异蛋白质鉴定结果
2.4Westernblot蛋白分析结果见图5。由图5可知,与对照组相比,差异蛋白评分最高的CRT在大鼠矽肺模型表达降低(t=5.132,P<0.001),评分最低的H2B1表达增高(t=2.145,P=0.017)。

图5 2组大鼠肺组织中CRT和H2B1蛋白表达的比较
3 讨论
本研究采用吸入式气管滴注法成功建立大鼠矽肺模型,HE染色结果显示,染尘3周后模型组大鼠肺组织有较大的炎性结节形成。利用双向电泳和质谱分析技术,通过对2组大鼠肺组织蛋白点的对比分析,找出了15组差异蛋白。双向电泳获得了较为清晰的图谱;每组进行3次染色,匹配效果均较好。这些都说明本实验有较好的重复性和可靠性。
TMP2属于原肌球蛋白(tropomyosin,TM)的一个亚型,是广泛分布于真核生物中的一种细胞骨架蛋白,哺乳动物中存在TM1、TM2、TM3和TM4 4个异构体[8]。有研究[9]证实在大鼠肝纤维化模型组TMP2表达增强,提示其可能参与了肝纤维化的发生和发展过程。CRT是广泛存在于各种真核生物细胞中的多功能调节蛋白,能够维持细胞内的钙稳态,具有分子伴侣、细胞黏附和基因表达调控等多种生物学功能[10]。Lu等[11]研究发现糖尿病小鼠肾脏CRT表达增加,其在糖尿病性肾病肾纤维化的发展中起重要作用。本研究结果显示CRT在矽肺大鼠肺组织中表达降低,可能与矽肺前期炎性细胞和细胞因子动态失衡有关。CAH3是一种细胞质酶,参与了机体线粒体ATP的合成、自身免疫、氧化应激反应等多项重要的生理过程[12]。Staunton等[13]研究发现CAH3水平随肌肉老化逐渐增加,增高的CAH3水平提示人类在衰老的过程中肌纤维逐渐向慢性收缩性纤维转化。H2B1是组蛋白H2B的一个亚型,对染色体的结构有重要作用;H2B在损伤位点的单泛素化可能对DNA双链的断裂修复具有重要作用[14]。本课题组前期研究[15]通过建立矽肺纤维化体外细胞模型共筛选出1 815个基因存在组蛋白差异。该研究结果显示H2B1在矽肺大鼠肺组织中表达增高。CRM是肌酸激酶的重要组成部分,对维持机体能量代谢平衡及机体运动过程起重要作用[16]。研究发现血浆中高水平的CRM能够反映急性心肌梗死预后[17]和作为肌萎缩性侧索硬化症早期出现的指标[18]。Takamori等[19]研究发现肌酸激酶可以作为一种新颖的生物标志来监测某些肿瘤的预后。MLC2是肌球蛋白的主要调节区域,目前MLC2的进化起源、表达模式和功能了解甚少,有研究[20]发现MLC2基因突变会导致心脏结构缺陷和纤维化。
本课题组前期研究检测了矽肺模型大鼠外周血和肺泡灌洗液中DC、Th1/Th2细胞和Th1/Th2细胞因子的表达情况[6,21],结果显示,矽肺大鼠肺脏中DC和Th1/Th2细胞均存在一个动态变化过程,3周是矽肺发展过程中Th1细胞反应占主导的炎症反应期(1周、2周)向Th2细胞反应占主导的纤维化期(6周、9周)的过渡时间。姚三巧等[22]研究发现早期煤工尘肺患者血清中表达特异性细胞因子。基于此,本实验运用双向电泳联合质谱技术鉴定大鼠矽肺初期肺组织差异表达蛋白,对获得的15个差异蛋白点的肽质量指纹图谱进行数据库检索,最终鉴定出6个有意义的蛋白点,应用Western blot检测了CRT和H2B1蛋白在大鼠矽肺模型中的表达情况,发现CRT 在大鼠矽肺模型中表达降低,H2B1表达增高,差异有统计学意义。
综上所述,筛选的差异表达蛋白可能在矽肺纤维化发生发展中发挥作用。
