心腔内超声指导下射频消融治疗心耳起源房性心动过速
2021-06-08陶海龙陆明辉龙德勇赵江涛陈晓伟董建增1
陶海龙,陆明辉,龙德勇,王 琎,赵江涛,朱 揆,陈晓伟,董建增1,
1)郑州大学第一附属医院心内科 郑州 450052 2)首都医科大学北京安贞医院心内科 北京 100029
三维标测系统指导下复杂心律失常的射频消融取得了很好的治疗效果[1-2]。但心耳部位起源的房性心动过速(房速),由于其位于心脏的盲端,结构复杂,基于导管操作安全性的考虑,心耳内部细微结构的解剖重建及标测常不充分,易导致消融失败或复发[3]。以往采用射频导管以及多极标测电极,对心耳结构只能进行粗略的标测,因心耳局部解剖结构复杂,为了增加导管贴靠,过大的导管压力可机械终止房速,导致激动标测无法正常完成[4]。心腔内超声技术可以进行实时非接触性标测,对于心耳尖端以及小叶结构显示清晰,指导导管标测消融具有技术优势,但目前临床应用较少。作者采用心腔内超声技术指导射频消融治疗心耳起源房速,效果显著,现报道如下。
1 对象与方法
1.1研究对象收集郑州大学第一附属医院、北京安贞医院自2017年1月至2020年1月,症状性、药物治疗无效的20例心耳起源房速患者的临床资料(术前常规行心电图、心脏超声检查)。
1.2电生理检查术前停用抗心律失常药物>5个半衰期,局部麻醉后穿刺左、右股静脉,放置十极可控弯电极至冠状静脉窦、四极标测电极至右心室。程序刺激诱发心动过速,不能诱发者给予异丙肾上腺素后重复刺激直至诱发;电生理检查排除旁道及房室结双径路机制所致室上速。
1.3心腔内超声指导下的解剖重建心动过速诱发后,首先采用盐水灌注压力消融导管(SmartTouch,Biosense-Webster,Diamond Bar,CA,美国)进行心腔解剖重构(分辨率设置为12)和激动顺序标测。明确心动过速起源于心耳后,换用心腔内超声导管(CartoSound,Biosense-Webster,Diamond Bar,CA,美国)对心耳局部进行细致解剖建模。具体步骤如下:①右心耳解剖建模。由左股静脉11F鞘管置入CartoSound导管于下腔静脉,旋转导管使超声扇面至2:00方向,至三尖瓣环扇面;然后旋转P弯使CartoSound导管头端呈反弯,微调R/L弯使右心耳结构在扇面上充分展示。再在上述扇面的切线平面构建右心耳的解剖模型(图1)。②左心耳解剖建模。CartoSound导管在下腔静脉三尖瓣环水平,旋转导管至3:00扇面方向,输送或回撤导管在不同高度扇面上构建左心耳解剖模型。
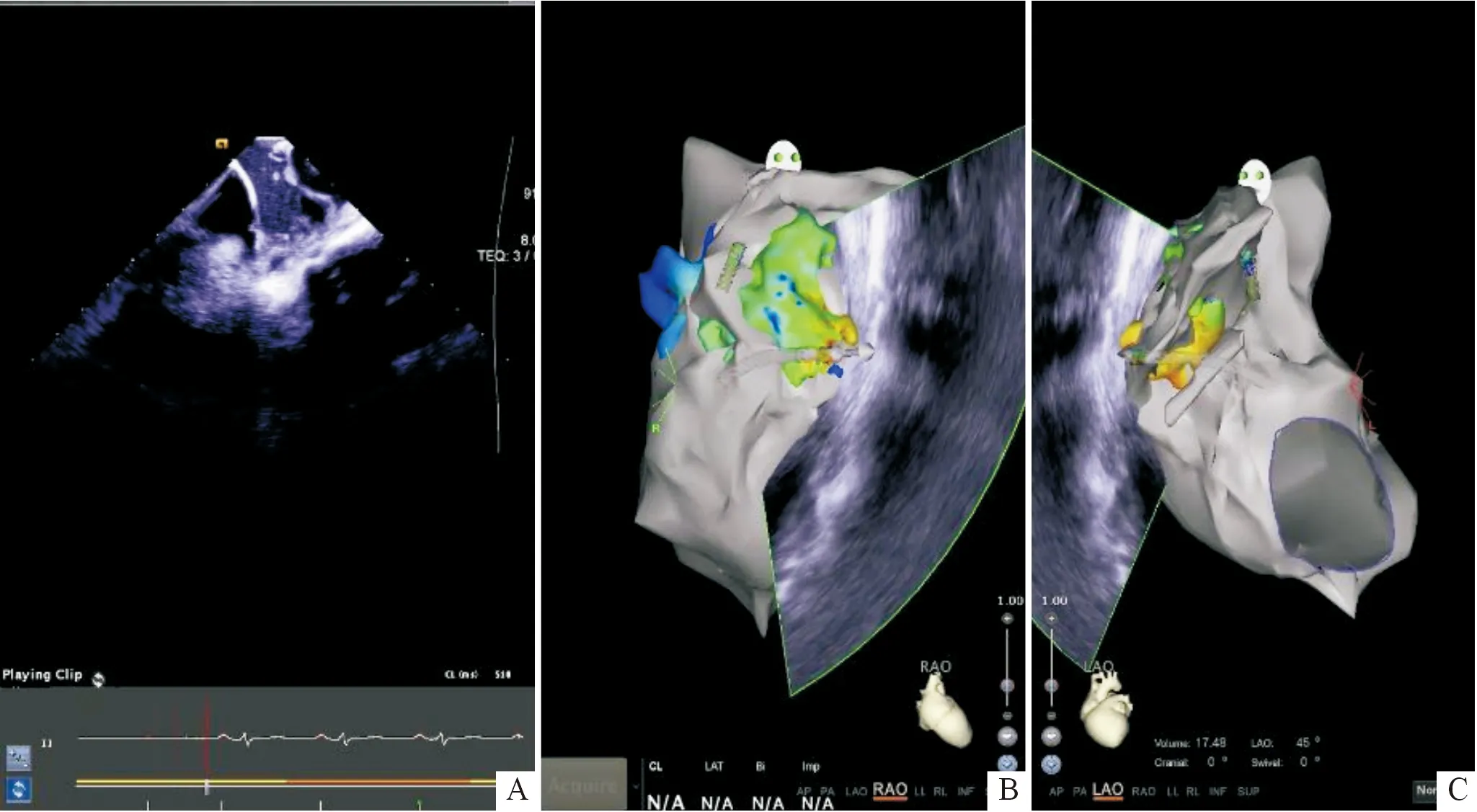
A:心腔内超声实时影像;B、C:心腔内超声对右心耳局部的三维重建;可见消融电极位于右心耳的分叶内
CartoSound导管完成心耳局部解剖建模后,使用冷盐水灌注压力消融导管在心耳局部再次进行解剖-激动顺序标测,结合单级电图将局灶起源范围尽可能最小化;分辨率设置为20,导管压力控制在5~10 g。
1.4射频消融治疗明确心耳内局灶最早激动点后,以温度43 ℃、能量35 W、流速17 mL/min放电消融。CartoSound导管实时监测消融中导管移动,如压力或阻抗突然增高,立即停止放电。
以消融终止房速发作,应用异丙肾上腺素行程序刺激不能诱发房速作为消融终点。消融后6个月内,心电图及动态心电图检查证实有无复发。
术中持续监测患者血压、心率、指脉氧参数,术中经胸超声检查明确有无心脏瓣膜损伤及心包积液。
1.5统计学处理采用SPSS 24.0进行数据分析。应用配对t检验比较射频消融手术前后左房直径变化的差异。检验水准α=0.05。
2 结果
2.1临床资料20例患者中男12例,女8例,年龄(34.3±9.7)岁,病史(23.8±22.6)个月,其中5例为再次消融病例。心脏超声检查:左房(33.1±4.5) mm(7例左房扩大),左室射血分数(LVEF):(54.6±5.1)%(5例LVEF下降,伴有心衰症状);使用抗心律失常药物(1.45±0.88)种。患者具体资料见表1。
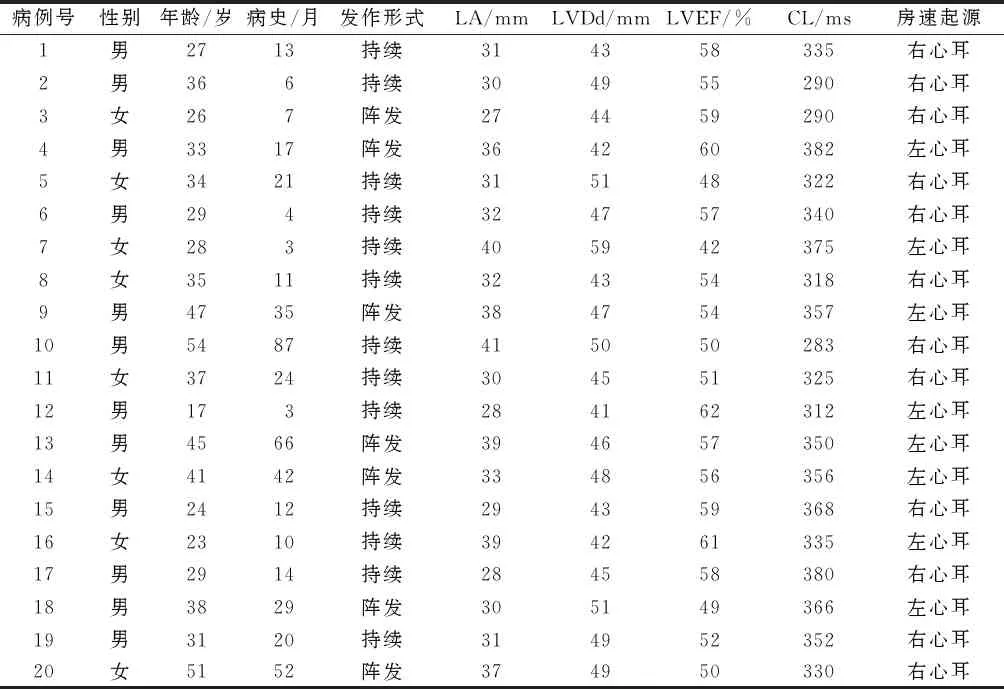
表1 房速患者临床资料
2.2电生理检查20例患者中13例呈无休止发作,7例采用程序刺激或应用异丙肾上腺素后诱发,房速周长(338±30) ms。20例均完成心腔内超声指导下心耳解剖重建及激动顺序标测,其中左心耳起源8例(基底部5例,尖部3例),右心耳起源12例(基底部6例,尖部4例,广泛起源2例,图2)。平均标测(45.25±6.29)点,消融靶点局部激动较CS电极A波提前(40.55±4.45) ms,靶点放电导管压力(7.25±1.33) g,平均放电(2.85±1.31)次。术中患者均达到消融终点,围术期未出现心包填塞、穿刺部位出血等消融并发症。

A:心腔内超声指导下右房解剖重建;B:房速发作心电图;C、D:房速激动顺序标测及靶点图,可见消融部位广泛而弥漫
2.3随访术后随访6个月,左心耳起源房速复发1例,右心耳起源房速复发2例。右心耳起源复发的1例再次消融成功;另2例再次消融后仍有发作,后行外科微创心耳切除,术后未再复发。7例术前左房扩大者随访期左房直径显著缩小[(38.6±1.7)mmvs(33.1±1.6) mm;t=7.550,P<0.001]。5例伴有LVEF下降者,随访期LVEF恢复正常。
3 讨论
人群中房速患病率为5%~10%[5],年轻人及孕产妇房速多见,其中右心耳起源房速约占所有房速的3.8%,而左心耳起源房速则更少(约3%)[6-8]。多数心耳起源房速对抗心律失常药物反应较差,常呈持续性无休止发作,容易合并心功能障碍并诱发心动过速性心肌病。
有研究显示心耳起源房速的导管消融复发率为10%~17%[3],其消融过程中穿孔引起心脏压塞等严重并发症的发生率约为1.8%[9],皆与心耳的特殊组织结构有密切关系。心耳为胚胎时期原始心房发育而成的盲端结构,其内面凹凸不平,富含梳状肌结构,因此在心耳内导管操作受限、无法形成稳定贴靠,常规影像学指导无法进行局部精细解剖重建和激动标测。同时心耳质地菲薄,局部导管压力过高或者粗暴操作易导致心耳穿孔,造成心脏压塞等严重并发症[3,7]。如房速起源于心耳尖端,出于导管消融安全性的顾虑,无法实现精细标测和稳定消融,复发率显著增加;多数患者需要再次消融或其他治疗方式治疗,如心外膜消融、球囊冷冻消融及心耳切除术等[3,10-13]。因此,如何对心耳解剖结构进行精准重建,实现导管在心耳内可操作性及精确标测和消融已成为提高心耳起源房速射频消融疗效、减少围术期并发症的关键。
应用心腔内超声技术可实时显示心耳的分叶结构,实现精细标测,保证消融导管与心耳的稳定贴靠,形成有效消融损伤;此外心腔内超声可以准确显示心耳毗邻的冠状动脉,保证了消融过程的安全性。更为重要的是,心腔内超声技术可对心耳进行非接触性解剖重建,避免了消融导管在重建操作过程中机械碰撞导致房速意外终止。本研究中在心腔内超声指导下,平均导管压力(7.25±1.33)g,在形成稳定贴靠的同时避免了导管标测中机械终止房速。此外,作者在心房解剖标测基础上,采用心腔内超声指导再次对心耳局部进行精细解剖标测,继之压力消融电极进行激动顺序标测,不仅可以对心耳局部分叶结构进行精细的构建,同时还可更加清晰显示局部激动领先部位,进行精准放电消融。有研究[14]显示,孕妇由于妊娠期循环血容量增加及内环境变化,易发生房性心动过速,且心悸、呼吸困难、头晕等症状更明显,对胎儿影响显著。本研究中有4例患者为孕妇,常规消融常常需要多体位投照,辐射无法避免,而心腔内超声指导的标测和消融可以实现零射线的介入操作,避免了过多的辐射。
本组病例中有2例患者右心耳房速靶点呈现弥漫分布,消融后激动顺序发生改变,需要对心耳及心房进行广泛消融方可终止心动过速。提示部分患者可能存在心肌基质的参与,细致、多次的标测消融很有必要。1例患者在再次消融后仍有房速发作,最终转至心外科行右心耳切除术,术后恢复窦性心律,随访无房速发生,提示射频消融无效时行心耳切除术是治疗心耳起源房速的有效方法[14]。
总之,心腔内超声指导下射频消融治疗心耳起源房速安全、有效。但由于本研究样本量小且随访周期短,其远期预后及长期有效性仍需进一步观察。
