新型冠状病毒肺炎患者输注康复者恢复期血浆前后实验室指标的变化
2021-06-08杨乾坤李建斌朱伟涛靳慧芳赵言腾孔永奎吕先萍
邵 明,杨乾坤,李建斌,朱伟涛,靳慧芳,赵言腾,王 静,孔永奎,谢 莹,吕先萍
1)郑州大学第一附属医院输血科 郑州450052 2)河南省红十字血液中心 郑州450000 3)郑州大学第一附属医院检验科 郑州 450052
新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是由SARS-CoV-2所致的急性呼吸道传染病,已引起全球大范围的感染[1]。该疾病可导致严重的呼吸系统症状,一部分患者会出现急性呼吸窘迫综合征及多器官功能衰竭,目前尚无治疗特效药。恢复期血浆(convalescent plasma,CP)作为一种被动免疫疗法[2],含有针对病原体的中和抗体,通常用于新出现的尚无特定疫苗或药物治疗的感染性疾病的治疗。我国《新型冠状病毒肺炎诊疗方案(试行第五版)》[3]中首次纳入CP治疗,随后在第六版、第七版以及《新冠肺炎康复者恢复期血浆临床治疗方案(试行第二版)》[4]中对献血浆者的招募,血浆的采集、制备、检测和临床应用有了更详细的描述。本研究对接受COVID-19 CP治疗的11例重型和危重型COVID-19患者输注前后各项实验室指标的变化进行了分析。
1 对象与方法
1.1研究对象以2020年1月31日至2020年2月29日在郑州大学第一附属医院接受COVID-19 CP治疗的11例COVID-19患者为研究对象。患者均按照《新型冠状病毒肺炎诊疗方案(试行第五版)》的标准进行诊断、分型,其中重型4例,危重型7例。11例SARS-CoV-2核酸持续阳性,由医院各科室会诊及筛选后,符合COVID-19 CP治疗的临床适应证,并排除禁忌证。COVID-19 CP应用遵循以下原则:①原则上发病不超过3周,SARS-CoV-2核酸检测阳性或临床专家判定患者存在病毒血症。②病情进展快的重症患者、危重症早期患者或经临床专家综合评估认为需要进行血浆治疗的患者。禁忌:有血浆、人体血浆蛋白类制品、枸橼酸钠过敏史者,有亚甲蓝过敏史者,有其他严重过敏史或血浆使用禁忌者。不宜使用:危重型终末期者,多脏器功能衰竭无法逆转者,非中和SARS-CoV-2目的的治疗,临床医生综合评估认为存在其他不宜输注的情形。该研究符合赫尔辛基宣言的原则,通过该院伦理委员会的审核,伦理审查编号 2020-KY-227。
所有患者在输注CP前已进行了氧疗、抗病毒治疗,同时防治并发症;治疗基础疾病,预防继发感染等。
1.2COVID-19CP的采集和制备捐献者均符合《新冠肺炎康复者恢复期血浆临床治疗方案(试行第二版)》中要求的捐献条件:距首发症状时间少于3周,符合最新版诊疗方案中解除隔离和出院标准,年满18岁,原则上不超过55岁,体重男性不低于50 kg/女性不低于45 kg,无经血传播疾病史,经临床医师综合评估后认为可以捐献血浆。捐献者献血前经过身份核实并进行输血前告知工作。由河南省红十字会血液中心进行血浆的采集,采用美国血液技术公司MCS+型血细胞分离机采集,每次采集血浆200 mL,快速置于-20 ℃以下冰冻保存。同时留样,遵照《血站技术操作规程(2019版)》[5]进行血液一般质量、乙肝、丙肝、艾滋病病毒标志物、梅毒抗体、ALT及SARS-CoV-2核酸检测。乙肝、丙肝、艾滋病病毒标志物血清学及核酸检测阴性,梅毒抗体两次血清学检测为阴性,ALT正常,SARS-CoV-2核酸单人份检测结果阴性的血浆为合格。
1.3输注过程根据《新冠肺炎康复者恢复期血浆临床治疗方案(试行第二版)》给予患者200~400 mL(4~5 mL/kg)ABO同型的COVID-19 CP,患者及其家属被详细告知使用目的和风险并签署治疗同意书。输注起始的15 min内慢速输注,严密监测是否发生输血不良反应,若无不良反应,可根据病情调整滴速至120~300 mL/h。若出现输血不良反应,及时记录,并根据《AABB技术手册(第18版)》[6]中输血不良反应的处理方案对症处理。主要输血不良反应包括输血相关循环超负荷、输血相关急性肺损伤、输血相关呼吸困难、过敏反应、输血相关低血压反应、非溶血性发热反应、急性溶血性输血反应、迟发性溶血性输血反应、感染性输血反应、其他/未知等。
1.4实验室指标检测方法患者输注COVID-19 CP前后每日监测咽拭子SARS-CoV-2核酸,检测试剂盒为上海博杰生物科技有限公司和上海之江生物科技股份有限公司产品。至少间隔24 h连续2次核酸阴性者判定为核酸转阴,核酸转阴时间以第1天转阴时间为准。输注前及输注后根据病情每8~12 h抽取动脉血进行血气分析,计算动脉氧分压(PaO2)和氧合指数(PaO2/FiO2)。24 h内留取静脉血查血常规,检测C反应蛋白(CRP)、降钙素原、ALT、白蛋白、总胆红素、肌酐、PT、APTT、D-二聚体、纤维蛋白(原)降解产物、超敏肌钙蛋白T、肌酸酶同工酶、N端脑钠肽前体(NT-proBNP)、LDH水平,严格按照试剂盒说明书操作。
2 结果
2.1患者一般情况及COVID-19CP输注效果重型患者4例,男/女为2/2,年龄32~79岁,≥60岁2例; 2例有基础疾病,其中慢性乙型肝炎1例,2型糖尿病1例。4例从确诊到输注COVID-19 CP的时间为10~25 d,输注200 mL者2例, 400 mL者2例;输注CP后1~2 d咽拭子核酸全部转阴;输注过程中及输注后均未发生输血不良反应。
危重型7例,男/女为6/1,年龄30~83岁,≥60岁6例;6例有基础疾病,其中冠心病2例,慢性支气管炎1例,妊娠期糖尿病1例,高血压合并脑梗死及乙肝1例,慢性阻塞性肺疾病合并高血压1例。7例从确诊到输注CP的时间为13~24 d,输注200 mL者5例, 400 mL者2例;5例输注后2~5 d咽拭子核酸转阴;输注过程中及输注后均未发生输血不良反应;1例输注后第3天心脏骤停死亡,1例于输注后第6天CO2潴留、病情恶化死亡,均排除输血不良反应。
2.2重型患者输注前后各实验室指标的变化主要指标测定结果见表1。重型4例输注前PaO2和氧合指数降低2例,输注后24 h和48 h全部正常。
输注前,白细胞计数增高1例,输注后24 h全部正常。输注前淋巴细胞绝对值降低3例,CRP和降钙素原水平升高3例;输注后24 h,2例CRP、1例淋巴细胞绝对值正常;输注后48 h,1例CRP、1例淋巴细胞绝对值、3例降钙素原水平仍未正常。
输注前,1例ALT、1例总胆红素、3例D-二聚体、1例纤维蛋白(原)降解产物水平增高,2例白蛋白水平降低;输注后48 h,仍有1例白蛋白、1例总胆红素、3例D-二聚体、1例纤维蛋白(原)降解产物水平未正常,1例PT、APTT增高,1例纤维蛋白原水平降低。
输注前,1例肌酸酶同工酶、3例NT-proBNP、2例LDH水平增高;输注后48 h,1例LDH水平正常,余指标异常者未有改善。
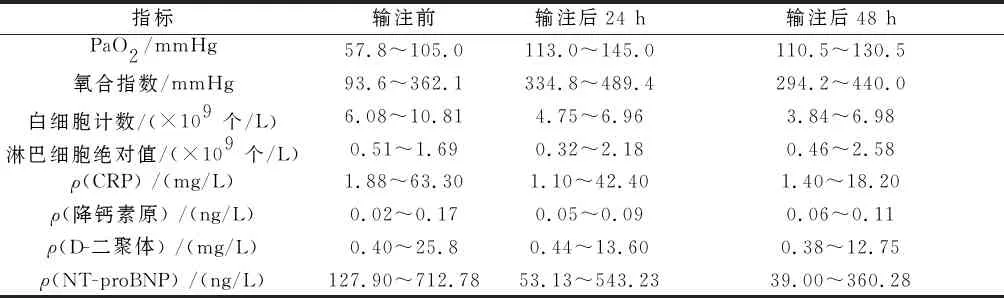
表1 4例重型患者输注COVID-19 CP前后主要实验室指标的变化
2.3危重型患者输注前后各实验室指标的变化主要指标测定结果见表2。危重型7例输注前PaO2降低5例,氧合指数降低7例;输注后24 h和48 h,有3例PaO2正常,但6例氧合指数仍降低。
输注前,2例白细胞计数升高,5例淋巴细胞绝对值降低,7例CRP和降钙素泵水平均增高;输注后24 h,指标异常者无改善;输注后48 h,仅1例淋巴细胞绝对值恢复正常,余指标未有改善。
输注前,4例总胆红素、1例肌酐、2例PT和APTT增高,2例白蛋白、2例纤维蛋白原水平降低,7例D-二聚体和纤维蛋白(原)降解产物水平均增高;输注后48 h,仍有3例总胆红素水平增高,1例PT、APTT水平增高,3例纤维蛋白原水平降低。
输注前,2例超敏肌钙蛋白T、1例肌酸酶同工酶、6例NT-proBNP水平增高,7例LDH均增高;输注后 均未恢复正常。

表2 7例危重型患者输注COVID-19 CP前后主要实验室指标的变化
2.4典型病例患者重型1号,男,32岁,无基础疾病,确诊第9 天入院,确诊第10天输注COVID-19 CP 400 mL,同时应用干扰素α-2b雾化吸入和羟氯喹。输注前患者发热(38.6 ℃),PaO2(66.7 mmHg)降低,氧合指数(190.0 mmHg)降低;白细胞计数(12.92×109个/L )增高,淋巴细胞绝对值(0.75×109个/L)降低;CRP(68.30 mg/L)、降钙素原(0.13 ng/L)、NT-proBNP(788.70 ng/L)水平增高,白蛋白(29.30 g/L)降低,D-二聚体(0.25 mg/L)正常,余指标基本正常。输注CP后,患者体温下降,PaO2和氧合指数仍高, 白细胞计数、CRP、降钙素原和NT-proBNP水平降低,淋巴细胞绝对值仍高,输注后第2天和第3天连续核酸检测阴性,输注后第7天出院。
患者危重型4号,男,62岁,既往患高血压、脑梗死和慢性乙肝,确诊后第14 天入院,入院时患者气管切开、呼吸机辅助通气,肺部合并细菌感染和继发真菌感染,肝功能损伤,确诊后第18天输注COVID-19 CP 400 mL,同时应用克立芝、磷酸氯喹抗病毒及对症治疗。输注前24 h患者间断发热(36.4~38.2 ℃),PaO2波动于87.9~108.0 mmHg,氧合指数波动于214.0~240.0 mmHg,白细胞计数(8.98×109个/L)增高,淋巴细胞绝对值(0.30×109个/L)降低,CRP(67.10 mg/L)、降钙素原(0.15 ng/L)、总胆红素(31.50 μmol/L)、D-二聚体(4.33 mg/L)、纤维蛋白(原)降解产物(11.08 mg/L),NT-proBNP(1 033.00 ng/L)、LDH(332.00 U/L)水平增高,白蛋白(27.20 g/L)降低,余指标基本正常。输注CP后24 h体温正常,白细胞计数、总胆红素、D-二聚体、纤维蛋白(原)降解产物、NT-proBNP、LDH降低,余无明显改善;输注后48 h,体温持续正常,白细胞计数、CRP和降钙素原、总胆红素、D-二聚体、纤维蛋白(原)降解产物、NT-proBNP、LDH水平较输注后24 h降低,PaO2、氧合指数、淋巴细胞绝对值和白蛋白水平无明显改变;输注后第4天和第5天连续核酸检测阴性。
3 讨论
CP疗法是指采集康复者恢复期富含抗体的血液后输注给其他患者,为一种被动免疫疗法[2];其可能的作用机制包括直接中和病毒、控制高免疫反应和对高凝状态的免疫调节等[7-8]。CP中的中和抗体在病毒清除中至关重要,被认为是预防病毒性疾病的关键[9]。除中和抗体外,CP中还含有其他保护性成分,包括IgG、IgM、抗炎细胞因子、凝血因子以及其他蛋白质。输注CP可以抑制致病性抗体驱动的炎症级联反应、补体级联反应激活导致的细胞损伤[7]。在SARS和埃博拉病毒感染的治疗中,应用CP治疗后患者体内病毒载量下降,病毒特异性中和抗体增加[10-12]。目前也有多个研究[13-15]显示,应用CP后COVID-19患者体内病毒载量下降,体温恢复正常,淋巴细胞水平增高,CRP和IL-6降低,氧合指数增加,随后肺部影像学有所改善。本研究对重型和危重型COVID-19患者输注CP前后的动脉血气分析、血常规、CRP、降钙素原、肝肾功能、凝血功能、心肌标志物等多个指标进行了检测,以间接了解输注CP对患者体内各器官的影响。因被动免疫维持时间短,大多报道[10-15]应用CP后24 h患者体内病毒载量下降,因此本研究选择输注后24 h、48 h作为检测时间点。
本研究11例患者中,输注CP后5 d内,9例病毒核酸转阴, 2例病毒核酸未转阴者分别于输注后第3天和第6天死亡。重型和危重型患者输注后24 h内均PaO2和氧合指数升高、白细胞计数下降、淋巴细胞绝对值增高、CRP和降钙素原水平降低;提示输注CP可抑制致病性抗体驱动的炎症级联反应,减轻细胞损伤,改善呼吸功能。
有文献[16]报道COVID-19患者D-二聚体水平与死亡相关。本研究结果也显示重型和危重型患者D-二聚体水平均增高,输注CP后D-二聚体水平降低,因此CP可能对高凝状态下的免疫调节[7]有一定影响。COVID-19重症和危重症患者易出现心肌损害,报道[16]显示NT-proBNP水平升高是COVID-19患者死亡的独立危险因素。本研究结果也显示CP输注前重型和危重型患者NT-proBNP水平均较高,输注后逐渐下降,提示CP对患者心功能有一定改善作用。本组患者肝肾功能和PT、APTT异常者较少,但重型、危重型患者病情复杂不稳定,用药较多,可能随时会出现肝肾功能、凝血紊乱的状态。
本研究有一定的局限性。①本研究未对CP进行抗体效价的检测。捐献血浆者体内的抗体效价不同,中和病毒的能力也有所差异,且抗体量会随着时间的推移而减少[17]。本组两名核酸未转阴者所输注的CP来自于同一捐献者,核酸未转阴可能与该份CP抗体效价较低有关。②CP治疗时间对疗效有影响。大多数病毒性疾病患者通常在感染后第10~14天发生主要的免疫反应,然后清除病毒。因此,在疾病早期病毒处于细胞之外时给予CP疗效可能会更好[18]。本研究中重型1号患者在发病后第11天进行CP输注,输注后24、48 h内PaO2持续升高,CRP、降钙素原水平下降,淋巴细胞绝对值增高,输注后第4天胸片显示无明显新发渗出影。而其他患者发病后较长时间才接受CP治疗,虽各项指标有所改善,但疗效不如重型1号。③其他抗病毒治疗可能有助于患者的康复,或协同CP发挥治疗作用。此外,一些患者接受糖皮质激素治疗,这可能会干扰免疫反应和延迟病毒清除。④本研究为单中心回顾性分析,因受实验室限制,患者治疗过程中检测项目不完整,未进行核酸定量、病毒抗体、细胞因子水平的动态监测。
本研究初步证实了CP疗法对COVID-19有效。因CP为血液制品,存在输血不良反应等风险,输注前应重视对患者的评估。
