上调环状RNA_8199表达对食管鳞状细胞癌细胞增殖、迁移和侵袭能力的影响
2021-06-08燕迪迪倪凯园姜国忠
王 伟, 燕迪迪,丁 爽,倪凯园,姜国忠
1)郑州大学第一附属医院肿瘤科 郑州 450052 2)郑州大学第一附属医院病理科 郑州 450052
食管癌在全球癌症发病率中排名第7,病死率排名第6[1]。我国90%以上的食管癌病例是食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[2]。由于ESCC起病隐匿,多数患者诊断时已是晚期,预后很差。因此,明确ESCC发生及发展的分子机制,探寻有效的生物标志物及治疗靶标对于ESCC的早期诊断、精准治疗和复发预测意义重大。环状RNA是一类闭合成环的非编码RNA,不具有5’末端帽子和3’末端poly(A)尾巴[3]。目前的研究[4-6]表明环状RNA参与了基因的翻译调控并介导了多种肿瘤的进展。如环状RNA_0000263在宫颈癌细胞系中的表达显著增加,环状RNA_0000263/miR-150-5p/MDM4调控轴可能通过影响p53基因的表达在宫颈癌的发病和发展中发挥重要作用[4]。环状RNA_LDLRAD3在胰腺癌组织和细胞系中高表达,下调其表达可以通过调控miR-137-3p/PTN轴抑制胰腺癌细胞的增殖、迁移和侵袭能力[5]。环状RNA_CDK13在肝癌细胞和组织中表达降低,上调环状RNA_CDK13表达可显著抑制肝癌细胞的增殖、迁移和侵袭能力,并改变细胞周期进程[6]。本研究检测了环状RNA_8199在ESCC细胞中的表达情况,探讨上调环状RNA_8199表达对ESCC细胞增殖、迁移和侵袭能力的影响。
1 材料与方法
1.1主要试剂与仪器RPMI 1640培养基购自美国HyClone公司,胎牛血清购自以色列Biological Industries公司,胰蛋白酶购自北京索莱宝科技有限公司。Trizol试剂购自美国Invitrogen公司,反转录试剂盒购自南京诺唯赞公司,基因组DNA(gDNA)提取试剂盒购自北京天根生化科技有限公司,SYBR Premix Ex TaqTMⅡ购自TaKaRa公司,ABI7500荧光PCR仪购自美国ABI公司。RNase R购自北京天根生化科技有限公司。免疫荧光探针由上海吉玛公司合成,杂交试剂盒购自广州锐博生物技术有限公司,核浆分离试剂盒购自广州博徕斯生物科技有限公司。Lipofectamine 2000购自美国Invitrogen公司,离心机购自德国Eppendorf公司,CCK-8购自日本同仁试剂公司,Transwell小室购自美国Coming公司。
1.2细胞来源及培养人ESCC细胞系KYSE30、KYSE70、KYSE270、KYSE520、KYSE150、KYSE410购自ATCC细胞库。细胞用含体积分数10%胎牛血清、100 U/mL青霉素和0.1 g/L链霉素的RPMI 1640培养基培养。培养环境为体积分数5%CO2、37 ℃恒温培养箱。
1.3RT-PCR检测KYSE520细胞中环状RNA_8199的表达Trizol法提取KYSE520细胞总RNA,用反转录试剂盒合成cDNA,用gDNA提取试剂盒提取KYSE520细胞gDNA,并将反转录产物cDNA和gDNA进行PCR扩增。使用发散引物(上游引物5’-ATGTGGCCAATGGGTTTAAG-3’,下游引物5’-GCAAGCTCAACAGCATGAGA-3’)扩增环状转录本,使用聚合引物(上游引物5’-GAAACAGCAC CCAGGACTA-3’,下游引物5’-CTGATTGAATTCTG GTTCACAG-3’)扩增线性转录本,GAPDH(上游引物5’-GAGTCCACTGGCGTCTTCA-3’,下游引物5’-TGATGATCTTGAGGCTGTTGTC-3’)作为内参,引物均由北京擎科生物技术有限公司郑州分公司合成。将PCR 扩增产物进行琼脂糖凝胶电泳,后置于凝胶成像仪上观察,拍照记录。
1.4Sanger测序鉴定环状RNA_8199的环化剪接点序列从环状RNA Base数据库获取环状RNA_8199序列,据此设计一对引物以扩增包含反向剪切位点的序列,上游引物5’-GCTTCAGGTGTCTTCG CAAT-3’,下游引物5’-AATCTTCATTCCGTGAG GCAAT-3’。以KYSE150和KYSE410细胞的cDNA为模板进行PCR扩增,琼脂糖凝胶电泳后,送河南尚亚生物技术有限公司完成测序验证。
1.5环状RNA_8199在KYSE520细胞中的特性表达Trizol法提取KYSE520细胞中总RNA,将提取的RNA分为RNase R处理组和对照组各10 μg。RNase R处理组用20 U RNase R处理(2 U/μg),对照组用等量双蒸水替代,于37 ℃孵育10 min。两组分别取等量消化产物反转录为cDNA,通过qRT-PCR法检测环状RNA_8199和ATXN10 mRNA的表达,选用 GAPDH 作为内参。反应体系共20 μL:SYBR Premix Ex TaqTMⅡ 10 μL,ROX Reference Dye Ⅱ 0.4 μL,上、下游引物各0.8 μL,灭菌蒸馏水6 μL,cDNA 2 μL。采用2-ΔΔCt法计算目的基因的相对表达量。实验重复3次。
1.6细胞免疫荧光法和核浆分离法检测环状RNA_8199在KYSE520和KYSE270细胞中的亚定位①将KYSE520和KYSE270细胞以每孔6×104个细胞分别接种于12孔板里,弃去培养基,PBS浸洗3次;每孔中加入1 mL 40 g/L多聚甲醛,室温下固定15 min,PBS洗涤3次;加入体积分数1%的Triton破膜15 min,用PBS洗涤3 次后加入体积分数10%的山羊血清室温下封闭1 h;除去山羊血清,加入探针对环状RNA_8199序列的反向剪接区进行荧光原位杂交,4 ℃过夜,PBS洗涤3次,每次5 min;荧光显微镜下观察及照相。②根据核浆分离试剂盒说明对KYSE520和KYSE270细胞进行核浆分离,细胞浆定位内参为S14,细胞核定位内参为U2。qRT-PCR法分别检测细胞核、浆中环状RNA_8199的表达,选用GAPDH作为内参。采用2-ΔΔCt法计算目的基因的相对表达量。实验重复3次。
1.7细胞转染及分组通过Lipofectamine 2000将高表达环状RNA_8199的质粒载体(环状RNA_8199-OE)及阴性对照(环状RNA_8199-NC)分别转染到KYSE30和KYSE70细胞中,48 h后收集细胞并用于后续实验。
1.8CCK-8实验检测环状RNA_8199对KYSE30、KYSE70细胞增殖能力的影响将转染后的KYSE30、KYSE70细胞以每孔2×103个细胞分别接种于96孔板,培养24、48、72和96 h。每个时间点分别向孔中加入 10 μL CCK-8溶液,继续孵育2 h,用酶标仪检测450 nm波长处的OD值。实验重复3次。
1.9平板克隆形成实验检测环状RNA_8199对KYSE30、KYSE70细胞克隆形成能力的影响将转染后的KYSE30、 KYSE70细胞接种于6孔板中(每孔300个细胞),在37 ℃、体积分数5% CO2的环境中培养14 d,室温下甲醛固定15 min,结晶紫染色15 min,冲洗并干燥后置于低倍镜下观察,含有50个细胞以上的集落视为一个克隆,计数克隆数。实验重复3次。
1.10Transwell实验检测环状RNA_8199对KYSE30细胞迁移和侵袭能力的影响细胞迁移实验:将转染后的KYSE30细胞加入无血清培养基中重悬,得到的细胞悬液调整至密度为2×105个/mL,上室中加入200 μL细胞悬液,同时将600 μL含体积分数10%胎牛血清的RPMI 1640加入下室,培养24 h后取出,甲醛固定后用结晶紫溶液染色30 min,PBS冲洗,于100倍镜下选取5个视野观察,计数穿过小室细胞数目。细胞侵袭实验:用 Matrigel基质胶涂于上室,余实验步骤同上。实验重复3次。
1.11统计学处理采用SPSS 25.0进行数据分析。两组间OD值的比较采用2×4析因设计的方差分析;细胞浆和细胞核中环状RNA_8199相对表达量,两组间环状RNA_8199和ATXN10 mRNA相对表达量、细胞克隆形成数、迁移细胞数、侵袭细胞数的比较采用两独立样本的t检验。检验水准α=0.05。
2 结果
2.1KYSE520细胞中环状RNA_8199的表达结果见图1。环状转录本只能通过发散引物在cDNA中扩增出来,而线性转录本可通过聚合引物同时在cDNA 和gDNA中扩增出来。
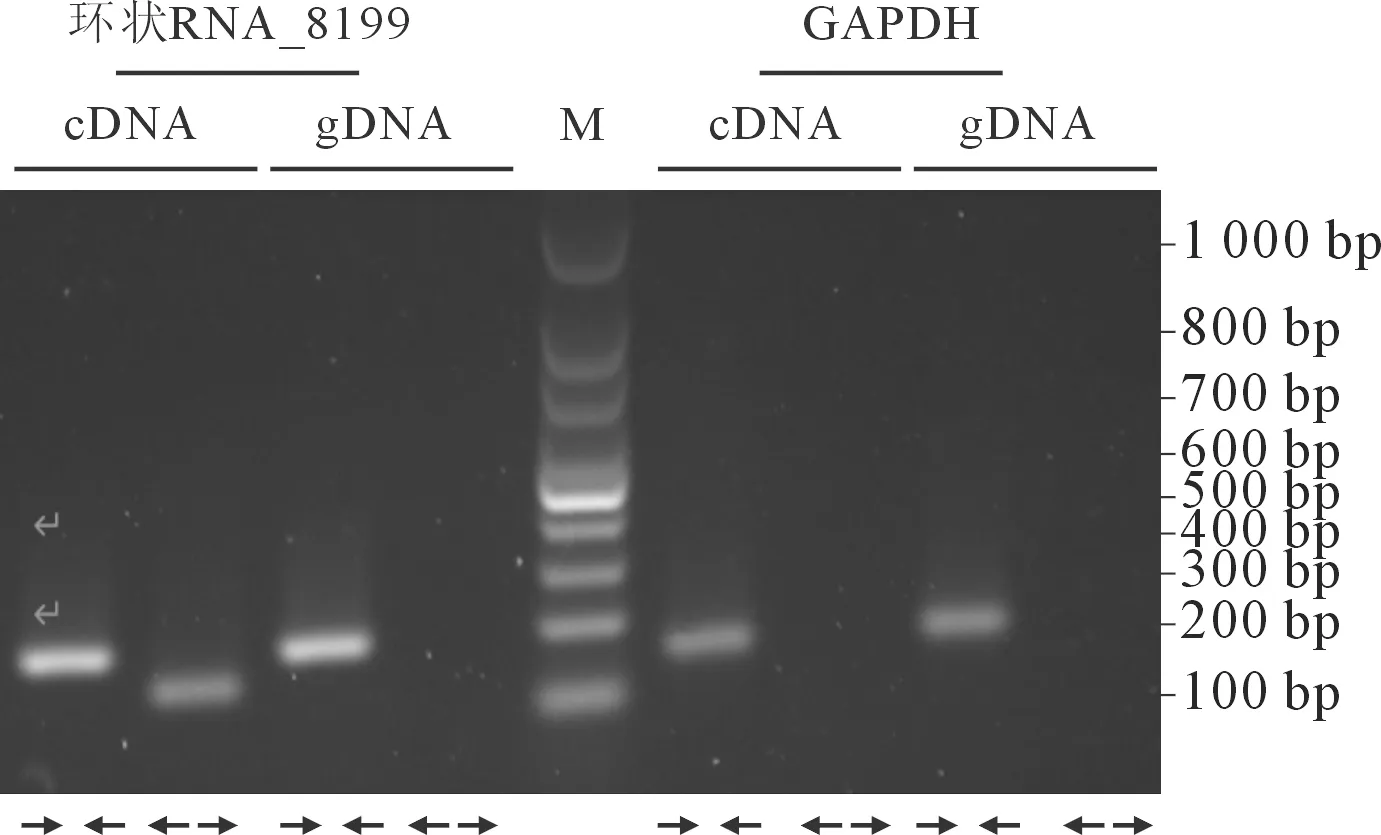
M:Marker;内向箭头指聚合引物,外向箭头指发散引物
2.2环状RNA_8199环化剪接点序列的Sanger测序Sanger测序结果证实了环状RNA_8199的环化剪接点序列,见图2。
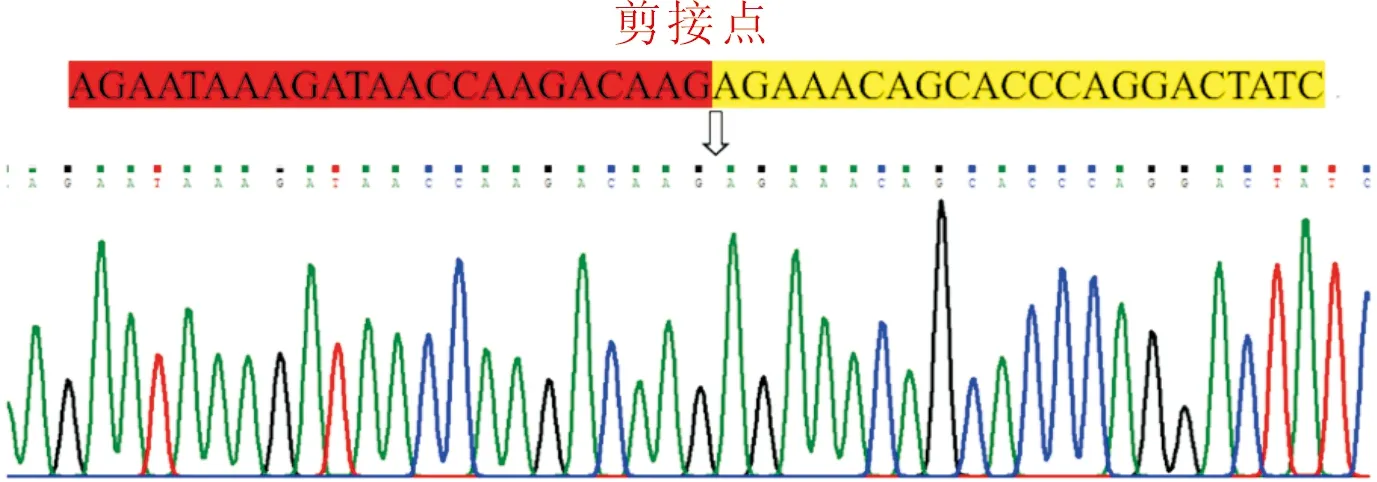
图2 环状RNA_8199环化剪接点序列的Sanger测序结果
2.3对照组与RNaseR处理组环状RNA_8199、ATXN10mRNA相对表达量的比较结果见表1。RNase R处理后环状RNA_8199对应的线性转录物ATXN10 mRNA表达水平下降,环状RNA_8199的环状转录物的表达水平无改变。

表1 两组环状RNA_8199、ATXN10 mRNA相对表达量的比较(n=3)
2.4KYSE520和KYSE270细胞中环状RNA_8199的亚定位环状RNA_8199主要定位于细胞浆中,见图3。核浆分离实验显示,KYSE520和KYSE270细胞中环状RNA_8199在细胞浆水平高于细胞核水平,见表2。

图3 细胞免疫荧光法检测KYSE520和KYSE270细胞中环状RNA_8199亚定位结果(×200)

表2 KYSE520和KYSE270细胞浆和细胞核中环状RNA_8199表达水平的比较(n=3)
2.5上调环状RNA_8199表达对ESCC细胞增殖、克隆形成、迁移和侵袭能力的影响结果见表3、4。与环状RNA_8199-NC组相比,环状RNA_8199-OE组ESCC细胞OD值、克隆形成数、迁移细胞数和侵袭细胞数均下降。

表3 两组KYSE30、KYSE70细胞OD值比较(n=3)
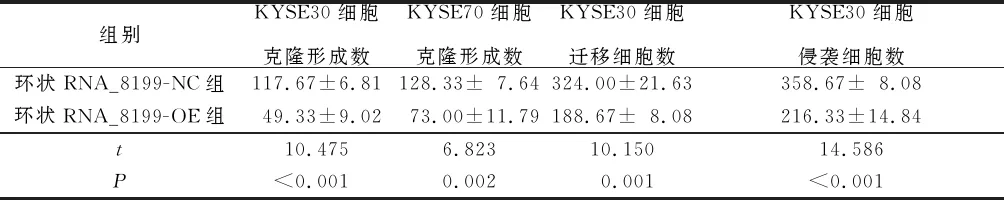
表4 两组ESCC细胞克隆形成数、迁移细胞数与侵袭细胞数比较(n=3)
3 讨论
食管癌是世界范围内发病率较高的消化道恶性肿瘤之一[1],据统计2017年全球新增食管癌病例约为47万[2]。由于食管癌起病隐匿且侵袭性强,多数患者就诊时已是晚期,5 a生存率不足20%[7]。因此,我们迫切需要进一步研究ESCC发生发展的分子机制,探寻有效的生物标志物及治疗靶标。
环状RNA是一类表达稳定且进化保守的非编码RNA,自身或其调控通路的紊乱可导致多种疾病的发生。大多数环状RNA存在于细胞质中,通过与细胞质中的miRNA和蛋白相互作用共同发挥调控功能[8]。证据表明环状RNA在多种肿瘤中表达异常。如环状RNA_FGFR1在非小细胞肺癌组织中表达上调,通过海绵吸附作用与miR-381-3p共同导致非小细胞肺癌进展和免疫逃避的发生[9]。环状RNA_LONP2在结肠癌组织中表达上调,且可通过调节miR-17的成熟来增强结肠癌细胞的侵袭和转移能力[10]。环状RNA_MBOAT2在前列腺癌组织和细胞系中表达上调,过表达环状RNA_MBOAT2可以促进前列腺癌细胞的增殖、迁移和侵袭能力[11]。
文献[12-14]证实环状RNA可以调控ESCC的进展并影响其预后,具有成为ESCC预测因子和治疗靶点的潜力。环状RNA_0004771在ESCC患者血浆和组织中表达上调,并通过调控miR-339-5p/CDC25A促进ESCC进展[12]。环状RNA_LARP4在ESCC细胞系中表达下调,过表达环状RNA_LARP4可以抑制ESCC细胞增殖和迁移并促进凋亡[13]。环状RNA_0012563在ESCC中表达显著上调,敲低环状RNA_0012563可以抑制XRCC1介导的EMT通路,从而抑制ESCC细胞的迁移和侵袭能力[14]。
本研究首先采用RT-PCR法检测了KYSE520细胞中环状RNA_8199的表达情况,并进一步采用Sanger测序法鉴定了其环化剪接位点。环状RNA的闭合成环结构使其与线性RNA相比,表达水平更加稳定[15]。通过RNase R实验发现,RNase R处理后环状RNA_8199的表达水平与对照组相比无明显改变,而ATXN10 mRNA的表达水平与对照组相比明显下降,证明了环状RNA_8199相比于线性转录本更能抵抗RNase R消化作用。细胞免疫荧光和核浆分离实验证明了环状RNA_8199主要存在于细胞浆中。另外,本研究还探索了环状RNA_8199对ESCC细胞生物学行为的影响。我们构建了高表达环状RNA_8199质粒载体并转染ESCC细胞,通过CCK-8实验、平板克隆形成实验及Transwell 实验发现,上调ESCC细胞中环状RNA_8199表达后,细胞的增殖活性明显降低,细胞克隆形成数目明显减少,侵袭与迁移能力明显受到抑制。这表明环状RNA_8199参与并影响了ESCC的发生发展,因此,有望成为ESCC基因治疗的新靶点。
综上所述,本研究发现环状RNA_8199与ESCC的发生发展有关,提示环状RNA_8199可能是食管癌诊疗的有效靶点之一。然而我们的研究仍有一定的局限性,如环状RNA_8199抑制ESCC细胞的增殖、迁移和侵袭能力的具体作用机制尚不清楚,因此,还需进一步探索环状RNA_8199发挥各种生物学功能的具体机制。
