根际Ca2+对番茄灰霉病抗性的影响
2021-06-07孙佳星彭雅慧黄文婷李琳琳
孙佳星 ,娄 琦,彭雅慧,玉 蓝,黄文婷,李琳琳
(1.大连民族大学环境与资源学院,辽宁大连116600;2.吉林市园艺特产技术中心,吉林吉林132000)
灰霉病是我国设施番茄生产中的重要病害,主要由灰葡萄孢(Botrytis cinerea)侵染所引起,可危害番茄叶、茎、果实等部位,传播性强,严重影响番茄的产量和品质[1]。实际生产中多采用化学药剂预防和控制病害,并发挥了重要的作用,但近年来由于化学农药造成的环境污染和人们对食品安全的担忧日益突出。通过生物诱导物质激活植物自身免疫系统是一种更为主动、安全、经济、广谱、持久、有效的抗性反应方式,其研究受到人们的广泛关注,具有重要的理论研究意义和实际应用价值[2]。
水杨酸(SA)是植物中普遍存在的小分子酚类物质,是重要的植物激素和抗病信号分子,SA 的积累标志着植物免疫系统的激活,它还可以迅速的传递到植物其他部位产生系统获得抗性(SAR)[3-4]。SA依赖型的抗性反应对病原物普遍有效(包括真菌、细菌和病毒),拟南芥通过抗氧化酶基因OXR2 激活植物体内SA 的积累,提高对丁香假单胞菌的抗性[4]。又如SA提高PR1的表达提高早熟禾对褐斑病的抗性[5]。
钙是植物生长发育过程中一种重要的营养元素,在植物体内发挥重要作用。有研究表明钙可激发植物对病原菌的抗性,包括产生先天性免疫反应、过敏性反应和病原物相关分子模式触发免疫[6]。施用钾和钙可显著降低甜罗勒的百霉病[7];2%~3%的CaCl2对生姜青枯病具有很好的抑制效果[8];叶片外施钙可通过调控ROS响应大豆核菌侵染[9];小麦细胞内Ca2+水平的波动可引起CDPK的表达提高对白粉病的抗性[10];土壤施钙可以有效提高番茄叶片钙含量和PAL、PPO 活性,提高其对枯萎病的抗性[11],这说明Ca2+在防治植物病害方面的积极作用,并有可能通过ROS、提高防御酶活性、改变细胞代谢途径及钙相关基因表达来调控植物抗病。
前人分别在钙和SA 诱导的生物胁迫中展开了大量研究,但目前关于钙对SA 调控设施番茄的抗病性研究为数不多。本试验以L402 番茄为试材,以前期试验筛选确定的补钙浓度为基础,研究根际Ca2+对番茄幼苗SA含量、灰霉病抗性、防御酶活性和基因表达水平的影响。为进一步研究钙对SA 诱导抗病的作用机制和生产上开发新的生物抗病试剂奠定理论基础。
1 材料与方法
1.1 材料
供试番茄(Lycopersicon esculenturnMill)品种为L402,属于灰霉病敏感型。供试灰霉菌(Botrytis cinerea)由辽宁省农业科学院蔬菜花卉研究所惠赠,病菌培养基为PDA。
1.2 方法
试验于2018年4月20日进行,番茄种子经55℃温水处理10 min后,于30℃水温浸种4h,然后置光照培养箱中28℃催芽,选择出芽一致的种子,进行32孔穴盘普通基质育苗。番茄幼苗长到4叶1心时洗根移植到温度处理室中的1/2 Hoagland营养液中适应7d。温度处理室由自动控温系统G IC-Ⅲ型温室环境智能化控制器(沈阳农业大学工厂化农业中心研制)按白天25℃、夜间15℃调控温度;采用自然光照;控制器控制排风扇实时调节湿度,相对湿度为60%~70%。其他进行常规管理。
番茄幼苗适应7d 后(番茄幼苗长至 5 叶1 心)进行Ca2+处理:T0 处理(对照,Ca2+浓度3mmol·L-1)、T1 处理(Ca2+浓度为8mmol·L-1)、T2 处理(Ca2+浓度为0mmol·L-1)。正常Hoagland 营养液的标准Ca2+浓度为 3mmol·L-1,8mmol·L-1Ca2+浓度是在标准Hoagland营养液基础上使用CaCl2调节营养液中Ca2+浓度,0mmol·L-1Ca2+浓度是在标准Hoagland 营养液[12]基础上使用KNO3代替Ca(NO3)2剔除Ca2+并补充营养液中N 的浓度。营养液使用HCl和NaOH调节营养液中pH值达5.8~6.3,平均3d测定1次营养液的离子浓度和pH值。
Ca2+处理3d 后接种灰霉菌。灰霉菌采用孢子悬液接种法,镜检调节孢子悬液浓度为4×106个孢子·mL-1悬液均匀喷施植株叶片背面,直到滴水为止。接种前保湿24h,接种后48h 内保持湿度达100%并进行遮阴,温度设置为25℃/15℃。于接种6,12,24,48,72,96h 取样进行后续指标测定。接种5d 后调查发病情况并计算病情指数。每个处理10株,3次重复。
1.2.1 发病情况调查和病情指数的计算 灰霉病发病程度分级标准为:0级,无病斑;1级,病斑面积占叶面积5%以下;3级,病斑面积占叶面积5%~15%;5级,病斑面积占叶面积15%~25%;7级,病斑面积占叶面积25%~50%;9级,病斑面积占叶面积50%以上。采用分级计数法计算病情指数。

1.2.2 游离态SA含量、超氧阴离子产生速率和过氧化氢含量的测定 SA的提取和测定参照YALPANI等[13]方法略有改进。游离态SA含量用高效液相色谱(HPLC)测定。超氧阴离子产生速率过氧化氢(H2O2)含量的测定参照PATTERSON等[14]的方法略有改进。
1.2.3 钙含量的测定 称取烘干样品使用马弗炉进行灰化,使用原子吸收分光光度计测定钙含量[15]。
1.2.4 苯丙氨酸解氨酶(PAL)、β-1,3-葡聚糖酶、几丁质酶活性测定 使用pH值8.8的0.1mol·L-1硼酸-硼砂缓冲液研磨番茄叶片,离心后上清液为酶粗提液,以37 ℃保温前后每小时酶促反应产物反式肉桂酸生成量来表示PAL酶活。β-1,3-葡聚糖酶、几丁质酶酶活性根据BOLLER等[16]的方法略有改进,以每秒分解胶状几丁质产生1×10-9mol N-乙酰葡萄糖胺量为一个酶活力单位;β-1,3-葡聚糖酶活性测定利用DNS试剂测定生成还原糖的量来表示。蛋白质含量测定采用BRADFORD[17]的方法,用考马斯亮蓝G-250法测定蛋白含量,以牛血清蛋白为标准蛋白。
1.2.5 RNA提取和RT-PCR基因表达分析 根据NCBI发表的番茄PR1、CDPK、CaM、CBL和Actin基因片段的序列,使用primer Primer 5.0软件进行特异引物设计,使用TianGen RNA提取试剂盒提取的RNA,作为模板使用Takara PrimeScript Reverse Transcriptase 合成cDNA第一链(表1)。根据KIM等[18]的方法采用实时荧光定量(qRT-PCR)进行表达量分析。

表1 实时定量PCR引物Table 1 Primers of quantitative real time PCR
1.3 数据分析方法
试验所得数据采用Excel 2016 软件进行整理和作图,不同处理间差异的显著性采用SPSS 19.0 软件进行Duncan’n多重比较分析(α=0.05)。
2 结果与分析
2.1 根际Ca2+对番茄幼苗抗病性的影响
由图1 可知,本试验3 个根际Ca2+浓度处理条件下接种灰霉菌,其中,8mmol·L-1Ca2+处理的病情指数为36.05,3mmol·L-1和0mmol·L-1Ca2+处理的病情指数分别为42.50 和73.24。Ca2+浓度越高病情指数越低,抗病效果越好,且不同Ca2+处理间的抗病性差异达到极显著水平。
2.2 根际Ca2+对番茄幼苗体内游离态SA含量的影响
由图 2 可知,与对照相比,在 8mmol·L-1Ca2+处理条件下,游离态SA 含量在接种6h 增加到157.54 ng·g-1FW,并一直(6~96h)保持相对较高的水平;其含量在 24~96h 分别高于对照 2.0~2.5 倍。0mmol·L-1和3mmol·L-1处理的游离 SA 含量低于 8mmol·L-1Ca2+处理,且0mmol·L-1Ca2+处理游离SA含量低于对照。
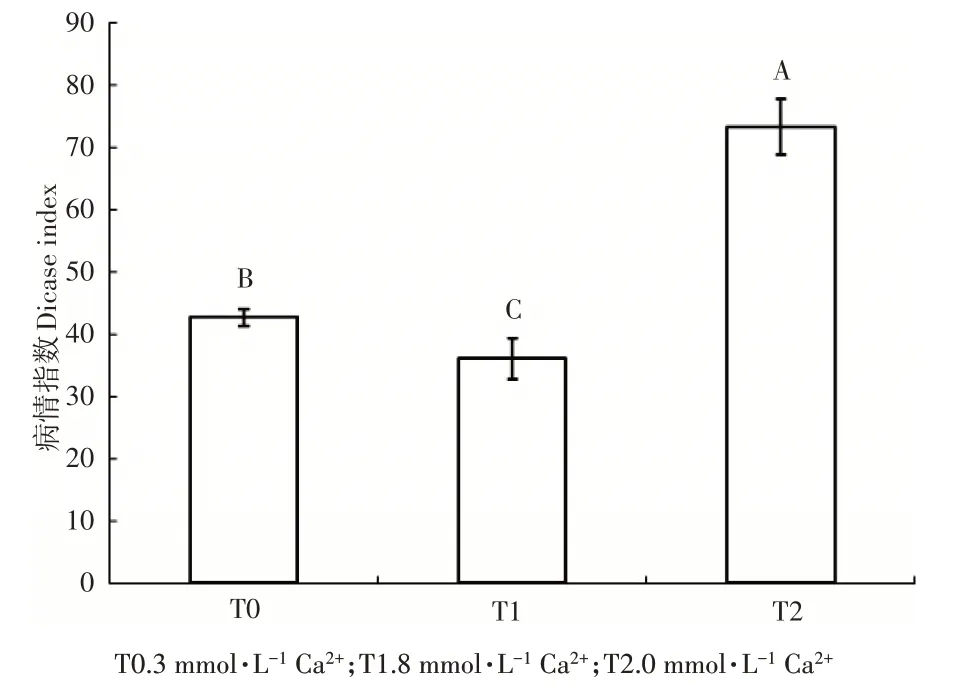
图1 不同根际Ca2+浓度处理番茄幼苗接种灰霉菌的病情指数Figure 1 The disease index of different rhizosphere Ca2+con‐centration treated tomato seedlings after Botrytis cinerea infec‐tion
2.3 根际Ca2+处理对接种灰霉菌后番茄幼苗和H2O2含量的影响

H2O2含量在8mmol·L-1Ca2+处理的番茄叶片接种灰霉菌 0~24h 剧烈的升高,明显高于 3mmol·L-1和 0mmol·L-1Ca2+处 理 ,其 高 峰 出 现 在 24h,分 别 是 3mmol·L-1和0mmol·L-1Ca2+处理的1.75和2.94倍;24~96 h剧烈的降低,在48h降低到3mmol·L-1的83%,0 mmol·L-1Ca2+处理的1.40倍。对照的H2O2含量在接种期间始终高于0mmol·L-1Ca2+处理。
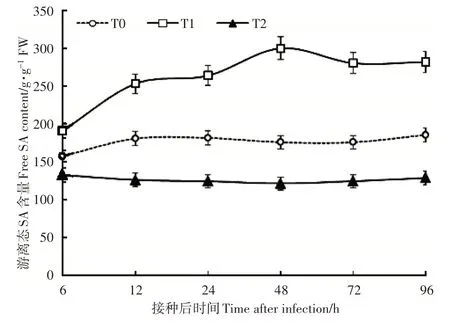
图2 根际Ca2+处理接种灰霉菌对番茄幼苗叶片游离态SA含量的影响Figure 2 The effect of rhizosphere Ca2+ treatments on the free SA content in tomato seedling leaves inoculated with Botrytis cinerea
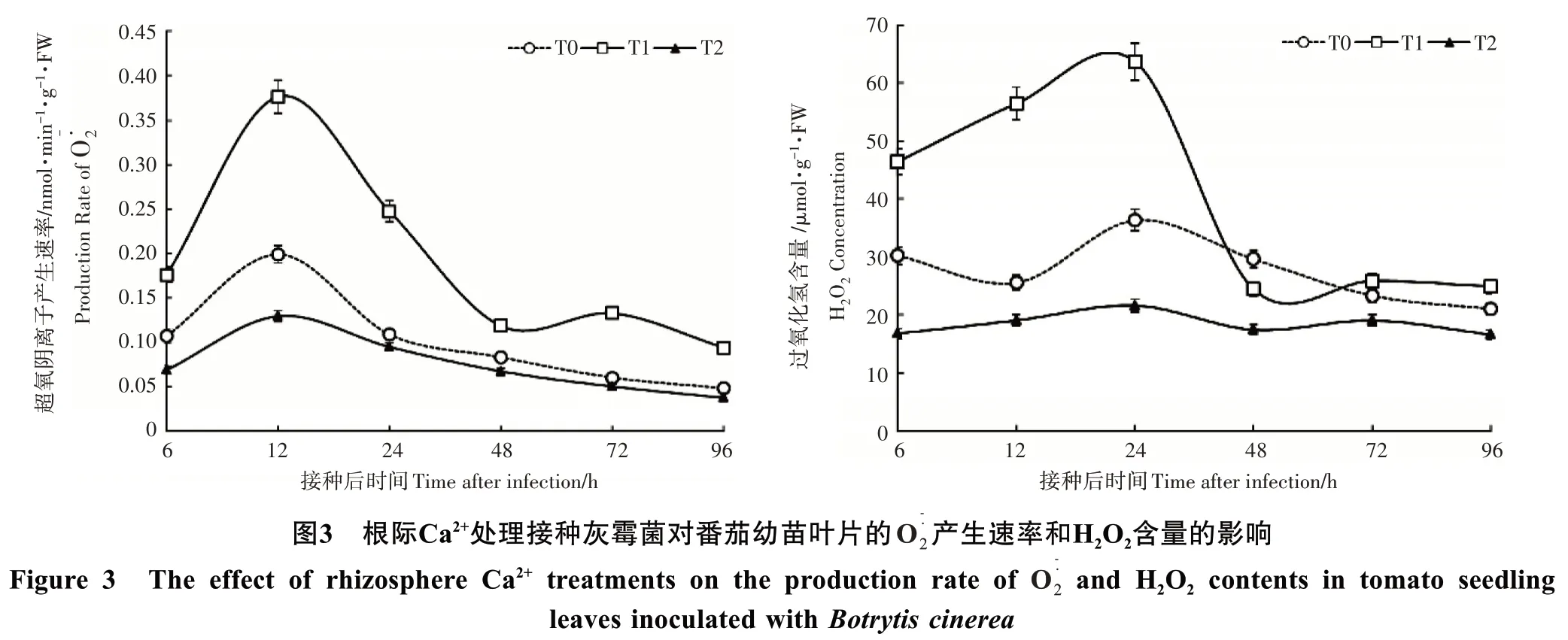
2.4 根际Ca2+处理对接种灰霉菌后番茄幼苗钙含量和防御酶活性的影响
由表2可知,在8mmol·L-1Ca2+处理条件下番茄体内钙含量显著高于3mmol·L-1和0mmol·L-1Ca2+处理,分别是二者的1.24 倍和1.86 倍。所有处理叶片PAL 活性均随时间延长而升高,但升高趋势不同。处理6 h 时,0 mmol·L-1Ca2+处理的番茄叶片PAL 活性与对照相比上升37.73%,到12~96 h,0mmol·L-1Ca2+处理植株PAL 活性始终低于对照;在8mmol·L-1Ca2+处理中,PAL 活性始终高于对照,并显著高于0mmol·L-1Ca2+处理,且在处理24h活性最高,分别是3mmol·L-1和0 mmol·L-1Ca2+处理的2.63倍和3.82倍。
所有处理几丁质酶和β-1,3-葡聚糖酶活性均是迅速升高而后缓慢下降的过程。对照的几丁质酶活性高峰出现在处理后48h,8 mmol·L-1Ca2+处理酶活高峰出现在处理后24h,0mmol·L-1Ca2+处理酶活高峰出现在处理后72h,分别为1.66U·mg-1protein、1.90U·mg-1protein 和1.23U·mg-1protein;8mmol·L-1Ca2+处理酶活较对照和0mmol·L-1Ca2+处理分别提高了14.45%和54.47%。在整个处理期间几丁质酶活性8mmol·L-1Ca2+处理高于对照,对照显著高于0 mmol·L-1Ca2+处理。β-1,3-葡聚糖酶活性在12~96h 期间3 个处理间差异显著,在处理6~24h 酶活均迅速上升,24~48h 达到酶活高峰,48~96 h 酶活保持相对稳定略有下降。8mmol·L-1Ca2+处理的β-1,3-葡聚糖酶活性在处理后24h到达高峰,为117.73U·mg-1protein,显著高于3mmol·L-1和0mmol·L-1Ca2+处理,分别是 3mmol·L-1和 0mmol·L-1Ca2+处理的 1.24 倍和 1.40 倍。0mmol·L-1Ca2+处理的 β-1,3-葡聚糖酶活性高峰在24h出现,为84.07U·mg-1protein,对照的酶活高峰出现在48h,为103.44U·mg-1protein。
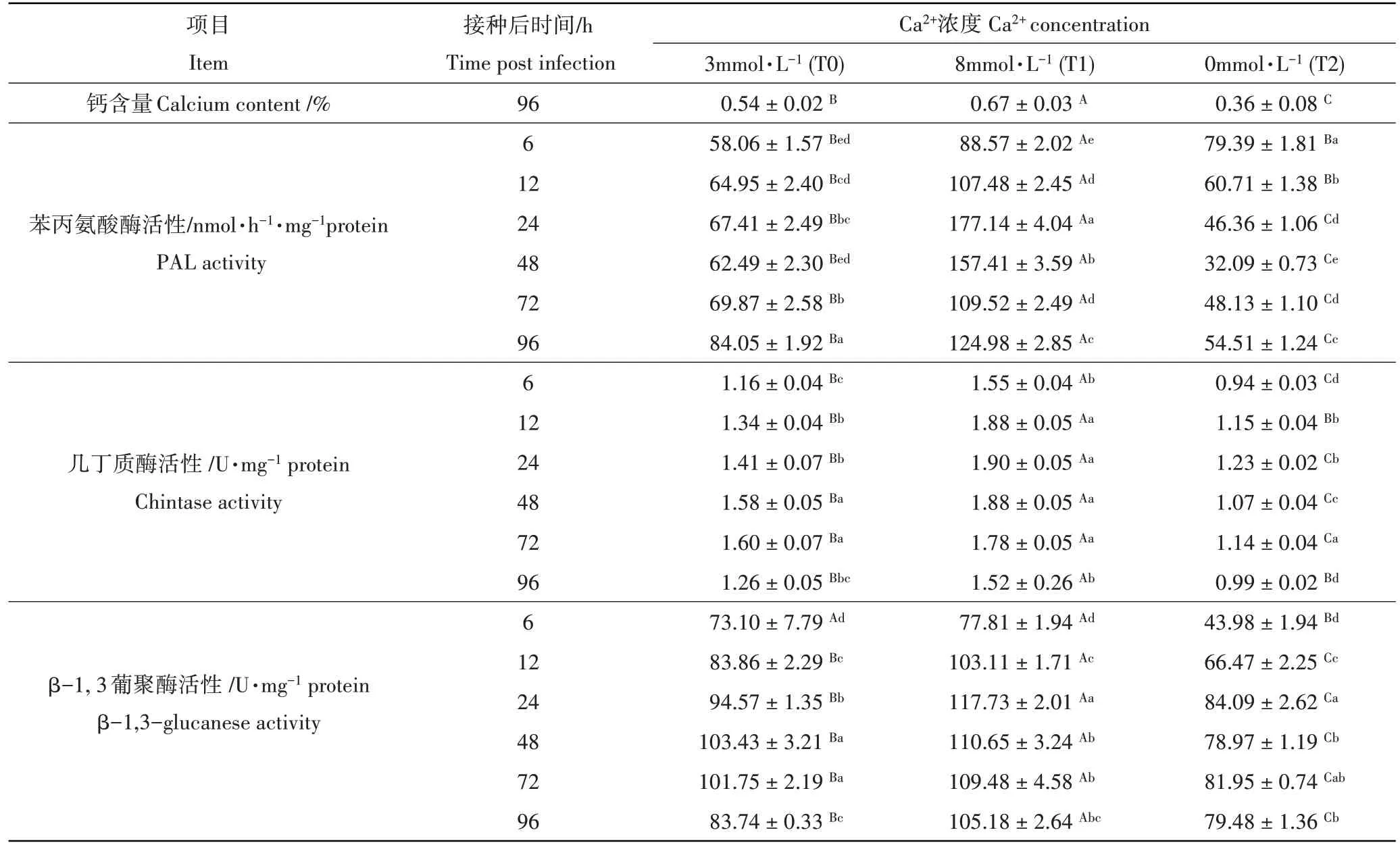
表2 不同根际Ca2+处理接种灰霉菌对番茄叶片钙含量和防御酶活性的影响Table 2 The effect of rhizosphere Ca2+ treatments on calcium content, defense enzyme activities in tomato seedling leaves inoculated with Botrytis cinerea
2.5 根际Ca2+对番茄幼苗接种灰霉菌后钙结合蛋白基因和病程相关蛋白1基因表达的影响
由图4可知,钙结合蛋白基因CDPK、CaM、CBL的表达模式均是先升高后缓慢降低的趋势,其中CDPK的表达高峰出现在接种后 12h,8mmol·L-1Ca2+处理的表达量是 3mmol·L-1和0mmol·L-1Ca2+处理的 2.44 倍和 4.45 倍;与对照和0mmol·L-1Ca2+处理相比,8mmol·L-1Ca2+处理的CDPK 表达水平在接种24~96 h均保持相对较高水平。CaM的表达量在 3 个处理中均升高,在 8mmol·L-1Ca2+处理下高峰出现在 24 h,分别为 3mmol·L-1和 0mmol·L-1Ca2+处理的2.41倍、1.17倍;0mmol·L-1Ca2+处理下6~48hCaM的表达量均高于对照。CBL基因在8mmol·L-1Ca2+处理条件下接种灰霉菌后迅速升高并一直保持较高表达水平,3mmol·L-1和0mmol·L-1Ca2+处理条件下则是在6~24h升高,48h迅速下降后基本保持表达量稳定。Ca2+浓度越高PR1基因表达量越高,在接种灰霉菌后24 h表达量最高为26.01,分别为3mmol·L-1和0mmol·L-1Ca2+处理的1.60倍和3.17倍。整体看接种灰霉菌0~96 h过程中PR1的表达量为:8mmol·L-1处理 > 3mmol·L-1处理> 0mmol·L-1处理。
3 讨论与结论
3.1 Ca2+对番茄灰霉病抗性和SA含量的影响
Ca2+和SA 在防治植物病害方面有积极的作用。ARFAOUI 等[9]对大豆外施钙可显著抑制核菌的侵染;不同Ca2+处理可显著降低生姜的青枯病的发病率[8],CLARK 等[19]则认为真菌的侵染可能是植物缺Ca2+的间接结果。植物体内SA 含量的提高可被视为植物提高抗病性的一种标志。DU 等[20]研究发现Ca2+可以调控拟南芥水杨酸的积累和对病原物的抗性;拟南芥中CBP60(一种钙调素结合蛋白)与Ca2+联合起来促进SA 的积累提高病原抗性[21]。本试验中根际8mmol·L-1Ca2+处理中,番茄叶片中游离态SA含量明显升高、病情指数均显著低于3mmol·L-1Ca2+处理;而 3mmol·L-1Ca2+处理番茄幼苗 SA 含量高于 0mmol·L-1Ca2+处理;病情指数又低于 0mmol·L-1Ca2+处理。随着根际Ca2+处理浓度升高,植物体内钙含量也随之升高。证明根际补充Ca2+具有显著提高番茄抗灰霉病的能力。笔者认为一方面因为补充的Ca2+被植物吸收,增强细胞壁的机械强度,提高植物细胞对病原菌侵染的抵御能力。另一更重要方面是Ca2+促进SA合成提高番茄对灰霉病的抗性。
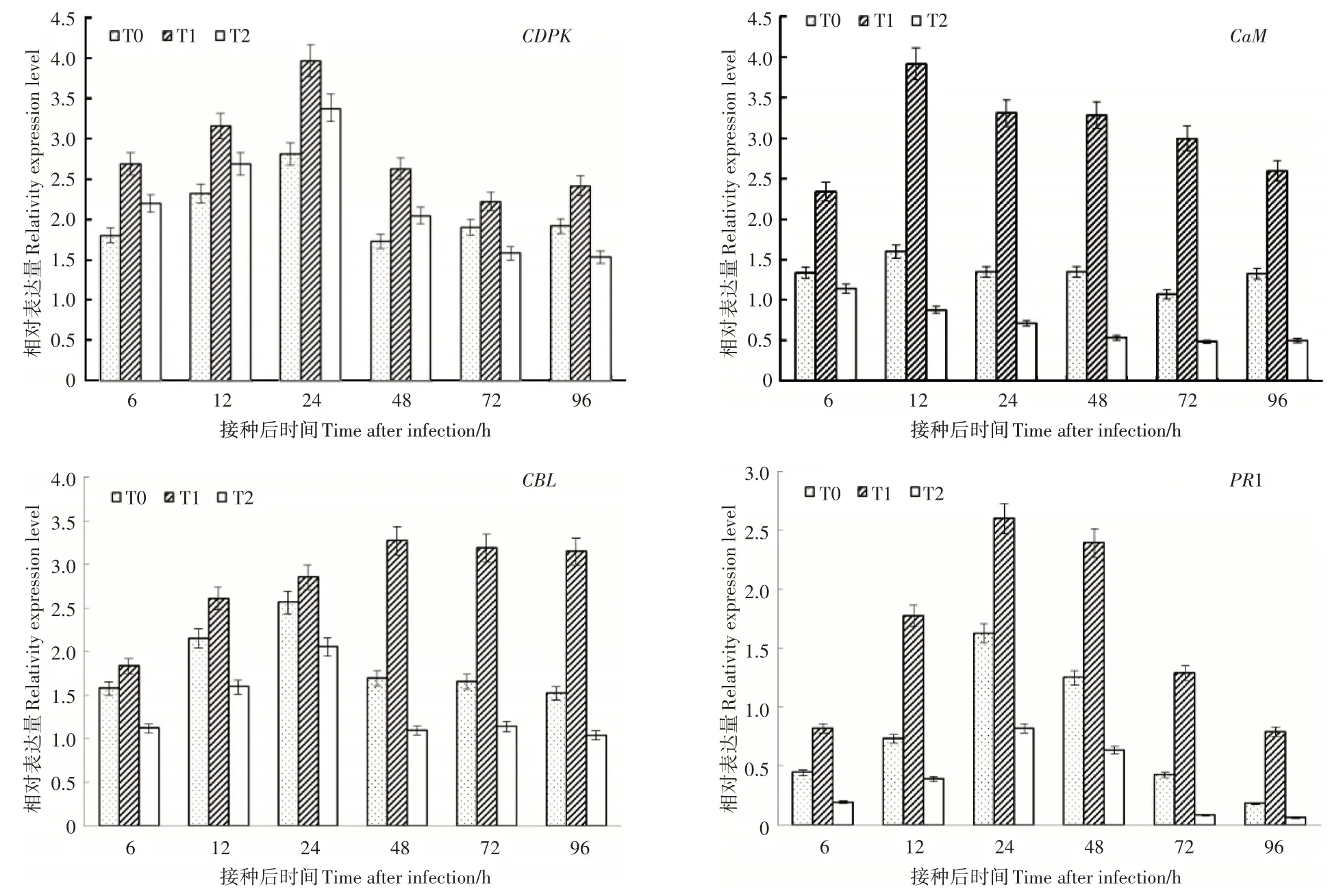
图4 根际Ca2+对番茄幼苗接种灰霉菌后钙相关基因和病程相关蛋白基因1表达的影响Figure 4 The effect of rhizosphere Ca2+ treatments on calcium related genes and PR1 expression level in tomato seedling leaves inoculated with Botrytis cinerea
3.2 Ca2+对ROS和防御酶活性及相关基因表达的影响

ROS 的爆发继而引起防御酶(PAL、几丁质和β-1,3-葡聚糖)活性升高。PAL 是产生抗病物质丙烷类代谢途径的关键酶[24-25]。本试验中不同根际钙处理PAL 活性均随时间延长而升高,8mmol·L-1Ca2+处理PAL 活性始终高于对照。冯军等[24]研究发现SA 可有效诱导草莓PAL 的积累,进而增强草莓抵御白粉菌侵染的能力,与本研究结果一致。β-1, 3-葡聚糖酶和几丁质酶可水解真菌细胞壁是植物抗病重要指标。SCHNEIDERMÜLLER 等[26]发现,用壳聚糖处理胡萝卜悬浮细胞可诱导产生几丁质酶,除去胞外Ca2+明显降低诱导物对几丁质酶的诱导作用;SA 处理番茄幼苗后几丁质酶,β-1,3-葡聚糖酶活性明显提高[27],本试验中β-1,3-葡聚糖酶和几丁质酶活性在根际Ca2+处理接种灰霉菌后均显著升高,8mmol·L-1Ca2+处理几丁质酶活性和β-1,3-葡聚糖酶活性显著高于3mmol·L-1和0mmol·L-1Ca2+处理。在0mmol·L-1Ca2+处理中,钙含量、几丁质酶和β-1,3-葡聚糖酶活性降到最低水平,且与Ca2+浓度和游离态SA 含量呈正相关关系。笔者认为Ca2+促进SA 积累,Ca2+和SA共同激发ROS导致PAL、β-1,3-葡聚糖酶和几丁质酶活性的提高。
植物细胞中有Ca2+/CDPK、Ca2+/CaM 和Ca2+/CBL 3种主要的钙信号转导途径,它们均可以与Ca2+结合与植物抗逆反应密切相关[28]。如在柑橘溃疡病抗性的SNP 筛选中发现与抗病相关的CDPK基因上调表达[28];在PEG 6000 渗透胁迫下,Ca2+/CaM 调控SA 诱导的小桐子幼苗甜菜碱积累[29];TaCIPK31 在小麦抵抗叶锈菌侵染过程中起负调控作用[30]。本试验分析了钙结合蛋白基因CDPK、CaM、CBL的表达情况,其中CDPK和CaM的表达水平高于CBL,且CDPK和CaM的表达模式与防御酶活性和PR1的表达模式一致,说明CDPK和CaM与番茄对灰霉菌抗性密切相关,与张娜等的研究结果相似[30]。PR1基因是SA 抗病信号途径的标志性基因[7],PR1基因的表达受SA、JA、病原菌、矿质元素等多种物质诱导[7],本试验也与前人研究结果一致,但8mmol·L-1Ca2+处理的PR1基因的表达水平高于3mmol·L-1和0mmol·L-1Ca2+处理,说明Ca2+促进SA的积累,并与SA一同进一步提高了8mmol·L-1Ca2+条件下PR1的表达水平。
综上所述,根际8mmol·L-1Ca2+处理后接种灰霉菌降低番茄的病情指数,提高抗病性,促进ROS 的爆发,提高番茄幼苗体内游离态SA含量,SA和ROS共同提高了PAL、几丁质酶、β-1,3-葡聚糖酶活性和PR1表达水平;Ca2+结合蛋白基因CDPK和CaM受不同根际钙处理影响且与抗病密切相关;根际Ca2+提高番茄抗灰霉病效果显著。
