新疆栽培荒漠肉苁蓉醇提物的免疫调节作用研究
2021-06-07杨秀梅杨雨王丹阳张爱莲
杨秀梅 杨雨 王丹阳 张爱莲
新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室,乌鲁木齐 830046
0 引言
当前,各种传染病如新型冠状病毒肺炎、流感、艾滋病、乙型肝炎等仍严重危害着人类健康。在这些疾病的预防和治疗中,中药发挥着重要作用。已知具有免疫调节作用的中药达200多种,其中补益类中药如人参、肉苁蓉、枸杞、黄芪、何首乌、五味子、肉桂等可综合性提高机体免疫力,与其他中药相比,补益类中药的有效成分具有高活性的免疫调节作用[1-3]。近年来,随着传染病、癌症、代谢性疾病等不断增加,对疾病的治疗不仅仅是减轻临床症状,更多的是关注安全有效的治疗策略。因此,从补益类中药中筛选安全、有效的免疫调节活性成分用于疾病防治具有积极意义。
新疆荒漠肉苁蓉(Cistanche deserticola.Y.C.Ma)为列当科肉苁蓉属植物,药理研究结果表明,苯乙醇苷类化合物和糖类是其主要活性成分,苯乙醇苷类化合物主要表现为抗氧化、神经保护和抗炎作用等,而多糖具有抗氧化、免疫调节和抗衰老活性[4-6]。鉴于肉苁蓉的滋补作用,作为食品来源的传统补益类中药消费量大。新疆是肉苁蓉的主产区,因过度采挖导致有限的野生肉苁蓉资源濒临枯竭,难以满足需求;通过多年的人工栽培技术研究,新疆成功种植了大面积的荒漠肉苁蓉,且主要成分与野生肉苁蓉一致[7-9]。研究者们对肉苁蓉的化学成分、药理作用、食品保健等诸多方面做了大量深入细致的研究,建立了苯乙醇苷和多糖等多种活性成分的定量分析和分离方法、指纹图谱及生药的质量标准,但对栽培肉苁蓉醇提物对特异性免疫反应的作用特点尚不清楚。
为此,基于肉苁蓉的药理活性,本研究选用新疆栽培荒漠肉苁蓉醇提物(ethanol extracts of cultivated Cistanche deserticola,EECCD)为研究材料,通过小鼠体内实验研究其量效关系以及对体液免疫反应、细胞免疫反应和细胞因子等的影响,观察EECCD对特异性免疫反应的免疫调节特点,为从EECCD中筛选免疫调节活性成分用于人类和动物疾病防治提供依据,也为更好地开发利用新疆栽培荒漠肉苁蓉提供参考。
1 材料与方法
1.1 主要材料与仪器
EECCD(其中苯乙醇苷类化合物的质量分数为17.12%,笔者所在实验室制备[10]),辣根过氧化物酶标记的山羊抗小鼠IgG、IgG1和IgG2a抗体(美国Southern Biotech公司),卵清蛋白(ovalbumin,OVA)、脂多糖(lipopolysaccharide,LPS)、刀豆蛋白A(concanavalin A,ConA)、噻唑蓝(美国Sigma公司),铝佐剂(A lum adjuvant,Al um)(美国Thermo公司),莫能霉素、Fc封闭抗体、别藻蓝蛋白(allophycocyanin,APC)标记的CD4抗体(APC-CD4)、藻红蛋白(phycocyanin,PE)标记的白细胞介素-4(interleukin-4,IL-4)抗体(PE-IL-4)、PE标记的γ-干扰素(interferonγ,IFN-γ)抗体(PE-IFN-γ)、PE标记的CD11c抗体(PECD11c)、异硫氰酸荧光素(flourescein isothiocyanate,FITC)标记的CD40抗体(FITC-CD40)、APC标记的CD80抗体(APC-CD80)、APC-CD86、FITC标记的主要组织相容性复合体Ⅱ类(major histocompatibility complex classⅡ,MHCⅡ)抗体(FITC-MHCⅡ)、Cytofix/Cytoperm缓冲液、Perm/Wash缓冲液(美国BD公司),CD4+CD25+Foxp3+调节性T细胞(regulatory T cell,Treg)检测试剂盒(美国eBioscience公司)。
健康清洁级6~8周龄ICR雌性小鼠42只,体质量范围18~22 g,来自新疆医科大学动物实验中心,许可证号SCXK(新)2003-0001。小鼠于实验室动物房饲养,适应后用于免疫实验。小鼠免疫实验获得了新疆生物资源基因工程重点实验室动物实验伦理委员会批准(批号BRGE-AE001)。
HFsafe-1200超净工作台、HF90二氧化碳培养箱(力康生物医疗科技控股有限公司),ELx808酶标仪(美国BioTek仪器有限公司),BD FACSCalibur流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 动物分组与免疫
采用9 g/L NaCl溶液溶解OVA,将Tween-20与9 g/L NaCl溶液按照体积比1∶9混合后用于溶解EECCD,过滤除菌后备用。抗体实验动物随机分为7组(每组6只):9 g/L NaCl组、EECCD组(1 200μg EECCD)、OVA组(10μg OVA)、低剂量EECCD/OVA组(400μg EECCD+10μg OVA)、中剂量EECCD/OVA组(800μg EECCD+10μg OVA)、高剂量EECCD/OVA组(1 200μg EECCD+10μg OVA)和Alum/OVA组(200μg Alum+10μg OVA)。于小鼠背部皮下三点注射,共免疫2次,间隔14 d,每次免疫前小鼠眼眶取血制备血清用于抗体检测。由抗体实验筛选出EECCD最佳剂量用于后续的脾淋巴细胞增殖、细胞因子、树突状细胞(dendritic cells,DCs)表面分子及Treg检测。
1.2.2 间接酶联免疫吸附测定法检测小鼠OVA特异性抗体滴度和抗体分型
采用间接酶联免疫吸附测定法检测初免后14、28、42、56 d小鼠血清的IgG抗体滴度以及加强免疫后7 d小鼠血清的IgG抗体分型水平,具体操作参见文献[11]。
1.2.3 噻唑蓝法检测小鼠脾细胞增殖
加强免疫后7 d,制备小鼠脾单细胞悬液,计数后调整细胞浓度,以适宜浓度接种于96孔细胞培养板中;分别加入适宜浓度的OVA、ConA和LPS与细胞共孵育48 h,以空白培养基组及未加刺激物的空细胞组作为对照,每组设3个复孔;加入噻唑蓝溶液培养4 h,离心后加入二甲基亚砜溶解沉淀,酶标仪测定吸光度(A570/630nm)值,并按下式计算刺激指数

式中:A刺激组、A空白培养基组和A未刺激组分别为刺激组、空白培养基组和未刺激组的吸光度(A570/630nm)值。
1.2.4 流式细胞术检测细胞因子
采用流式细胞术对CD4+T细胞分泌IL-4和IFN-γ的水平进行检测,步骤简述如下:加强免疫后7 d,制备小鼠脾单细胞悬液加入细胞培养板中,与OVA抗原共刺激4 h后加入莫能霉素继续培养过夜,同时设置佛波酯(phorbol 12-myristate 13-acetate,PMA)刺激细胞为阳性对照;收集细胞,加入Fc封闭抗体封闭30 min,Perm/Wash缓冲液洗涤细胞;加入APC-CD4抗体进行细胞表面分子染色20 min,Perm/Wash缓冲液洗涤细胞;加入Cytofix/Cytoperm缓冲液固定破膜,Perm/Wash缓冲液洗涤细胞;分别加入适量的PE-IL-4和PE-IFN-γ抗体进行胞内染色20 min,Perm/Wash缓冲液洗涤细胞后加入磷酸盐缓冲液,上流式细胞仪检测。
1.2.5 流式细胞术检测DCs表面分子和Treg细胞
加强免疫后7 d,制备小鼠脾单细胞悬液,使用PE-CD11c、FITC-CD40、APC-CD80、APC-CD86、FITCMHCⅡ抗体进行DCs表面分子染色15~20 min,洗涤细胞后加入磷酸盐缓冲液,上流式细胞仪检测。
加强免疫后7 d,制备小鼠脾单细胞悬液,采用CD4+CD25+Foxp3+Treg检测试剂盒进行检测,具体操作参见试剂盒说明书。
1.3 统计学方法
采用GraphPad Prism 5.0统计学软件处理数据,符合正态分布的计量数据以均值±标准差(Mean±SD)表示。组间差异性采用单因素方差分析后用Turkey’s post-test进行多重比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 EECCD对小鼠体液免疫反应的影响
采用间接酶联免疫吸附测定法检测初免后14、28、42和56 d小鼠的血清IgG抗体滴度。结果如图1所示,EECCD可提高小鼠血清IgG抗体滴度,表现为低、中、高剂量EECCD/OVA均提高了OVA特异性IgG抗体滴度,中剂量EECCD为最佳剂量;初免后不同时间点的抗体趋势基本相同;初免后14 d,IgG抗体滴度整体偏低;初免后28 d,IgG抗体滴度达最大值,并与初免后42、56 d的IgG抗体滴度相当;初免后28 d,与OVA组相比,中剂量EECCD/OVA能提高OVA特异性IgG抗体滴度2.5倍(抗体滴度达25万),且与Alum/OVA组相当,并持续至初免后56 d,抗体滴度无降低的趋势;EECCD单独免疫组的IgG抗体滴度与9 g/L NaCl组相当。

图1 间接酶联免疫吸附测定法检测初免后不同时间点小鼠OVA特异性抗体滴度
2.2 EECCD对小鼠血清IgG1和IgG2a水平的影响
加强免疫后7 d,采用间接酶联免疫吸附测定法检测小鼠OVA特异性IgG1和IgG2a水平。结果如图2所示,中剂量EECCD/OVA明显提高了OVA特异性IgG1(Th2型免疫应答)水平(P<0.01),且与Alum/OVA组相比差异无统计学意义(P>0.05);中剂量EECCD/OVA和高剂量EECCD/OVA均明显提高了OVA特异性IgG2a(Th1型免疫应答)水平(均P<0.01),且中剂量EECCD/OVA组高于Alum/OVA组(P<0.01);与OVA组相比,Alum/OVA只能提高OVA特异性IgG1水平(P<0.01),对IgG2a水平无明显影响(P>0.05);与OVA组相比,低剂量EECCD/OVA明显提高了IgG2a/IgG1比值(P<0.01)。由此筛选出中剂量EECCD/OVA组为最佳剂量组。
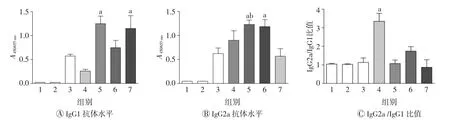
图2 间接酶联免疫吸附测定法检测加强免疫后7 d小鼠血清抗体亚型
2.3 EECCD对小鼠脾细胞增殖的影响
将中剂量EECCD与OVA共免疫后,制备小鼠脾单细胞悬液,分别用OVA、ConA和LPS体外刺激细胞,观察EECCD对脾细胞增殖的影响。结果显示,与OVA组相比,中剂量EECCD/OVA明显促进了OVA特异性的脾细胞增殖(P<0.05)(图3A);ConA和LPS体外刺激结果显示,中剂量EECCD/OVA明显促进了T/B细胞的增殖(均P<0.05)(图3B、3C)。

图3 噻唑蓝实验检测加强免疫后7 d小鼠脾淋巴细胞的增殖情况
2.4 EECCD对CD4+T细胞分泌IL-4和IFN-γ的影响
加强免疫后7 d,制备小鼠脾单细胞悬液,并以一定浓度的OVA抗原体外刺激脾单细胞悬液,同时以PMA刺激组为阳性对照,采用流式细胞术检测CD4+T细胞分泌IL-4和IFN-γ的水平。由图4可知,与OVA组相比,中剂量EECCD/OVA和PMA均能促进CD4+T细胞分泌IL-4(均P<0.01),且中剂量EECCD/OVA组与PMA组间差异无统计学意义(P>0.05),中剂量EECCD/OVA组明显高于Alum/OVA组(P<0.01);中剂量EECCD/OVA还能促进CD4+T细胞分泌IFN-γ(P<0.01),且明显高于Alum/OVA组(P<0.01);而OVA组与Alum/OVA组相比,CD4+T细胞分泌IL-4和IFN-γ的水平差异均无统计学意义(均P>0.05)。

图4 流式细胞术检测加强免疫后7 d小鼠CD4+T细胞分泌IL-4和IFN-γ的水平
2.5 EECCD对DCs成熟和Treg的影响
采用流式细胞术检测加强免疫后7 d小鼠脾细胞中DCs表面分子CD40、CD80、CD86和MHCⅡ的表达,以及CD4+CD25+Foxp3+Treg细胞的表达。结果如图5、6所示,与OVA组相比,中剂量EECCD/OVA能明显促进CD40、CD80、CD86和MHCⅡ的表达,降低CD4+CD25+Foxp3+Treg细胞的表达,差异均具有统计学意义(均P<0.05)。
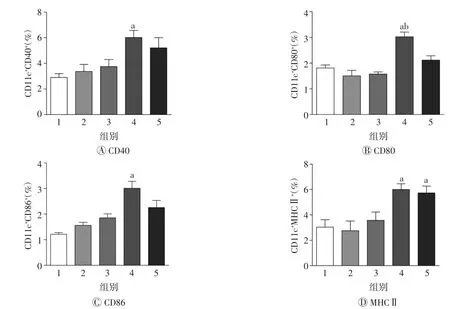
图5 流式细胞术检测加强免疫后7 d小鼠脾细胞中DCs表面分子CD40、CD80、CD86和MHCⅡ的表达
3 讨论与结论
中药的有效成分可通过刺激或抑制作用来调节免疫反应,从而帮助机体维持健康状态。中药用于人类和动物疾病的防治有着悠久的历史,寻找治疗各类疾病的中药有效成分一直是研究者们关注的重要课题。肉苁蓉作为传统补益类中药是治疗疾病的重要候选资源。文献报道,肉苁蓉醇提物中的主要活性成分为苯乙醇苷类化合物[12],其在肉苁蓉属、紫丁香属、毛冬青属、车前草属等植物中均有分布,具有抗氧化、抗炎和免疫调节作用[13-15],对机体的免疫功能具有增强或抑制作用[16-17],这说明不同中药的苯乙醇苷类化合物的免疫调节作用存在差异。为此,本研究通过小鼠体内实验对EECCD的免疫调节活性进行探索,结果发现EECCD可有效增强OVA特异性IgG、IgG1和IgG2a抗体的水平,激活OVA特异性的淋巴细胞增殖和T/B细胞的活化,促进CD4+T细胞分泌IL-4和IFN-γ,并可促进免疫后小鼠脾脏中DCs的成熟,抑制Treg的表达。上述结果提示EECCD对特异性免疫反应具有良好的免疫增强作用。
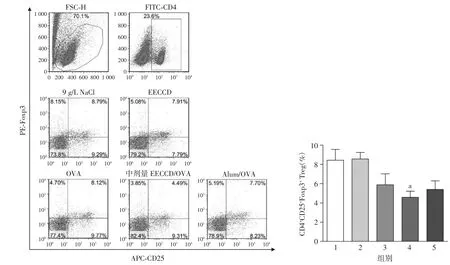
图6 流式细胞术检测加强免疫后7 d小鼠脾脏CD4+CD25+Foxp3+Treg的表达
中药有效成分的免疫调节作用呈现一定的量效关系。为了探究EECCD对体液免疫反应和细胞免疫反应的量效关系,本研究设置了低、中、高3个剂量的EECCD,分别与OVA共同皮下免疫小鼠。抗体滴度结果表明,3个剂量的EECCD均可提高OVA特异性IgG抗体滴度,其中中剂量为最佳剂量,抗体滴度可达25万,效果与Alum相当;中剂量EECCD/OVA能提高OVA特异性IgG1抗体水平,效果与Alum/OVA组相当;中、高剂量EECCD/OVA均能提高OVA特异性IgG2a抗体水平,效果优于Alum/OVA组,且EECCD无免疫原性。在抗体实验结果的基础上,脾细胞增殖实验选择了最佳剂量(中剂量)的EECCD检测其效应,结果显示中剂量EECCD/OVA可增强OVA特异性的脾细胞增殖,激活T/B细胞。上述实验结果表明,EECCD在适宜剂量下可有效促进体液免疫反应和细胞免疫反应。
Th1和Th2型免疫应答是宿主保护性免疫所必需的,而Th1介导的细胞免疫应答是宿主抵抗某些传染病的关键。中药中的有效成分不仅可激活B细胞,还可激活T细胞反应。在本研究中,选择了中剂量EECCD检测其对CD4+T细胞分泌IL-4和IFN-γ的影响。结果显示,中剂量EECCD/OVA可促进Th2型细胞因子IL-4的分泌,效果与Alum/OVA组相当;中剂量EECCD/OVA还可促进Th1型细胞因子IFN-γ的分泌,效果优于Alum/OVA组。该结果与IgG1(Th2型免疫应答)和IgG2a(Th1型免疫应答)的结果一致,表明EECCD可促进Th1和Th2型免疫应答,尤其可提高Th1型免疫应答,这对于某些疾病的治疗具有重要作用。
由于DCs在免疫调节中的重要作用,DCs常被作为中药有效成分的免疫调节靶点[18]。研究结果也表明,中药有效成分主要通过影响抗原递呈细胞的成熟状态及功能进而影响获得性免疫反应[19-20]。Treg的减少可增强体液和细胞免疫应答,并在保持免疫系统平衡中起到了重要的调节作用。为了进一步了解EECCD的免疫调节活性,本研究检测了中剂量EECCD/OVA免疫后小鼠脾细胞中DCs表面分子的表达和Treg水平。结果显示,中剂量EECCD/OVA上调了DCs表面分子CD40、CD80、CD86和MHCⅡ的表达,下调了小鼠脾脏中CD4+CD25+Foxp3+Treg的表达。该结果表明,EECCD可通过促进DCs成熟和抑制Treg细胞活化来提高OVA特异性的体液和细胞免疫应答。
总之,EECCD不仅可提高OVA特异性的体液和细胞免疫应答,促进IL-4和IFN-γ分泌,诱导DCs成熟,降低Treg表达,发挥良好的免疫增强作用,还可诱导Th1/Th2型免疫应答,尤其可诱导Th1型免疫应答,可作为一种有效的免疫调节成分候选资源用于疾病的防治。
利益冲突所有作者均声明不存在利益冲突
