新疆传统奶酪中产脂肪酶乳酸菌的优选及酶学特性研究
2021-06-07李晓楠李宇辉卢士玲王俊钢李宝坤刘世琳
李晓楠,李宇辉,卢士玲*,王俊钢,李宝坤,刘世琳
1(石河子大学 食品学院,新疆 石河子,832000)2(新疆农垦科学院农产品加工研究所,新疆 石河子,832000) 3(新疆农垦科学院农产品加工重点实验室,新疆 石河子,832000)
新疆传统奶酪也称奶疙瘩,是哈萨克族牧民为解决剩余鲜奶,将牛奶经自然发酵、排乳清制成的奶制品,它基本排除了牛奶中的水分,具有鲜奶10倍的蛋白质和脂质,有“乳品黄金”之称[1]。
有研究报道乳酸菌作为奶酪中的发酵剂已有3 600 年历史[2],目前市场中销售的奶酪在发酵时几乎都使用多种乳酸菌混合发酵,得到的产品不仅风味鲜美独特且质地细腻。产脂肪酶的乳酸菌可对鲜奶进行发酵,在奶酪的成熟及后熟过程中分解脂肪从而影响脂肪酸的变化[3]。短中链游离脂肪酸由于其较低的阈值对奶酪风味贡献很大,是多种挥发性化合物的前体物质,在奶酪成熟的各阶段产生不同的风味[4]。白雪等[5]研究发现奶贝和酸奶经微生物脂肪酶处理后,检测到氮氧化合物、硫化物、芳香成分和有机硫化物等含量均有增加,醛类、醇类、酸类、酮类化合物相对含量比未添加脂肪酶样品的相对含量高。何捷等[6]从新疆牧区酸马奶中筛选出1株产脂肪酶植物乳杆菌,其酶活力为8.54 U/mL。2019年景智波[7]从53株乳酸菌中筛选出1株高产脂肪酶的瑞士乳杆菌,最适反应温度为35 ℃,属于中度耐热温和型脂肪酶,将其应用于发酵羊肉香肠中,能够显著促进游离脂肪酸的释放,改变了香肠中脂肪酸组分并提升风味,同时产酸性能较好,能快速降低水分活度、pH,抑制杂菌生长。
本文利用三丁酸甘油酯平板透明圈法结合铜皂法测酶活力,从传统奶酪中筛选高产脂肪酶的乳酸菌,对其产酶特性及酶学性质进一步研究,为后续作为发酵剂在奶酪制品中的使用提供实验数据支撑,同时为新疆传统乳制品的现代化生产以及品质提升提供一定的理论基础。
1 材料与方法
1.1 材料、试剂、培养基
1.1.1 原料
奶酪样品来自伊犁地区、哈密地区、塔城地区。
1.1.2 试剂
聚乙烯醇(polyvinyl alcohol,PVA)-124、无水Na2CO3,西陇科学有限公司;橄榄油,嘉里粮油(天津)有限公司;无水乙醇,天津风船化学试剂科技有限公司;三丁酸甘油酯、TritionX-100,上海易恩化学技术有限公司;甲苯、冰乙酸,天津市鑫铂特化工有限公司;1 mol/L Tris-HCl缓冲液(pH 8.0),索莱宝(北京)科技有限公司;Tween 80、Tween 20,福晨(天津)化学试剂有限公司。以上试剂均为分析纯。
1.1.3 培养基及相关试剂的配制
富集培养基:蛋白胨10 g,牛肉浸粉10 g,酵母粉5 g,葡萄糖20 g,乙酸钠5 g,柠檬酸氢二胺2 g,吐温80 1 mL,磷酸氢二钾2 g,硫酸镁0.2 g,硫酸锰0.05 g,蒸馏水1 L,121 ℃灭菌20 min;种子培养基:蛋白胨5 g,氯化钠3 g,葡萄糖5 g,酵母粉5 g,磷酸氢二钾2 g,蒸馏水1 L,121 ℃灭菌20 min;分离培养基:种子培养基1 L、琼脂20 g;发酵产酶培养基:硫酸铵1 g、硫酸镁1 g、橄榄油乳化液12 mL、蛋白胨20 g、葡萄糖5 g、磷酸氢二钾1 g、蒸馏水1 L;初筛培养基:三丁酸甘油酯乳化液20 mL、pH 8.0 Tris-HCl缓冲液980 mL、琼脂20 g。
橄榄油乳化液的配制:准确称取PVA-124 3.0 g,加入150 mL蒸馏水,室温溶胀30 min后于95 ℃水浴溶解30 min至溶液透明后冷却至室温,加入橄榄油50 mL,用高速组织分散器处理20 min至混合液为乳白色的均匀乳化液,现配现用;三丁酸甘油酯乳化液的配制:用2%(质量分数)的PVA溶液配制2%(质量分数)的三丁酸甘油酯乳化液。
1.2 仪器与设备
22331 高速冷冻离心机,德国Eppendorf AG公司;核酸测定仪,美国赛默飞世尔科技有限公司;HP1020凝胶成像系统、T100 RCE仪,美国Bio-Rad公司;CX23LEDRFS1C生物显微镜,奥林巴斯(广州)工业有限公司;EONC酶标仪,美国伯腾仪器有限公司;UB-7 pH计,美国赛多利斯斯丹福公司。
1.3 实验方法
1.3.1 高产脂肪酶乳酸菌的分离筛选及鉴定
1.3.1.1 样品乳酸菌的分离
参照ZHENG等[8]的实验方法。将奶酪样品在无菌条件下用研钵研碎并充分混匀,取10 g于100 mL富集培养基中37 ℃,150 r/min摇床富集24 h。吸取1 mL富集后菌液于9 mL无菌生理盐水中进行梯度稀释,移液枪吸取10-4、10-5、10-6梯度200 μL菌液于MRS琼脂培养基上均匀涂布,每个梯度做3个平行,37 ℃恒温培养48 h,挑取疑似乳酸菌且形态不同的单菌落多次平板划线,至显微镜观察为纯种菌落,进行革兰氏染色和过氧化氢酶实验,将革兰氏染色呈阳性,过氧化氢酶呈阴性菌株暂定为乳酸菌,并进行菌落及细胞形态的记录,用50%(体积分数)的甘油溶液于-80 ℃冰箱保藏备用。
1.3.1.2 高产脂肪酶乳酸菌的初筛
参照ESTEBAN-TORRES等[9]的实验方法并做适当修改。将样品中筛选出暂定为乳酸菌的菌株于种子培养基中培养至对数期,移液枪吸取100 μL菌液注入三丁酸甘油酯琼脂培养基上的牛津杯中,37 ℃培养3~5 d,观察是否具有透明圈并记录直径,选择透明圈直径较大的菌株进行生物学鉴定及复筛。
1.3.1.3 高产脂肪酶乳酸菌生物学鉴定
使用细菌基因组DNA提取试剂盒(北京天根生化科技有限公司)提取菌株DNA,并检测其纯度,以便后续使用。
PCR扩增引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGAC-TT-3′);扩增体系(50 μL)为2×Taq Master Mix 25 μL,上下游引物各2 μL,模板DNA 2 μL,ddH2O补足50 μL。PCR反应条件:95 ℃预变性10 min,95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,循环34次,最后72 ℃ 延伸10 min。
由上海生工生物科技有限公司进行16S rDNA测序,测序结果经NCBI数据库中进行Blast序列同源性比对,用MAGE 7.0软件构建系统发育树。
1.3.1.4 高产脂肪酶乳酸菌的复筛
参考江慧芳等[10]的方法并做适当修改。将初筛得到的产生透明圈较大且16S rDNA鉴定为乳酸菌的菌株进行脂肪酶活力测定。脂肪酶活性单位定义:37 ℃中1 mL酶液1 min水解橄榄油生成1 μmol脂肪酸为1个酶活单位。
1.3.1.5 粗酶液的制备
将筛出的产酶优良的乳酸菌接种于10 mL种子培养基,37 ℃培养24 h,按2%的接种量接种至10 mL 发酵培养基中,37 ℃培养48 h得到发酵液,参照董娟[11]的方法对粗酶液进行提取。
1.3.1.6 脂肪酶活力的测定
使用脂肪酶活性检测试剂盒(北京索莱宝生物科技有限公司)测定脂肪酶活力。计算如公式(1)所示:

(1)
式中:T,催化反应时间;m,发酵液稀释倍数。
1.3.2 高产脂肪酶乳酸菌产酶特性研究
1.3.2.1 培养时间及温度对菌株产脂肪酶的影响
将目标菌接种于10 mL 种子培养基中,37 ℃培养24 h后,按2%的接种量转接至发酵培养基中,于不同温度(25、30、35、37、40、45 ℃)下180 r/min摇床培养,每12 h于710 nm处测定吸光值,每组测3个平行取平均值。
1.3.2.2 培养基初始pH值对菌株产脂肪酶的影响
参考刘延波等[12]的方法做少量修改。将目标菌接种于10 mL 种子培养基中,37 ℃培养24 h,按2%的接种量转接至发酵培养基中,将发酵培养基pH值分别调节为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,在37 ℃培养48 h后测定酶活力,每组测3个平行。
1.3.2.3 接种量对菌株产脂肪酶的影响
参考胡珺等[13]的实验方法并做适当修改。将目标菌接种在种子培养基中于37 ℃培养24 h,分别按0.5%、1%、2%、4%、6%的接种量在50 mL发酵培养基中37 ℃培养48 h后测酶活力。
1.3.2.4 不同表面活性剂对菌株产脂肪酶的影响
参考ZHANG等[14]的方法并做少量修改。将乳酸菌接种于种子培养基,37 ℃培养24 h,按2%的接种量转接至分别添加10%(体积分数)Tween 80、Tween 20、Trition X-100、PVA的发酵培养基中,以不添加表面活性剂的培养基为空白对照,将最高酶活记为100%,在37 ℃培养48 h后计算每组相对酶活,每组测3个平行。
1.3.3 脂肪酶酶学性质的研究
1.3.3.1 不同温度对脂肪酶的影响
将制备好的酶液分别在10~60 ℃下保温20 min后测定酶活力,每个温度测3个平行。
1.3.3.2 pH值对脂肪酶的影响
参照TURATI等[15]的方法并做适当修改。将酶液pH值调节为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,在最适条件下保温30 min后测定酶活力,每组测3个平行。
1.3.3.3 不同金属离子和抑制剂对脂肪酶的影响
在制备好的酶液中分别加入5和10 mmol/L的K+、Ca2+、Na+、Mg2+、Al3+、Fe2+、Fe3+、Cu2+、Zn2+、Mn2+、EDTA,在最适条件下保温20 min后测定酶活力,将未添加金属离子的酶液活力记为100%,计算相对酶活力以确定不同金属离子及抑制剂对脂肪酶活力的影响。
1.4 数据与处理
上述实验数据使用SPSS 22.0分析,用Origin 8.5作图,每组实验均设置3个平行且测定3次,数据结果采用均值±标准差形式,数据分析当P<0.05为显著性差异。
2 结果与分析
2.1 产脂肪酶乳酸菌的筛选
目前,已有报道从土壤、污水、食堂废弃物等环境中分离产脂肪酶的霉菌[16-17],而对来自食品中乳酸菌产脂肪酶的研究并不多。本实验从奶酪样品中分离到282株纯培养物,经革兰氏染色、酶触实验将267株暂定为乳酸菌。初筛有35株菌产生明显透明圈,其中T1-3、T1-5、B2-5产透明圈较大,直径最大为15.6 mm。具体结果如表1。

表1 产脂肪乳酸菌筛选结果Table 1 Screening results of fat producing lactic acid bacteria
根据脂肪酶标准曲线制作方法,得出油酸标准工作曲线线性回归方程为y=0.007 8x+0.012 1,线性相关系数R2=0.999 7,线性关系较好。利用铜皂法对初筛的35株菌进行酶活力测定,结果显示B2-5、T5-16、H1-6具有较高的酶活力。综合初筛和复筛结果,后续实验选择T1-3、T1-5、H1-6、B2-5进行产酶特性及酶学性质的研究。
2.2 乳酸菌的鉴定
将筛选出的35株产透明圈较大菌株进行16S rDNA鉴定,确定35株均为乳酸菌。结合透明圈直径和酶活确定T1-3、T1-5、H1-6、B2-5产脂肪酶较好,菌落形态及革兰氏染色后细胞形态如图1所示。通过16S rDNA基因检测分析,B2-5与植物乳杆菌(Lactobacillusplantarum)同源性最高(100%);T1-5和T1-3与融合魏斯氏菌(Weissellaconfusa)同源性最高(100%);H1-6与瑞士乳杆菌(Lactobacillushelveticus)具有100%同源性。
目前用于奶酪发酵的乳酸菌多为植物乳杆菌、发酵乳杆菌、瑞士乳杆菌等,魏斯氏菌是发酵豆制品、发酵肉制品中常见的乳酸菌,而其作为乳品中产脂肪酶乳酸菌的研究鲜有报道[18]。有研究表明[19]魏斯氏菌具有一定的耐人工肠液和降胆固醇的益生特性,且具有较好的耐酸耐胆碱盐性质,对大肠杆菌、金黄色葡萄球菌和沙门氏菌有明显抑制效果。

a-菌落形态;b-革兰氏染色后细胞形态图1 高产脂肪酶菌株的菌落形态和细胞形态Fig.1 Colony morphology and cell morphology of the high-producing lipase strain
2.3 产脂肪酶乳酸菌的产酶特性分析
2.3.1 培养温度对菌株产脂肪酶的影响
温度是微生物生长代谢的重要影响因素之一,图2显示随着温度的上升,菌株产酶能力逐渐增强,B2-5 和H1-6在37 ℃产生脂肪酶活力最高,T1-3和T1-5在35 ℃产酶效果最好。之后随着温度的上升产酶活力均有所下降,B2-5产酶能力受温度影响较大,但较其他3株菌产酶活力高,最适温度可达3.85 U/mL。
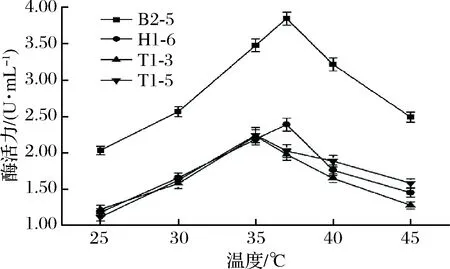
图2 培养温度对菌株产脂肪酶的影响Fig.2 Influence of culture temperature on lipase production by strains
2.3.2 培养时间对菌株产脂肪酶的影响
图3为培养时间对菌株产酶的影响,当培养时间为36 h时,H1-6、B2-5产酶活力最高,分别为2.65、4.26 U/mL,培养时间过长,发酵液酶活力明显下降(P<0.05),发酵72 h菌株B2-5的酶活力仅为最高点的42.78%;T1-5、T1-3在发酵48 h达到最大酶活力分别为1.98、2.02 U/mL,随后缓慢下降至 1.27 U/mL 左右。
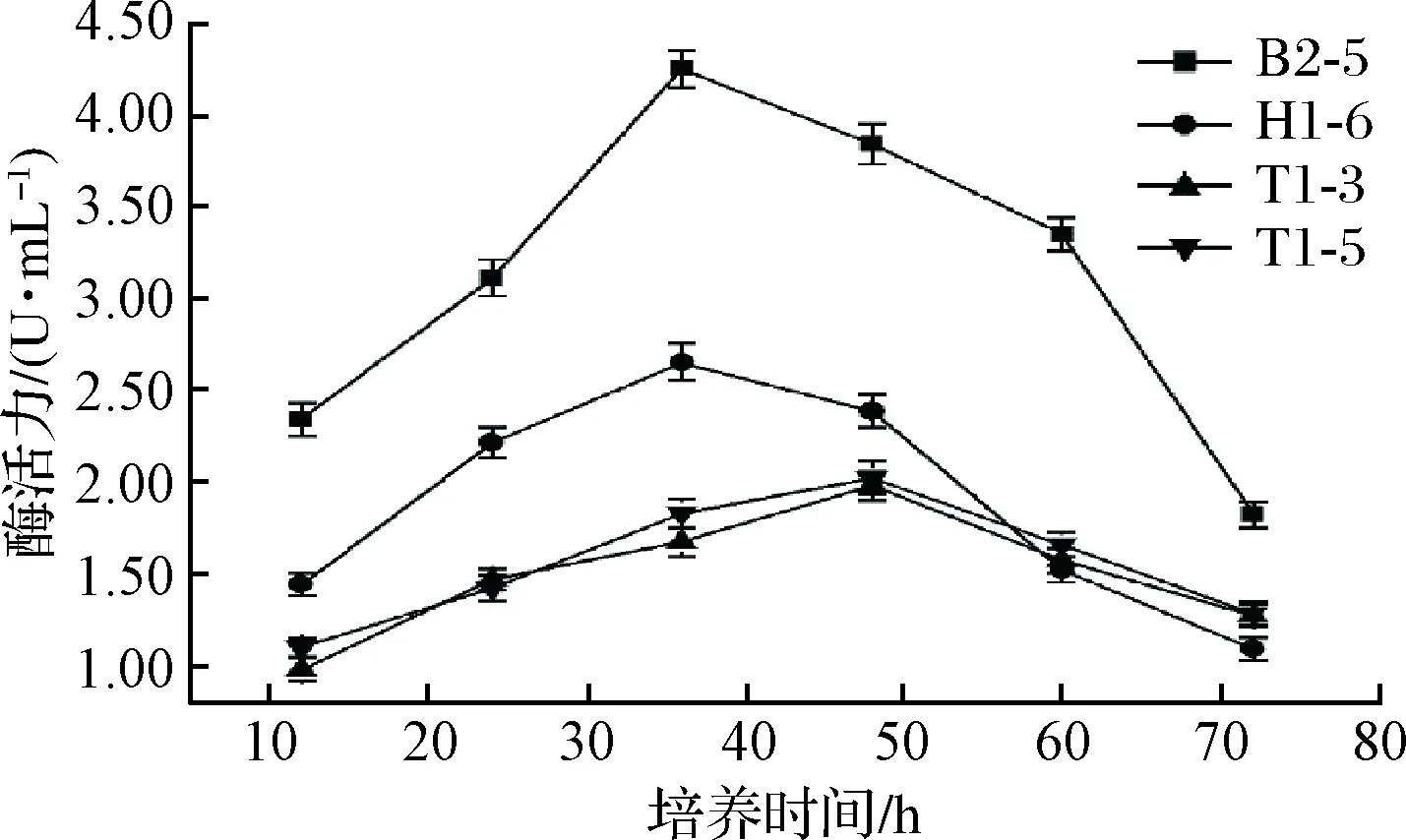
图3 培养时间对菌株产脂肪酶的影响Fig.3 Influence of culture time on lipase production by strains
2.3.3 培养基初始pH值对菌株产脂肪酶的影响
4株乳酸菌的产酶能力随发酵液初始pH的增大呈现先升高后降低的趋势(图4),当初始pH=7时,T1-3和B2-5产酶活力最高,B2-5酶活力可达4.02 U/mL;当pH>7时,酶活力大幅下降(P<0.05),因此中性环境更适合T1-3、B2-5发酵产酶。发酵液初始pH值为6时,菌株T1-5和H1-6达到最大酶活力,此时酶活力分别为2.81、2.48 U/mL,之后随着pH值的增大,产酶效果迅速下降。景智波等[20]研究在发酵培养基初始pH值为6时,目标乳酸菌具有最大酶活,这与本研究结果较为相似。

图4 培养基初始pH值对菌株产脂肪酶的影响Fig.4 Effect of the initial pH on lipase production by the strain
2.3.4 不同接种量对菌株产脂肪酶的影响
微生物接种量适宜有利于在较短发酵时间内获得足够的菌体量,利于产酶,如果接种量过少,菌体生物量增长缓慢,则会延长发酵周期;反之又会导致菌体增长过快,代谢产物增多,培养基黏度增大,致使溶氧不足等问题,不利于产酶[11]。本实验中4株乳酸菌产酶受接种量的影响见图5,当接种量为4%,B2-5产酶活力最高;接种量为2%,T1-3、T1-5和H1-6产生的酶活力可达最大值,证明该接种量最利于菌株产酶,这与张晶晶等[21]研究结果比较相似。
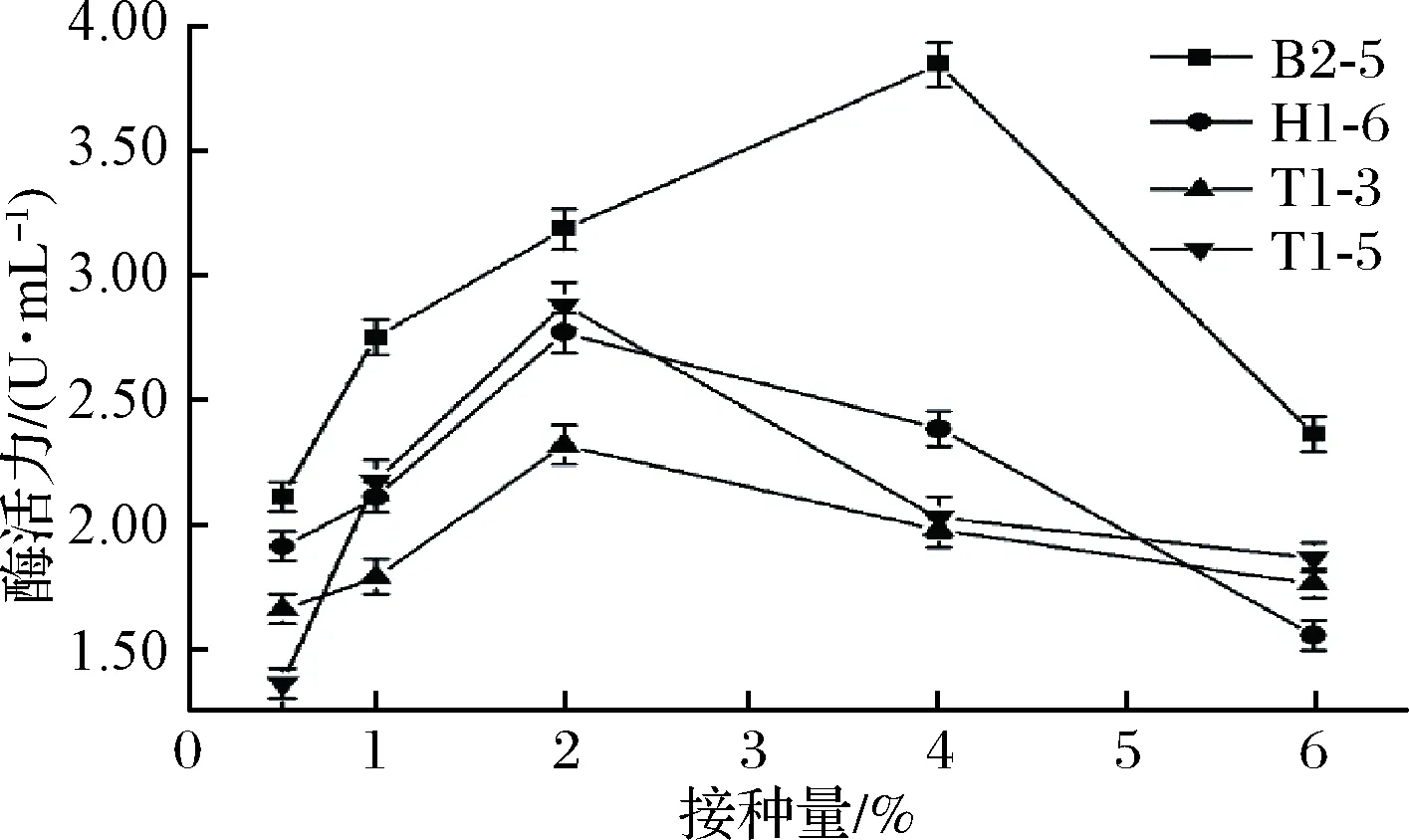
图5 不同接种量对菌株产脂肪酶的影响Fig.5 Effect of different inoculum on lipase production by strains
2.3.5 不同表面活性剂对菌株产脂肪酶的影响
不同表面活性剂对4株产酶乳酸菌的影响如图6所示,在添加PVA后菌株产酶活力均提高了30%~40%不等,确定PVA为最佳表面活性剂。与对照组相比,Tween 80、Tween 20、Triton X-100的添加对4株乳酸菌产酶能力均有不同程度的抑制作用,Tween 80的抑制作用最明显,其次是Triton X-100,这与CORZO等[22]的研究结果较不同,可能是由产酶菌株不同而导致的。

图6 不同表面活性剂对菌株产脂肪酶的影响Fig.6 Effects of different surfactants on lipase production by strains
2.4 菌株脂肪酶的酶学性质
2.4.1 温度对脂肪酶活力的影响
4株乳酸菌所产脂肪酶活力分别在35、40 ℃达到了峰值(图7),B2-5的脂肪酶活力在40 ℃约为5.02 U/mL;菌株T1-5、H1-6、T1-3的酶活力与各自最低点相比分别提高了约145%、126%和146%,当环境温度高于最适温度时,酶活力大幅度下降(P<0.05)。张传丽等[23]相关研究中得到脂肪酶最适催化温度为50 ℃,当温度升高至90 ℃时,酶活力仅为最高点的20%,这一变化趋势与本研究结果相似。综上所述,4株乳酸菌所产的脂肪酶均属于中温脂肪酶。
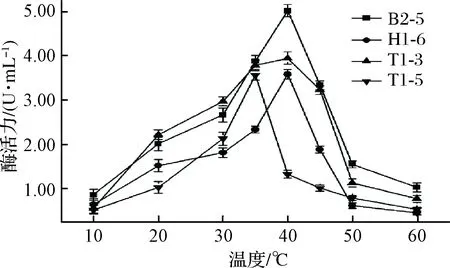
图7 温度对脂肪酶活性的影响Fig.7 Effect of temperature on lipase activity
2.4.2 不同pH值对脂肪酶活力的影响
乳酸菌的大量繁殖会使环境pH降低,因此确定脂肪酶的耐酸性十分重要[24]。由图8可知,菌株H1-6和B2-5的脂肪酶在pH值为6时活力最高,分别为3.12、4.89 U/mL;当pH>6时酶活力迅速下降(P<0.05)。融合魏斯氏菌T1-3和T1-5的脂肪酶最适作用pH值为5;环境pH>5时酶活力明显受到抑制。而郭冉冉[25]在酶学性质研究中发现产酶菌株酶活力随pH增大逐渐上升,在pH=9.0达到极值,这可能是样品来源、产酶菌株不同导致脂肪酶之间存在差异。总体来看4株乳酸菌产生的胞外脂肪酶在酸性环境下均有良好的酶活力,具备较好的耐酸能力,属于酸性脂肪酶。

图8 不同pH值对脂肪酶活性的影响Fig.8 Effect of different pH on lipase activity
2.4.3 不同金属离子及抑制剂对脂肪酶活力的影响
食品中通常会由于生产加工或自身因素而含有一些金属离子,如肉制品加工过程中会使用含Na+、K+、Mg2+的盐,牛乳中富含K+、Mg2+、Zn2+、Ca2+、Na+,且会因气候、饲料、动物健康情况发生变化[26]。因此本实验将5、10 mmol/L的不同金属离子及EDTA抑制剂添加到发酵培养基中,由表2和表3可知,K+、Na+、Fe2+、Mn2+对4株乳酸菌脂肪酶均有明显促进作用(P<0.05),与对照组相比,Fe2+和K+显著提高2株融合魏斯氏菌的酶活力(P<0.05),在5 mmol/L Na+、Mn2+存在的情况下, B2-5脂肪酶活力分别提高了约15%和17%,将离子浓度升高为10 mmol/L时,酶活力继续提高;同样地,5 mmol/L的Mn2+使H1-6的酶活力提高了约22%;Mn2+也可刺激T1-3和T1-5的脂肪酶活力有所提升,TURATI等[15]研究表明Mn2+不仅可以显著提高脂肪酶活力,还能够获得较高的稳定性。
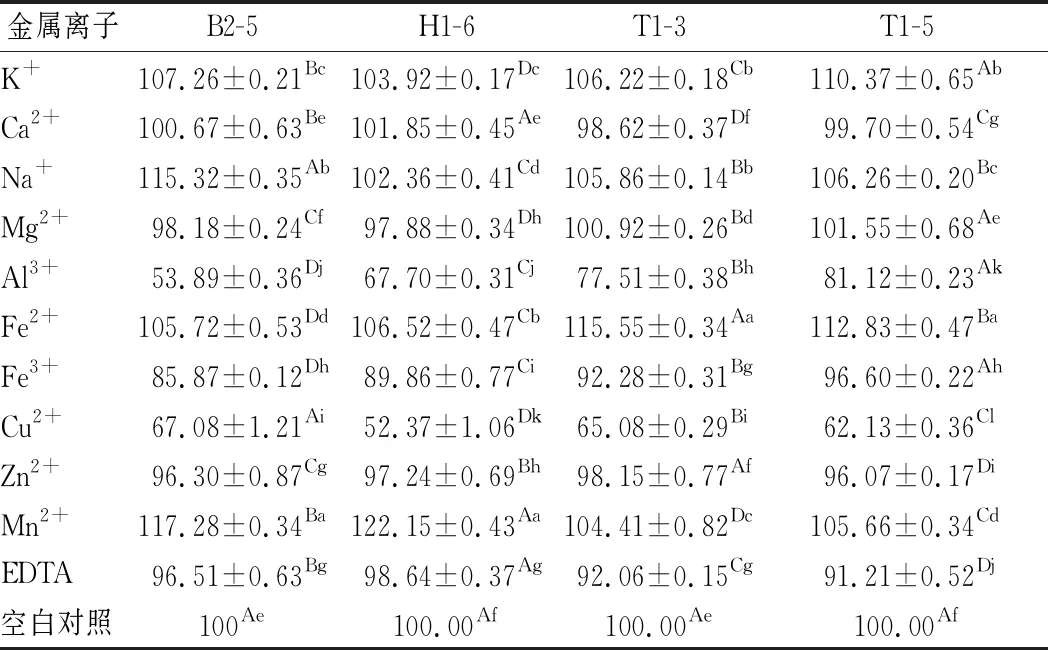
表2 5 mmol/L不同金属离子及抑制剂对脂肪酶活力的影响Table 2 Effects of 5 mmol/L different metal ions and inhibitors on lipase activity

表3 10 mmol/L不同金属离子及抑制剂对脂肪酶活性的影响Table 3 Effects of 10 mmol/L different metal ions and inhibitors on lipase activity
相反,与对照组相比,Cu2+、Al3+、Fe3+和EDTA的存在对脂肪酶活力有着不同程度的显著抑制作用(P<0.05),10 mmol/L Al3+可抑制B2-5脂肪酶约65%的活性;Cu2+无论浓度高低均能抑制H1-6约50%的酶活,这与周晶[27]的研究结果相似;Ca2+和Mg2+的存在对脂肪酶活力影响较小;KRETZA等[28]研究发现Zn2+对脂肪酶活力有轻微抑制作用,与本文结果相似。
3 结论
本研究利用传统培养法结合三丁酸甘油酯平板法和铜皂法从267株乳酸菌中筛选出4株高产脂肪酶乳酸菌,分别为B2-5(L.plantarum)、T1-5(W.confusa)、T1-3(W.confusa)、H1-6(L.helveticus)。
结果表明PVA是促进4株乳酸菌产脂肪酶的最佳表面活性剂,在35~40 ℃的中酸性初始培养基中产酶效果最好。接种量对乳酸菌产酶影响实验中发现,当接种量为4%时,B2-5产生的酶活力最高;接种量为2%时,T1-3和T1-5、H1-6的酶活力可达峰值。
在酶学特性分析实验中,35~40 ℃为脂肪酶最适催化环境,4株乳酸菌所产脂肪酶均为酸性脂肪酶,K+、Na+、Fe2+、Mn2+的存在对脂肪酶活力有明显提升(P<0.05),而Cu2+、Al3+能明显抑制其活力。
总体来看,W.confuseT1-3和T1-5对产酶环境的耐受性较好,L.plantarumB2-5在37 ℃,以2%的接种量于初始pH值为7且添加了PVA为表面活性剂的发酵培养基中发酵48 h后,产生的脂肪酶活力可达5.29 U/mL,产脂肪酶能力最强。满丽莉等[29]从内蒙古酸马奶中分离出的L.plantarumMXG-68对Caco-2细胞的黏附率高达64%,且对多种抗菌药物均表现敏感性,能够耐受极端环境压力、抑制肠道致病菌。因此植物乳杆菌和融合魏斯氏菌可作为发酵乳品中潜在益生菌,应用前景广阔。
