细胞学检查结合BRAF V600E基因检测在TIRADS 4类甲状腺结节定性诊断中的价值
2021-06-07张柳婷陈松旺赵燕妹
张柳婷,陈松旺,赵燕妹
南京医科大学附属南京医院(南京市第一医院)超声科,江苏 南京 210000
甲状腺癌是常见的内分泌系统恶性肿瘤之一,我国每1 000人中约90人发病,且发病率呈现城市地区高于农村地区、女性高于男性的分布特点[1]。韩国学者Kwak等[2]提出的甲状腺影像报告和数据系统(Thyroid Imaging Reporting and Data System,TI-RADS)提示4类甲状腺结节恶性概率为3.3%~72.4%,仍需甲状腺结节活检才可明确结节的性质。美国甲状腺学会(American Thyroid Association,ATA)认为超声引导下细针抽吸活组织检查(ultrasound-guided fine-needle aspiration biopsy,US-FNAB)是诊断甲状腺结节最准确、最经济的方法[3],现已成为鉴别甲状腺结节性质和病理学类型的一线方法,但是其结果存在假阴性、穿刺不满意的情况[4-6],因此提高甲状腺结节定性诊断的准确度还需要进一步的辅助诊断方法。甲状腺乳头状癌(papillary thyroid cancer,PTC)是甲状腺癌中最常见的组织学类型[7],而PTC患者中BRAF V600E突变率可高达87.69%[8-9]。故本研究分析了2019年7月—2020年3月于南京医科大学附属南京医院(南京市第一医院)行US-FNAB及BRAF V600E基因检测的178例TI-RADS 4类甲状腺结节患者资料,旨在探讨细胞学检查结合BRAF V600E基因检测在TI-RADS 4类甲状腺结节定性诊断中的价值,为临床制订个体化治疗方案提供依据。
1 资料和方法
1.1 一般资料
收集2019年7月—2020年3月行US-FNAB、BRAF V600E基因检测并且有手术后病理学检查结果的TI-RADS 4类结节患者。TI-RADS 4类标准:根据可疑恶性超声表现(实性成分、低回声、极低回声、微分叶或不规则边缘、微钙化和纵横比>1)划分,具有1项可疑恶性超声表现为TI-RADS 4a类,有2项可疑恶性超声表现为TI-RADS 4b类,有3、4项可疑恶性超声表现为TI-RADS 4c类。
纳入标准:① 于南京医科大学附属南京医院(南京市第一医院)行常规超声检查,且TI-RADS分类为4类的甲状腺结节(包括4a~4c);② 于南京医科大学附属南京医院(南京市第一医院)行US-FNAB及BRAF V600E基因检测;③ 有明确的术后组织病理学检查结果。共178例患者纳入研究,其中女性130例,男性48例,平均年龄(45.6±12.1)岁,平均结节直径为(10.76±6.16)mm。
1.2 方法
1.2.1 US-FNAB标本采集
患者签署知情同意书后,由副主任医师以上的高年资医师完成US-FNAB。采用意大利Esaote公司的MyLab 90彩色多普勒超声诊断仪,线阵探头频率为5~12 MHz,患者取仰卧位,先常规扫查甲状腺,定位甲状腺结节后消毒铺巾,2%利多卡因溶液局部浸润麻醉,然后在超声引导下,将5 mL注射器的针头推至结节中心并保持注射器的负压状态(图1),反复提拉注射器后得到足够的细胞,将其推至玻片上涂片,然后将玻片置于95%乙醇溶液中固定15 min,针筒内残余细胞用液基细胞保存液冲洗保存,重复取样过程3、4次,用于细胞病理学诊断。最后一次取样后,将注射器内的标本注入装有细胞保存液的Ependorf试管内保存,用于BRAFV600E基因检测。

图1 甲状腺结节行US-FNAB术前及术中影像
1.2.2 US-FNAB标本细胞病理学判读
由3、4名经验丰富的病理科医师共同完成判读过程,根据Bethesda报告系统[10]将结果分为6类,Ⅰ类:标本无法诊断或不满意,标本中<6个滤泡细胞团,且每团细胞<10个;Ⅱ类:良性病变;Ⅲ类:意义不明确的细胞非典型病变或意义不明确的滤泡性病变;Ⅳ类:滤泡性肿瘤或可疑滤泡性肿瘤;Ⅴ类:可疑恶性肿瘤;Ⅵ类:恶性肿瘤。根据细胞学诊断的结果将结节分为两组,A组由Bethesda Ⅱ类、Ⅴ类和Ⅵ类构成,为细胞学诊断确切组,B组由Bethesda Ⅰ类、Ⅲ类及Ⅳ类构成,为细胞学诊断模糊组。
1.2.3BRAFV600E检测
使用德国Qiagen公司QIAamp DNA Micro Kit提取试剂盒抽提FNAB标本的DNA,采用厦门艾德生物医药科技股份有限公司人类BRAFV600E ARMS-聚合酶链反应(polymerase chain reaction,PCR)试剂盒进行检测,严格按照说明书步骤操作,在实时PCR仪中打开设置窗口并设定循环条件:95 ℃ 5 min(1个循环);95 ℃25 s、64 ℃ 20 s、72 ℃ 20 s(15个循环);93 ℃25 s、60 ℃ 35 s、72 ℃ 20 s(31个循环)。在60 ℃时收集突变和内控信号,执行实时PCR,并保存文件。
1.3 统计学处理
应用SPSS 22.0软件分析研究中的数据,以术后组织病理学检查结果为标准,计算A组中细胞学检查、BRAFV600E基因检测及两种检测方法联合后鉴别TI-RADS 4类甲状腺结节的灵敏度、特异度、准确度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV),应用χ2检验比较USFNAB与两种检测方法联合的结果,P<0.05为差异有统计学意义,并采用kappa检验,比较单独细胞学检查、基因检测或二者结合后的结果与组织病理学检查结果的一致性,若κ<0为一致性弱;κ<0.7一致性一般;0.7<κ<0.9一致性较好;κ>0.9一致性极好。
2 结 果
2.1 组织病理学、BRAF V600E基因检测和Bethesda细胞学分类结果
本研究行US-FNAB和BRAFV600E基因检测的结节患者共178例,TI-RADS 4a、4b、4c类分别有32、89、57例,均行手术治疗且有组织病理学检查结果(表1)。恶性病变158例,占88.8%(158/178),包括157例PTC,1例甲状腺髓样癌(medullary thyroid cancer,MTC)。良性病变20例,占11.2%(20/178),包括结节性甲状腺肿12例,淋巴细胞性甲状腺炎7例,滤泡型肿瘤1例。

表1 TI-RADS4类甲状腺结节组织病理学情况
BRAFV600E突变型结节共126例,BRAFV600E野生型结节52例。细胞病理学检查结果Bethesda Ⅰ类2例,Ⅱ类20例,Ⅲ类9例,Ⅳ类1例,Ⅴ类142例,Ⅵ类4例。178例结节的组织病理学结果、BRAFV600E基因检测和Bethesda细胞学分类结果如表2所示。
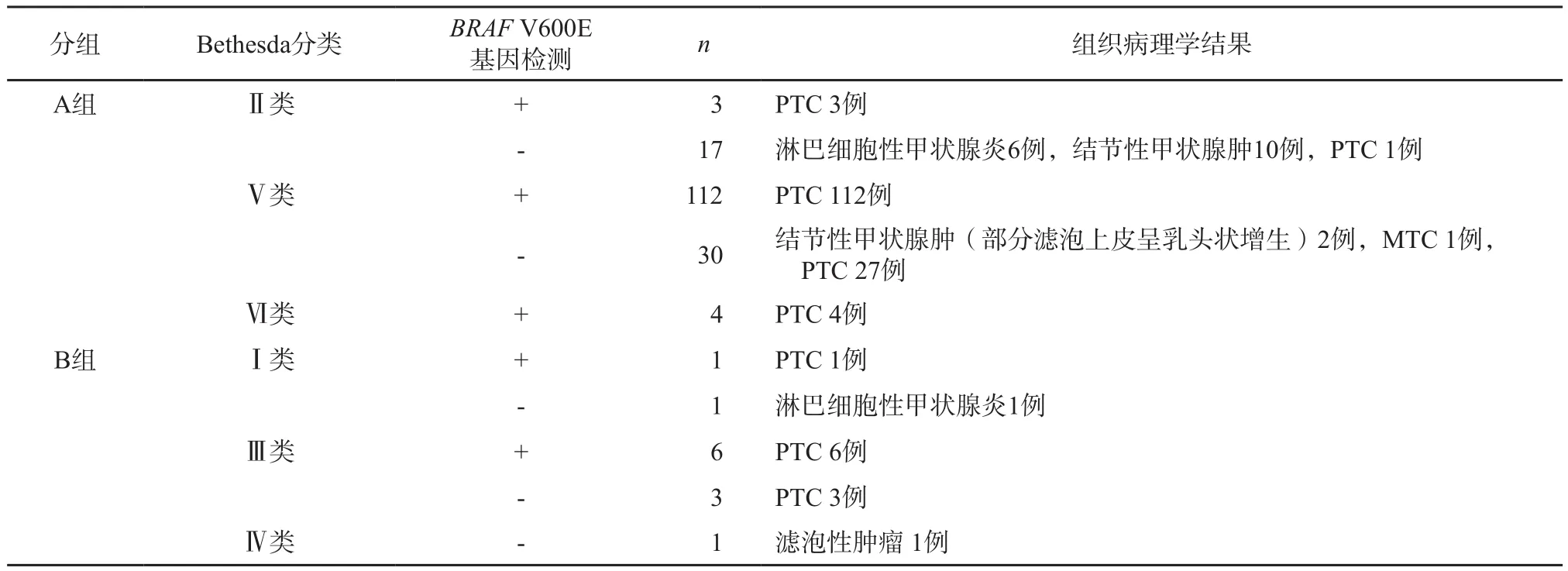
表2 178例结节患者的Bethesda细胞学分类、BRAF V600E基因检测和组织病理学结果
2.2 A组中BRAF V600E基因检测、细胞学检查及二者联合的诊断效能比较
A组中的Bethesda Ⅱ类为良性结果,Bethesda Ⅴ类和Ⅵ类为恶性结果,以术后病理学检查结果为标准,故US-FNAB鉴别结节良恶性的灵敏度、特异度及准确度分别为97.3%、88.9%及96.4%,细胞病理学检查与组织病理学检查结果一致性较好(κ=0.822±0.071)。BRAFV600E基因检测鉴别结节良恶性的灵敏度、特异度及准确度分别为80.4%、100.0%及82.5%,一致性方面,BRAFV600E检测结果与组织病理学结果一致性一般(κ=0.471±0.076)。
细胞学检查、BRAFV600E突变基因检测两种检查方法联合预测结节良恶性的灵敏度、特异度及准确度为99.3%、88.9%及98.2%,一致性检验中,细胞学检查与基因检测结合后与组织病理学检查结果一致性极好(κ=0.904±0.055,表3)。比较两种检测方法联合后与US-FNAB的诊断准确程度,χ2=74.5,P<0.05,二者之间差异有统计学意义。
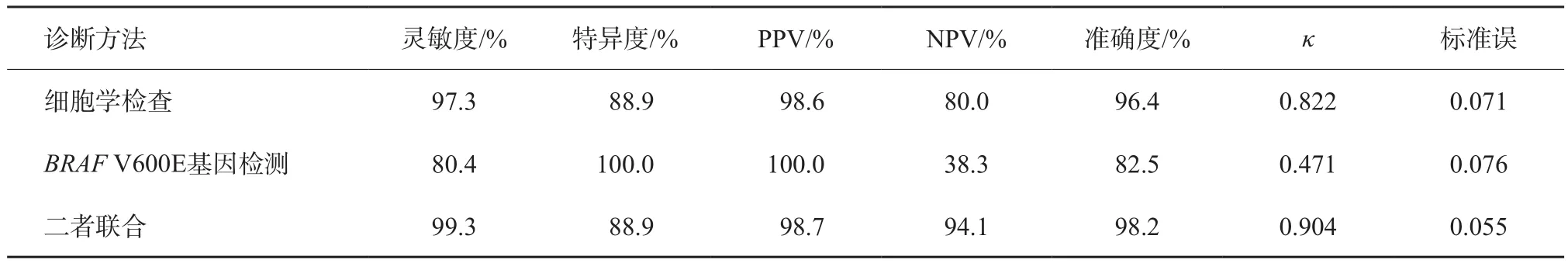
表3 3种方法的诊断效能比较
2.3 B组中BRAF V600E基因检测的诊断价值
如表2所示,B组共12例结节,共有7例发生BRAFV600E突变,均被术后组织病理学检查结果证实为PTC。其中Bethesda Ⅰ类结节中有1例存在BRAFV600E突变,9例Bethesda Ⅲ类结节中,表现为BRAFV600E突变型的共6例,Bethesda Ⅳ类结节中未发现BRAFV600E突变。
3 讨 论
US-FNAB是术前对甲状腺结节定性诊断的常用手段,而目前在行US-FNAB时增加分子标志物检测以提高其准确度受到广泛关注[11],甲状腺癌内较常见的突变类型有BRAF突变、RAS突变、RET/PTC重排、Pax8-PPARγ融合基因等[12]。B R A F基因位于人类7号染色体(7q34),其编码的蛋白质本质上为丝氨酸/苏氨酸蛋白激酶,同时也是激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的关键分子[13-14]。BRAF基因已鉴定出的40多种突变中的T1799A型占所有突变的90%以上[15],该突变为BRAF基因第15个外显子上第1 799位发生点突变,导致其编码的蛋白质第600位的缬氨酸(V)被谷氨酸(E)取代,所以也被称为BRAFV600E突变。BRAF突变使得MAPK通路被持续激活,细胞不断增殖形成肿瘤[16]。有学者[17]认为,BRAF突变在甲状腺癌的进展过程中起着关键作用,同时BRAFV600E在甲状腺癌中突变频率较高,且与高危临床病理特征、不良预后相关[18-21],而且BRAFV600E检测的灵敏度和特异度也较高[22],故本研究选择该位点。
纳入本研究的178例结节患者中共126例检测到BRAFV600E突变,术后组织病理学检查结果证实均为PTC,52例未发生BRAFV600E突变,有20例为甲状腺良性病变,BRAFV600E基因检测的特异度高达100.0%,准确度为82.5%,灵敏度为80.4%,但是与组织病理学检查结果的一致性一般,所以BRAF V600E检测结果并不能很好地反映组织病理学检查结果,而且由于BRAF V600E只存在于PTC和部分起源于PTC的间变性甲状腺癌[23],故基因检测的阴性结果并不能排除其他类型甲状腺肿瘤的可能,也就无法单独使用其对TI-RADS 4类甲状腺结节进行术前定性诊断。
本研究根据细胞病理学检查结果将结节分为两组,A组(诊断确切)和B组(诊断模糊),以明确BRAF V600E基因检测的诊断价值。A组中有20例Bethesda Ⅱ类结节中出现4例假阴性,而其中有3例发生BRAF V600E突变。因BRAF V600E突变特异度较高,若术前参照基因检测结果,便可知该3例结节为恶性肿瘤可能性大,由此可知,US-FNAB时增加BRAF V600E基因检测可在一定程度上避免假阴性结果。A组内146例Bethesda Ⅴ类结节中有2例为结节性甲状腺肿伴部分滤泡上皮呈乳头状改变,为细胞学诊断出现假阳性,基因检测结果均未见突变。正如前文所述,BRAF V600E突变仅存在于PTC中,故BRAF V600E基因检测的阴性结果并不能排除恶性肿瘤,所以其并不能避免假阳性的出现。
A组中的结节如将BRAF V600E基因检测应用于US-FNAB中,鉴别结节良恶性的准确度和灵敏度可达98.2%和99.3%,均比单独行USFNAB的96.4%和97.3%有所提升,这与部分文献[24-25]报道接近。在一致性检验中,BRAF V600E联合US-FNAB的κ值为0.904±0.055,而单独行US-FNAB的κ值为0.822±0.071,前者与组织病理学诊断的一致性极好,后者一致性较好。虽然US-FNAB的κ值小于两种检测方法联合,但是其诊断准确度与灵敏度均差于两种检测方法联合。综上,在细胞学诊断确切的结节中BRAF V600E基因检测联合US-FNAB既能及时弥补假阴性的情况,又能提高诊断准确度,继而提高术前定性诊断的效率。
而在B组(诊断模糊)中,共有10例患者的结节被组织病理学结果证实为PTC,分别为Bethesda Ⅰ类1例(50.0%),Ⅲ类9例(100.0%),其余2例均为良性病变。尽管细胞学诊断无法给予准确的结果,但是Bethesda Ⅰ类、Ⅲ类结节仍有5%~10%、6%~18%的概率为恶性肿瘤[26],可是若依靠基因检测的阳性结果,比如此次研究中B组最终诊断为PTC的结节中7例发生BRAF V600E突变,临床便可推测结节为恶性肿瘤可能性大,及时给予手术治疗避免重复行US-FNAB对患者造成经济及心理压力。故基因检测具有一定的补充作用,可通过US-FNAB时增加BRAF V600E基因检测提高恶性结节的检出率,提高术前定性诊断的准确度,这与相关文献[27]的结论一致。
本研究为回顾性研究,根据术后组织病理学检查结果收集结节信息,部分US-FNAB结果显示为良性(Bethesda Ⅱ类)的结节选择随访观察时,即使基因检测结果为BRAF V600E突变,也会因为缺乏术后组织病理学检查结果而被排除在研究范围外,造成一定程度的偏倚。由此可见,在TI-RADS 4类甲状腺结节行US-FNAB时增加BRAF V600E基因检测后诊断效率有所提升,无论细胞学诊断确切与否BRAF V600E基因检测都能够筛查出部分恶性结节,提高定性诊断的准确度。所以在TI-RADS 4类甲状腺结节中,细胞学检查结合BRAF V600E基因检测,能够提高定性诊断的效率,减少手术治疗延误的可能,而且避免重复行US-FNAB或者密切随访带来的经济及心理压力,具有在临床中广泛应用的价值。
