一株甲醇利用菌的分离、鉴定及特性研究
2021-06-04张建云谷立坤史永胜赵维文崔方凯臧亚奇
张建云,谷立坤,彭 更,史永胜,赵维文,崔方凯,臧亚奇
(1.河南工程学院 环境与生物工程学院,河南 郑州 451191;2.河南工程学院 煤化工资源综合利用与污染治理河南省工程实验室,河南 郑州 451191)
甲醇是一种重要的有机化工基础原料。甲醇可采用多种原料(如天然气、煤炭、油、乙炔尾气等)进行生产,世界甲醇生产以天然气为主,我国以煤炭为主[1]。目前,煤制甲醇的合成技术比较成熟,随着煤化工行业的快速发展,大型甲醇装置相继投产,甲醇成本日趋降低,我国的甲醇产能已经超过5 000万t/年,并呈继续增加趋势。然而国内的甲醇需求量不足一半,导致产能过剩[2-3]。因此,急需开发甲醇下游产品[4]。
甲基营养菌指的能够利用甲基化合物为唯一的碳源和能源进行生长的一类微生物,能够将自然界取之不尽、用之不竭的一碳化合物变为碳源和能源(据估计,每年大概有83~273百万t甲醇,600百万t甲烷释放到大气中[6]),可以解决发酵过程中糖原料的限制并且扩大石化原料的应用范围,因此对甲基营养型微生物的代谢研究具有重大意义。甲醇利用菌属于甲基营养型细菌,比甲烷氧化菌更容易培养,可以利用甲醇获取能量并转化为蛋白和各种次生代谢产物包括辅酶、维生素B12、吡咯喹啉醌(pyrroloquinoline quineone,PQQ)、丝氨酸、聚-β-羟丁酸(poly-β-hydroxybu tyrate,PHB)、类胡萝卜素等,这些产物可以作为药物、食品添加剂、生物防治菌剂,具有良好的应用前景。目前相对比较成熟的技术是饲料用甲醇蛋白[7],南京工业大学生物化工技术中心选育了生产甲醇蛋白的菌种,并通过实验室小试;达到1 t/年及5 t/年的产量规模[8]。义煤集团以毕赤酵母YM-SCP02作为生产菌种,得到的甲醇蛋白最高产量(细胞干质量)为19.3 g/L[9]。以甲醇为碳源的毕赤酵母表达系统已表达出了数以千计的外源蛋白,且已经有大规模工业化高密度生产的发酵工艺,表达重组蛋白时,已成功放大到10 000 L[10]。还有一些能以甲醇为唯一碳源进行生长的微生物体能够分泌附加值较高的生物活性物质[11],如:吡咯喹啉醌[12-15]、氨基酸[16-18]、维生素[19]、多糖[20]、有机酸类[21-22]等。由于甲醇的可生化性比较强,甲醇利用菌在含甲醇的工业废水的处理方面也有一定的应用价值[23-26],李宝庆等[23]筛选到一株甲醇利用菌对500 mg/L甲醇的降解率可达到97.75%,孔庆胜等[24]筛选的菌株SMD11对0.6%(V/V)甲醇的降解率为82.5%,田丹丹等[25]筛选的甲醇利用菌WGM16在60 h时对1%(V/V)甲醇的降解率为75%。
目前国内甲醇蛋白及相关生化产品的产业化尚处于起步阶段,很多关键性技术如发酵成本的降低,优质高效菌种的选育,提取工艺的优化等问题亟待探索研究。本研究从气化厂的甲醇车间分离纯化甲醇利用菌,并建立相关的微生物资源库,旨在为利用微生物资源开发甲醇下游生化产品提供理论依据和新的实验材料。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
沿河南气化厂甲醇生产线地下排污管道监测口挖取10~15 cm深度的土样,共得到7个土样,将采集的样品放于统一的样品袋中,做好标记并编号。
1.1.2 化学试剂
甲醇、磷酸氢二钾、磷酸二氢钾、硫酸铵、硝酸钾(均为分析纯):天津科密欧化学试剂有限公司;硫酸镁、氯化钙、氯化钠(均为分析纯):天津市风船化学试剂科技有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限公司;Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、GoldView I核酸染色剂:北京索莱宝科技有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker、细菌基因组DNA提取试剂盒:天根生化科技有限公司。
1.1.3 培养基
无机盐液体培养基:磷酸氢二钾7.5 g/L,磷酸二氢钾2.0 g/L,七水硫酸镁0.2 g/L,无水氯化钙0.015 g/L,氯化钠0.5 g/L,硫酸铵2.0 g/L,加蒸馏水1 L。121 ℃高压蒸汽灭菌20 min。
无机盐固体培养基:磷酸氢二钾7.5 g/L,磷酸二氢钾2.0 g/L,七水硫酸镁0.2 g/L,无水氯化钙0.015 g/L,氯化钠0.5 g/L,硫酸铵2.0 g/L,琼脂粉20 g/L,加蒸馏水1 L。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
PHS-25B型数字酸度计:上海大普仪器有限公司;752N紫外可见分光光度计:上海仪电分析仪器有限公司;HC-2064高速台式离心机:安徽中科中佳科学仪器有限公司;LDZM-60KCS-II立式压力蒸汽灭菌锅:上海申安医疗器械厂;FA2204B电子天平:上海天美天平仪器有限公司;LRH-150生化培养箱、THZ-300台式恒温摇床:上海一恒科学仪器有限公司;FC多功能酶标仪:赛默飞世尔科技(中国)有限公司;XSP-2CA双目生物显微镜:上海巴拓仪器有限公司。
1.3 方法
1.3.1 甲醇利用菌的富集、分离
配制500 mL无机盐培养基分别移取50 mL培养基在8个灭菌的250 mL锥形瓶中,标号1~8,再分别称取1~7号土样各0.5~1.0 g投入对应编号的锥形瓶中,以8号瓶作无菌对照。将8份样品分别添加2%(V/V)甲醇为碳源,恒温(34 ℃、180 r/min)富集培养48 h,第二天补加2%(V/V)甲醇,转接2次(每次培养48 h)。
菌液富集培养完成后,分别取1~8号锥形瓶中少量菌液,均匀涂布于含1.5%甲醇(V/V)的无机盐固体培养基表面,34 ℃倒置培养,每天观察菌落的生长情况(8号平板作为空白对照)。
1.3.2 甲醇利用菌的分离纯化
待1~7号培养基中明显观察到菌体生长后,挑取生长速度快的菌体转接到含1.5%(V/V)甲醇的无机盐固体培养基上,等细菌长好再次转接。第三次转接从第二次转接的平板上挑取菌体进行平板划线分离纯化,待长好后挑取划线平板上的明显的单菌落进行再一次划线分离纯化。挑取平生长状态好的单菌落转接斜面培养基进行培养(每个单菌落转接3份斜面),等斜面培养基上的菌体长好后放在4 ℃冷藏,备用。
1.3.3 菌株形态学观察和生理生化鉴定
将分离获得的生长优势菌株划线接种于含1%(V/V)甲醇的无机盐固体培养基中,34 ℃恒温培养3~5 d,观察菌落形态、色泽、质地等;挑取待测菌株苔进行革兰氏染色,采用10×100油镜,观察菌体细胞形态。细菌生理生化鉴定主要参考《常见细菌系统鉴定手册》[27],生理生化鉴定用试剂的配制方法主要参考文献[28]。
1.3.4 菌株的分子生物学鉴定
分子生物学鉴定采用16S rDNA基因序列分析法。
细菌总DNA 的提取:采用细菌基因组DNA 提取试剂盒进行提取,方法参考试剂盒说明书。
16S rDNA 基因序列的扩增:扩增引物(上游引物:27F:5'-AGA GTT TGA TCC TGG CTC AG-3',下游引物:1492R:5'-TAC GGC TAC CTT GTT ACG ACT T-3'),PCR扩增条件为94 ℃预变性5 min;95 ℃变性1 min,55 ℃退火l min,72 ℃延伸1 min(30个循环);最后在72 ℃下再延伸10 min。
16S rDNA基因序列的测序及分析:将扩增得到的16S rDNA基因序列由北京博迈德公司测序。测序结果在美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中用基本局部比对搜索工具(basic local alignment search tool,BLAST)程序进行序列比对,并使用MEGA软件(Version 5.1)中的邻接(neighbor joining,NJ)法构建微生物系统发育进化树。
1.3.5 分析检测
(1)菌体生长量的测定
从平板上挑取单菌落,接种于1.0%(V/V)甲醇为唯一碳源的无机盐液体培养基中,34 ℃、180 r/min条件下摇床振荡培养,菌体的生长量采用分光光度法测定,以波长600 nm处的光密度来表示,测定时以空白培养基作为参比。
(2)甲醇降解率的测定
用变色酸分光光度法对样品中残留的甲醇含量进行测定,参考余波等[29-30]的方法并略加改进。
a、标准曲线的绘制
分别取0.5%甲醇标准溶液0、4 μL、8 μL、12 μL、16 μL、20 μL、24 μL、28 μL、32 μL、36 μL、40 μL于4 mL离心管中用40 μL蒸馏水作为空白实验组,加入0.4 mL 25%的硫酸溶液,再加入0.2 mL 1%的高锰酸钾溶液,充分摇匀后室温放置5 min;加入0.2 mL亚硫酸钠溶液,摇匀,加入2 mL浓硫酸,摇匀后冷却至室温;加入0.2 mL 0.5%变色酸溶液,摇匀后在沸水中加热20min后,取出冷却至室温并定容至4mL,用分光光度计测定在波长574 nm下的吸光度值,并对不同甲醇绘制标准曲线。
b、培养液中甲醇残留量的测定
定量接种菌株4311的对数期培养物于以甲醇为唯一碳源的无机盐液体培养基中恒温培养,定时取样200 μL培养液,12 000 r/min离心5 min,取40 μL上清液按上述方法进行测定,并带入标准曲线回归方程计算甲醇含量。
c、甲醇降解率的计算[31]
甲醇降解率的计算公式如下:
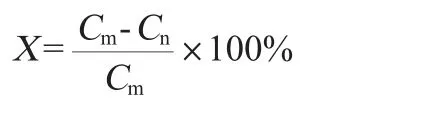
式中:X为甲醇的生物降解率,%;Cm为未接菌对照培养液中甲醇的体积分数,%;Cn为接菌处理培养液中甲醇的体积分数,%。
1.3.6 菌株生长条件和降解条件的优化
以甲醇体积分数、初始pH值、NaCl质量分数、氮源及最佳氮源添加量为影响因素,分别以菌体生长量及甲醇残留量为评价指标,考查菌株在不同培养条件下的生长和降解甲醇情况。
(1)甲醇体积分数的确定
将对数期培养物接种于甲醇体积分数分别为0、0.5%、1.0%、1.5%、2.0%的液体培养基中,同时以一组未接菌的培养基作为对照,于34 ℃、180 r/min条件下恒温振荡培养。定时取样测量其OD600nm值和甲醇含量,考察甲醇体积分数对菌株生长和降解甲醇的影响。
(2)初始pH值的测定
将对数期培养物接种于以1.0%(V/V)甲醇为唯一碳源的无机盐液体培养基中,初始pH值分别调为4.0、5.0、6.0、7.0、8.0、9.0,于34 ℃、180 r/min的条件下恒温振荡培养。定时取样测量其OD600nm值和甲醇含量,考察初始pH值对菌株生长和降解甲醇的影响。
(3)NaCl质量分数的确定
将对数期培养物接种于以1.0%(V/V)甲醇为唯一碳源,NaCl质量浓度分别为0.05%、0.50%、1.00%、2.00%、3.00%的无机盐液体培养基中,于34 ℃、180 r/min的条件下恒温振荡培养。定时取样测量其OD600nm值和甲醇含量,考察NaCl质量分数对菌株生长和降解甲醇的影响。
(4)氮源的确定
将对数期培养物接种于以1.0%(V/V)甲醇为唯一碳源的无机盐液体培养基中,培养基的氮源分别为硝酸钾、硫酸铵、蛋白胨、尿素,氮源添加量为2.0 g/L,于34 ℃、180 r/min的条件下恒温振荡培养。定时取样测量其OD600nm值和甲醇含量,考察氮源种类对菌株生长和降解甲醇的影响。
(5)氮源添加量的确定
将对数期培养物接种于以1.0%(V/V)甲醇为唯一碳源无机盐液体培养基中,培养基中蛋白胨的添加量为0.5 g/L、2.0 g/L、4.0 g/L、6.0 g/L、8.0 g/L、10.0 g/L,于34 ℃、180 r/min的条件下恒温振荡培养。定时取样测量OD600nm值和甲醇含量,考察氮源添加量对菌株生长和降解甲醇的影响。
1.3.6 菌株4311对不同浓度甲醇降解率的测定
在上述甲醇降解条件优化的工作基础上,将对数期培养物接种分别接种于以1.0%(V/V)和0.5%(V/V)甲醇为唯一碳源无机盐液体培养基中,按照最适条件进行接种培养,定时取样,采用变色酸分光光度法测定培养基内残留甲醇的含量,同时以未接种的无机盐液体培养基做为对照,计算甲醇的生物降解率,绘制甲醇降解曲线,考察菌株4311在优化后的条件下对不同浓度甲醇的降解能力。
2 结果与分析
2.1 菌株4311的鉴定
2.1.1 菌株4311的菌落和菌体形态观察
通过反复传代筛选,从7个土样中最终共筛选到16株能在1.5%(V/V)甲醇为唯一碳源无机盐固体培养基平板上快速生长的菌株,保藏于斜面培养基上,每个菌株保藏3份,共48份。4311是从4号土样中,第3批筛选出来的编号为1号的菌株。将斜面保藏的4311菌株在1.0%(V/V)甲醇为唯一碳源无机盐固体培养基平板上划线分离,34 ℃培养3~5 d,对菌株4311进行菌体、菌落形态观察,结果见图1。

图1 菌株4311的菌落(A)和细胞(B)形态Fig.1 Colony(A) and cell (B) morphology of strain 4311
由图1A可知,菌株4311的菌落呈白色,圆形,直径范围2~3 mm,中央隆起,边缘整齐,表面光滑、湿润。由图1B可知,菌株4311革兰氏染色为阴性,光学显微镜下观察为短杆状。
2.1.2 菌株4311的生理生化试验
菌株4311能够在以甲醇、甲胺为唯一碳源的无机盐培养基上生长,在LB培养基上生长状态更好,对链霉素和卡钠霉素敏感,对氨苄青霉素不敏感,不产色素,可以产吡咯喹啉醌PQQ,可以在pH值为5的培养基上生长,当NaCl含量>1.00%时几乎不生长。菌株4311的部分生理生化试验鉴定结果见表1。
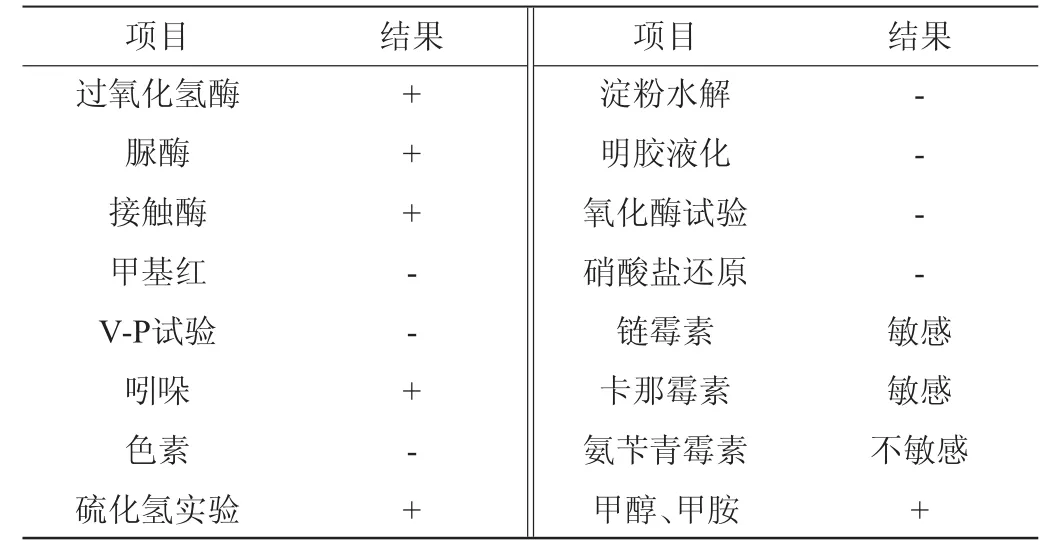
表1 菌株4311生理生化试验鉴定结果Table 1 Results of physiological and biochemical experiments identification of strain 4311
2.1.3 菌株4311的分子生物学鉴定
由图2可知,以细菌基因组DNA作为模板,以27F和1492R序列为引物,所扩增的16S rDNA的碱基片段大小在1.5 kb左右。对该16S rDNA片段序列进行测序,将测序后的结果提交至NCBI的GenBank数据库,用BLAST工具进行同源性比较结果显示,和菌株4311的16SrDNA序列同源性达到99%的有4株,同源性98%以上的有近20种,为甲基球形菌属(Methylopila)的有15株菌,分属于不同的种。其中Methylopila oligotropha最多,有4株。菌株4311系统发育树见图3。由图3可知,菌株4311与Methylopila capsulatastrain IM1和Methylopila oligotrophastrain 2395A两株菌具有最高的相似性,均为99%,与同属的Methylopila jiangsuensisstrain JZL-4和MethylopilaYHT-1的相似性为98%,菌株4311与Methylopila capsulatastrain IM1聚为一个分支。

图2 菌株4311 16S rDNA 的PCR扩增结果电泳图Fig.2 Electrophoresis of PCR amplification results of 16S rDNA of strain 4311
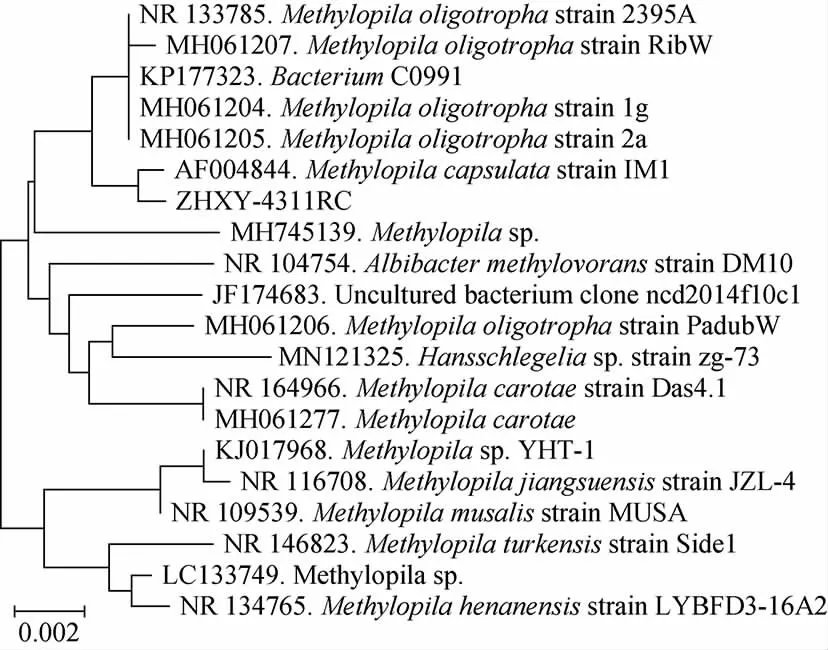
图3 基于16S rDNA序列菌株4311的系统发育树Fig.3 Phylogenetic tree of strain 4311 based on 16S rDNA sequence
综合菌体特征和生理生化特征和16S rRNA基因序列分析,菌株4311被鉴定为甲基球形菌属(Methylopilasp.),该菌株属于变形菌纲(Alphaproteobacteria),根瘤菌目(Rhizobiales),甲基包囊菌科(Methylocystaceae)。
2.2 甲醇标准曲线的绘制
由图4可知,当甲醇体积分数在0~0.6%(V/V)时,甲醇体积分数与吸光度值线性相关性良好。其标准曲线线性回归方程为y=3.058 4x-0.071 4,相关系数R2=0.993 4。
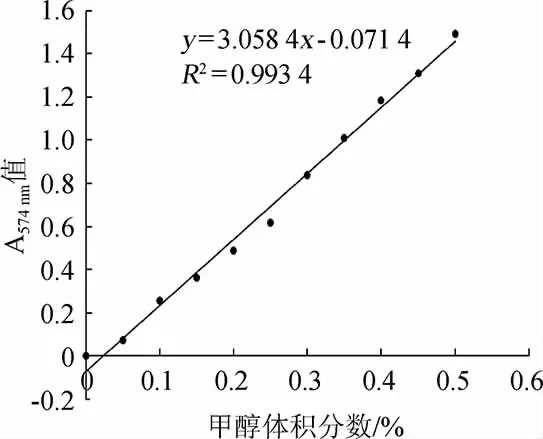
图4 甲醇标准曲线Fig.4 Standard curve of methanol determination
2.3 不同影响因素对菌株4311生长和甲醇降解条件的影响
2.3.1 不同甲醇体积分数对菌株4311生长和甲醇降解的影响
由图5A可知,当甲醇体积分数<2.0%时,菌株4311基本不长,当甲醇体积分数为1.0%~1.5%时,菌株生长达到的峰值相近,OD600nm值为0.7左右,而在甲醇体积分数为1.0%时能更快进入对数期;当甲醇体积分数为0.5%时,在前40 h内生长速度较快,40 h以后生长速度变慢,说明在生长后期甲醇体积分数0.5%不能提供足够的碳源供菌体生长。由图5B可知,在甲醇体积分数0.5%的培养体系中,培养基内甲醇含量从50~80 h之间有一个较大幅度的减少过程,而该时期菌株4311正处于对数生长期,对碳源需求量大;在甲醇体积分数为1.0%和1.5%的情况下,同样有一个甲醇含量急剧降低的过程,其时间范围均与对数生长期相对应;对于甲醇体积分数为2.0%的培养体系,几乎没有降解作用。综合菌株生长及降解甲醇能力可知,菌株生长最适的甲醇体积分数为1.0%。
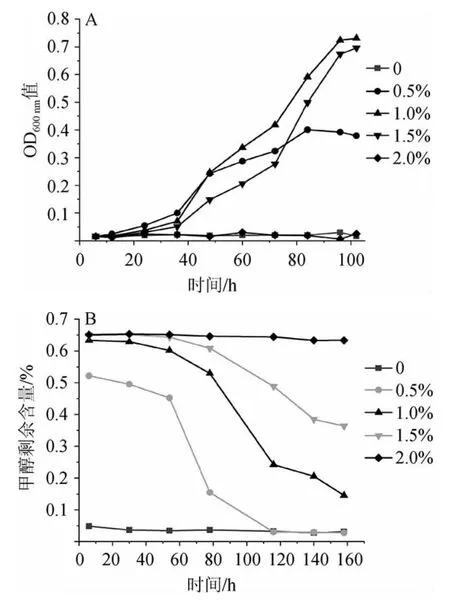
图5 不同甲醇体积分数对菌株4311生长(A)及甲醇降解(B)的影响Fig.5 Effects of different methanol volume fraction on the growth (A)and methanol degradation (B) of strain 4311
2.3.2 不同初始pH值对菌株4311生长和甲醇降解的影响
由图6A可知,与其他pH值相比,菌株4311在初始pH值5.0时生长情况最好,其他pH值时细菌生长情况明显减弱,初始pH值为9.0时细菌的生长明显受到抑制。可能与菌体自身会分泌碱性物质中和酸性培养基有关,导致细菌在前20 h所有pH梯度都有生长,但初始pH 5.0条件下的菌株生长情况因受到抑制而生长较为缓慢。40 h以后,细菌分泌的碱性物质增多,使得培养基初始pH值越来越大,初始pH值为5.0条件下的菌株继续生长,而其他条件时的菌株的生长受到抑制。由图6B可知,对于菌株4311,在初始pH值为5.0~9.0,随着pH的增大降解甲醇的速率而逐渐降低,在初始pH值为5的时候降解甲醇的速率最快,而且降解的最彻底。综合菌株生长及降解甲醇能力,菌株4311最适生长的初始pH值为5.0。
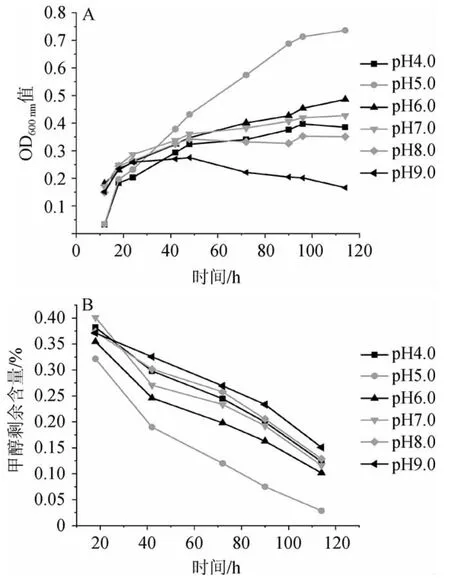
图6 不同初始pH值对菌株4311生长(A)及甲醇降解(B)的影响Fig.6 Effects of different initial pH value on the growth (A) and methanol degradation (B) of strain 4311
2.3.3 不同NaCl添加量对菌株4311生长和甲醇降解的影响
由图7A可知,当NaCl质量分数为0.05%时,菌株4311的生长情况最好;当NaCl质量分数为0.50%时,生长状态次之;当NaCl质量分数>1.00%时,细菌活性极低,基本不生长。由图7B可知,NaCl质量分数为0.05%时,菌株4311降解甲醇的能力最强,当NaCl质量分数为0.5%时降解能力次之。说明随着盐度的提高,菌株4311生长状况变差,导致降解甲醇的能力变差。筛选到的甲醇利用菌4311耐盐能力较差,当NaCl质量分数>1%时,就不能正常生长。综合菌株生长及降解甲醇能力,NaCl最适质量分数为0.05%。
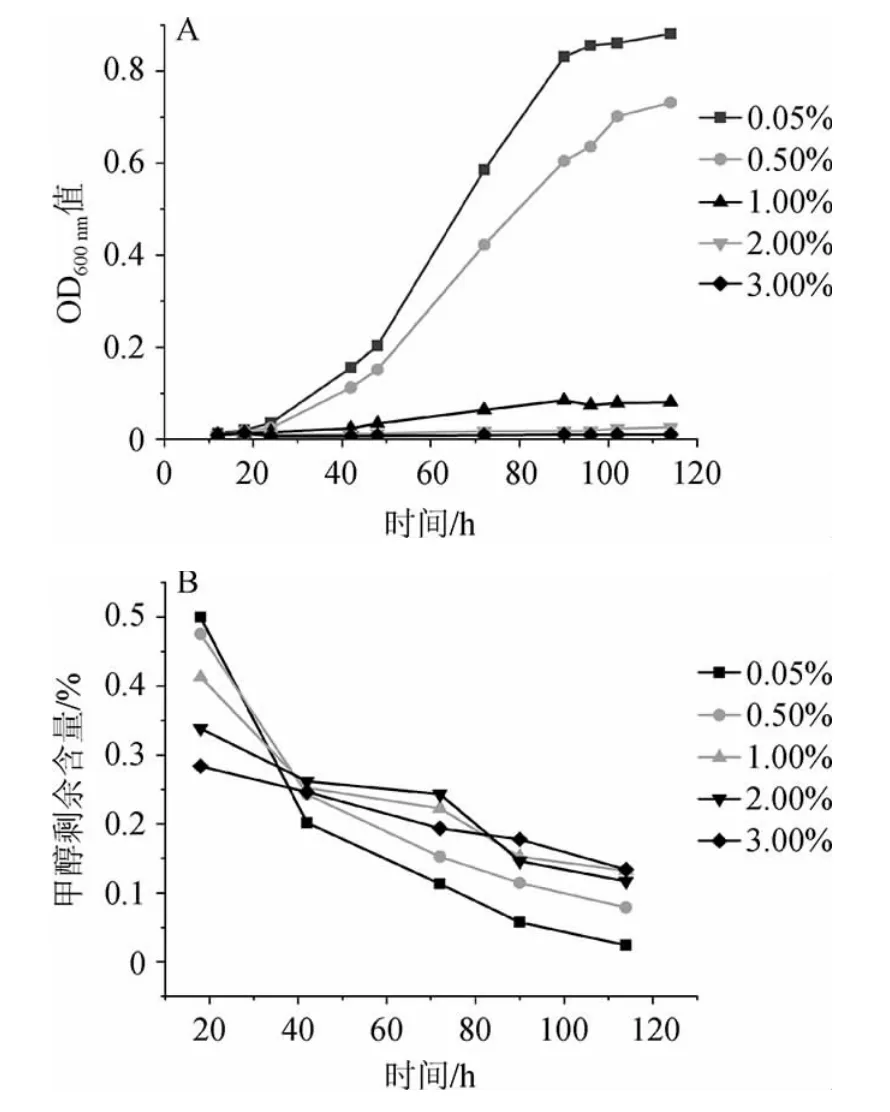
图7 不同NaCl质量分数对菌株4311生长(A)及甲醇降解(B)的影响Fig.7 Effects of different NaCl mass concentrations on the growth (A)and methanol degradation (B) of strain
2.3.4 不同氮源对菌株4311生长和甲醇降解的影响
氮源可用于合成细菌中的各种有机质,对于细菌的生长有着极其重要的作用,不同的氮源对细菌的影响也各不相同。由图8A可知,菌株4311以蛋白胨为氮源时生长速度最快,其次是硫酸铵和硝酸钾,而在尿素中生长最为缓慢,推测可能菌株4311体内脲酶分泌量低,不能很好的利用尿素做为氮源,相应地,当以蛋白胨为氮源时,菌株4311生长速度最快,其降解能力最强。沈寿国等[26]筛选出一株甲醇降解菌,其最适氮源为蛋白胨,其次是硫酸铵,在硝酸钾中不生长,其结论与本研究的相近。
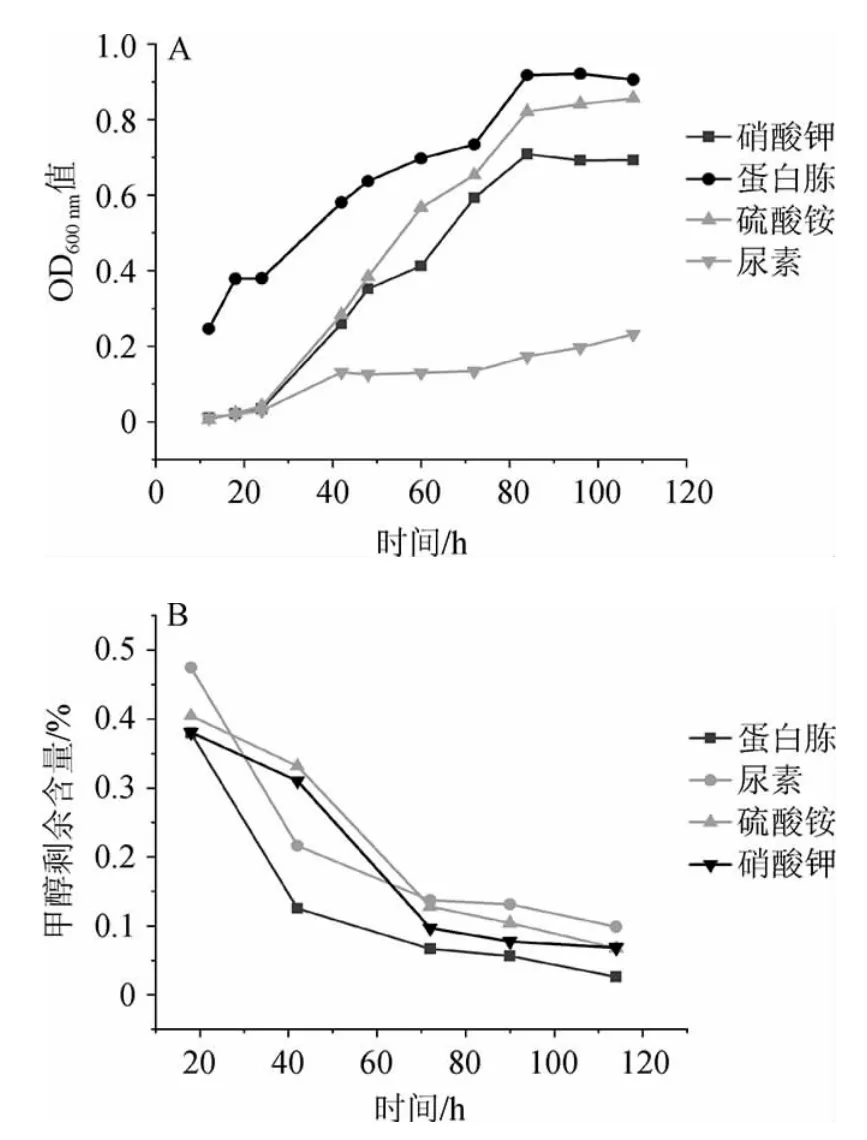
图8 不同氮源对菌株4311生长(A)及甲醇降解(B)的影响Fig.8 Effects of different nitrogen sources on growth (A) and methanol degradation (B) of strain 4311
2.3.5 不同氮源添加量对菌株4311生长和甲醇降解的影响
由图9A可知,蛋白胨添加量在0~10 g/L范围内,蛋白胨添加量越高,菌体生长速度越快;当以10 g/L的蛋白胨为氮源时,菌体的OD600nm值在96 h可以达到1.1左右。在培养过程中,当以硫酸铵为氮源时,培养基中的菌体在培养4 d以后溶液出现聚集现象,而以蛋白胨为氮源时,菌体聚集的现象会延迟1~2 d出现。由图9B可知,当蛋白胨添加量为2 g/L,菌株4311降解能力最强,当蛋白胨添加量为0.5 g/L,降解能力略次之。蛋白胨添加量为10 g/L时,菌株4311生长状态最好,但降解能力最差,其原因可能是蛋白胨中含有碳源,会和甲醇起到竞争作用,影响到甲醇的利用。综合菌株生长及降解甲醇能力,蛋白胨最适添加量为2 g/L。
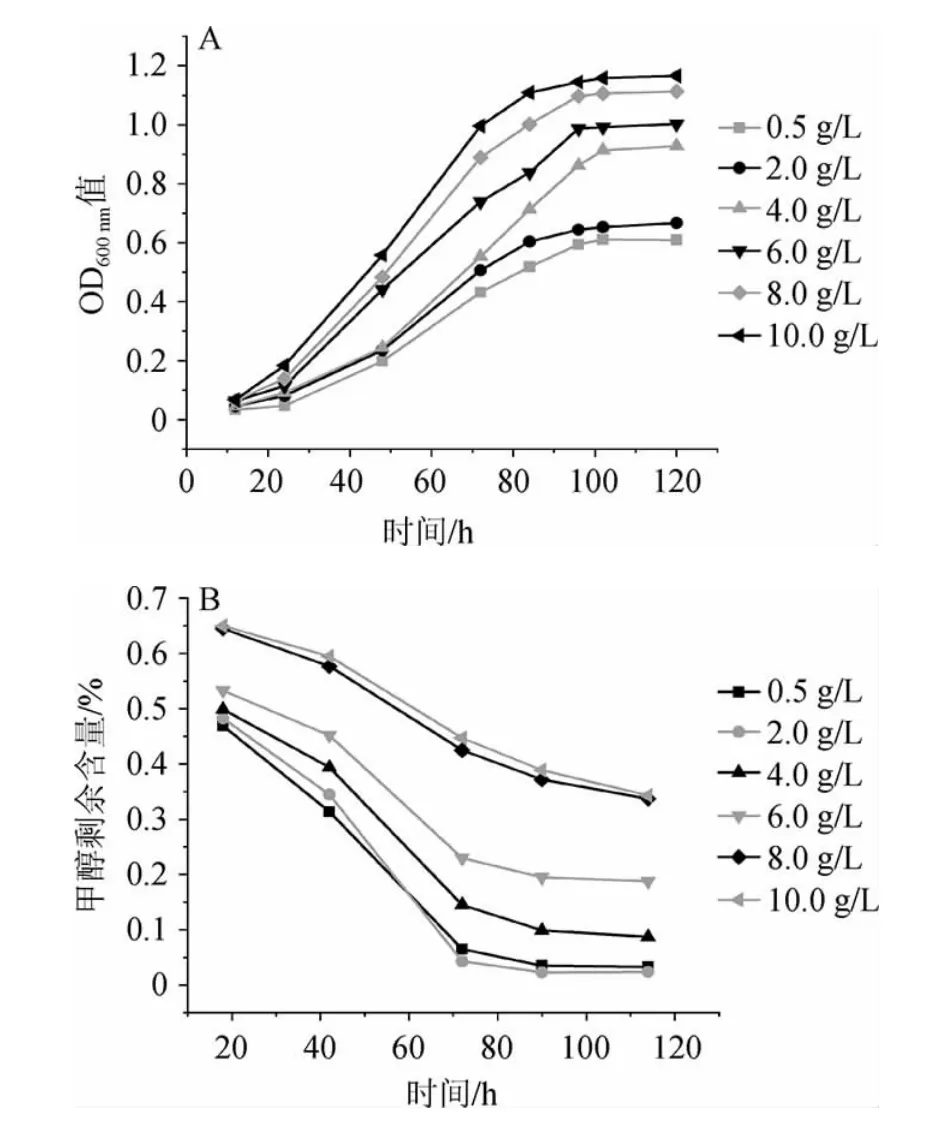
图9 不同蛋白胨添加量对菌株4311生长(A)及甲醇降解(B)的影响Fig.9 Effects of different peptone addition on growth (A) and methanol degradation (B) of strain 4311
3 结论
本研究从义马气化厂甲醇车间附近的土壤中筛选到一株甲醇利用菌4311。分析菌株的16S rDNA序列并结合其形态特征和生理生化特征,鉴定菌株4311为甲基球形菌属(Methylopilasp.)。生长特性研究表明,该菌株的最适生长及降解条件为甲醇体积分数1.0%,初始pH 值5.0,氯化钠质量分数0.05%,最适氮源为蛋白胨,其添加量为2 g/L。在此最佳培养条件下,1%(V/V)甲醇的降解率最高可以达到85%。
